
- •Обмен белков
- •1. Азотистый баланс
- •2. Переваривание белков в желудочно-кишечном тракте
- •3. Обмен белков в тканях
- •4. Катаболизм аминокислот
- •5. Обмен аммиака: источники, связывание в тканях, транспорт
- •Глутаминсинтетаза обладает высоким сродством к аммиаку, и благодаря этой реакции в крови и тканях поддерживается низкая концентрация nh3.
- •Образование и экскреция аммиака в почках
- •Биосинтез мочевины
- •Биологическая роль синтеза мочевины
- •Регуляция биосинтеза мочевины
- •Энергетическая цена синтеза мочевины
- •Гипераммониемия
- •6. Судьба углеродных скелетов аминокислот
- •7. Биосинтез заменимых аминокислот
- •Непосредственно путем переаминирования метаболитов опк с глутаматом синтезируются аланин, аспартат и глутамат:
- •8. Обмен метионина и реакции трансметилирования
- •Регенерация метионина
- •9. Обмен одноуглеродных фрагментов
- •10. Обмен фенилаланина и тирозина
- •Биосинтез меланина
- •11. Обмен гистидина
- •12. Биогенные амины: их образование, функции и инактивация
- •Образование гистамина
- •Образование 4-аминобутирата (гамк)
- •Образование катехоламинов
Регенерация метионина
После отдачи метильной группы в реакции трансметилирования S-аденозилметионин (SAM) превращается вS-аденозилгомоцистеин (SAG). Под действием специфической гидролазы это вещество распадается на гомоцистеин и аденозин:
![]()
Гомоцистеин может вновь превращаться в метионин в реакции трансметилирования с 5-метил-Н4-фолатом:
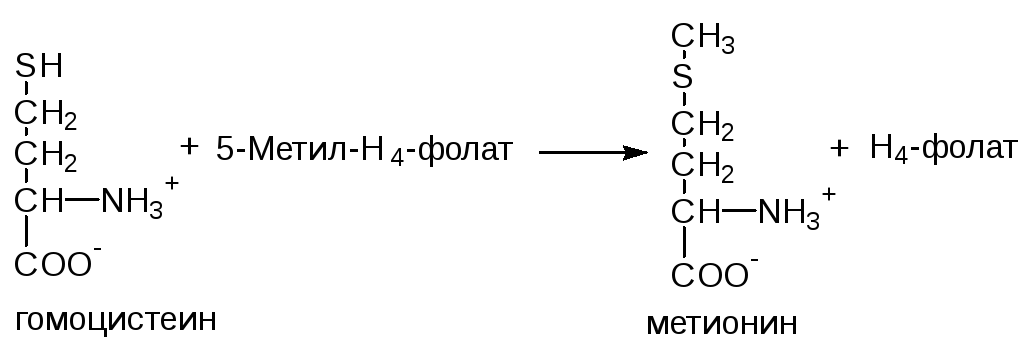
Промежуточным переносчиком метильной группы в этой реакции служит метилкобаламин – производное витамина В12. Данная реакция представляет собой “путь спасения” метионина.
9. Обмен одноуглеродных фрагментов
Для синтеза ряда соединений используются одноуглеродные фрагменты, такие как метильная группа (-СН3), метиленовая группа (-СН2-), метенильная группа (-СН=) и формильная группа (-СОН). Роль промежуточного переносчика этих групп играет Н4-фолат.
Н4-фолат образуется из фолиевой кислоты (фолата) при участии фолатредуктазы в печени. Коферментом фолатредуктазы является НАДФН·Н+.
Взаимопревращения производных тетрагидрофолата тесно связаны с обменом серина и глицина.
Превращение серина в глицин под действием серин-оксиметилтрансферазы происходит с участием Н4-фолата:
![]()
Распад глицина также происходит с участием Н4-фолата:
![]()
Метиленовая группа в молекуле 5,10-метилен-Н4-фолата может превращаться под действием специальных ферментов в другие одноуглеродные группы: 5,10-метенил-Н4-фолат и 10-формил-Н4-фолат. Все эти производные Н4-фолата служат донорами одноуглеродных радикалов при синтезе ряда соединений, в том числе дТМФ, пуриновых нуклеотидов, метионина и др.
Соответственно при гиповитаминозе, связанном с недостаточностью фолиевой кислоты, возникает дефицит предшественников ДНК и, в конечном счете, происходят изменения эритропоэза. Мегалобластическая анемия – почти всегда результат недостаточности фолиевой кислоты или витамина В12.
Фолиевая кислота является витамином не только для млекопитающих, но и для бактерий, в том числе болезнетворных. В последних фолиевая кислота образуется из парааминобензойной кислоты – одной из составных частей фолиевой кислоты. На структурном сходстве с парааминобензойной кислотой основано применение сульфаниламидных препаратов. При попадании в клетку бактерии сульфаниламидный препарат подавляет синтез фолиевой кислоты, нарушая все реакции, в которых она участвует. Размножение бактерий становится невозможным.
10. Обмен фенилаланина и тирозина
Фенилаланин – незаменимая аминокислота, т.к. в клетках животных не синтезируется бензольное кольцо.
Основная масса фенилаланина утилизируется двумя путями – превращается в тирозин (90%) или включается в состав белков. Обмен тирозина значительно сложнее: тирозин используется для синтеза белков, служит предшественником катехоламинов, меланина, тироксина, а также может подвергаться катаболизму до СО2и Н2О.
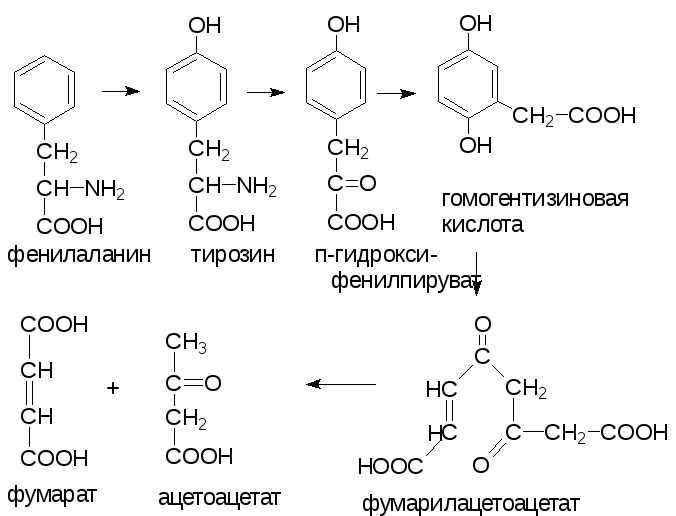
Катаболизм фенилаланина и тирозина. В результате ряда ферментативных превращений эти аминокислоты превращаются в фумарат и ацетоацетат.
Превращение фенилаланина в тирозин катализируется ферментом фенилаланинмонооксигеназой, коферментом которой служит тетрагидробиоптерин (ТГБП). Для регенерации последнего используется НАДФН·Н+. Превращение фенилаланина в тирозин скорее нужно для удаления избытка фенилаланина, чем для образования тирозина, поскольку недостатка в тирозине обычно не бывает. При врожденном отсутствии этого фермента развивается заболеваниефенилкетонурия.
Фенилкетонурия характеризуется нарушением обмена фенилаланина, в результате последний не может превращаться в тирозин и поэтому накапливается во всех жидкостях организма. Некоторые превращения фенилаланина, количественно несущественные у здорового человека, становятся заметными при фенилкетонурии. Наиболее значительным из них является переаминирование фенилаланина с образованием фенилпирувата. В основе самого названия болезни лежит высокое содержание этого фенилкетона в моче. Из фенилпирувата далее могут образовываться фениллактат, фенилацетат и О-гидроксифенилацетат.
Phe → фенилпируват → фенилацетат → фенилацетилглутамин
Конъюгат фенилацетата с глутамином выводится из организма с мочой.
Различают 2 формы фенилкетонурии: 1) классическая – наследственное заболевание связано с мутацией в гене фенилаланинмонооксигеназы. Наиболее тяжелые проявления – нарушение умственного и физического развития, судорожный синдром. 2) вариантная - следствие мутаций в генах, контролирующих метаболизм тетрагидробиоптерина. При этой форме клинические проявления близки, но не во всем совпадают с классической формой.
Нарушение умственного и физического развития при фенилкетонурии связано с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата и фениллактата. Большие концентрации Pheограничивают транспортTyrиTrpчерез гематоэнцефалический барьер и тормозят синтез нейромедиаторов.
Тетрагидробиоптерин необходим для реакций гидроксилирования не только Phe, но иTyr, иTrp. Поэтому при недостатке этого кофермента нарушается метаболизм всех 3-х аминокислот, в том числе синтез нейромедиаторов – катехоламинов и серотонина. Заболевание характеризуется тяжелыми неврологическими нарушениями и ранней смертью (злокачественная фенилкетонурия).
При фенилкетонурии имеют место и другие нарушения аминокислотного обмена. Так, кожа и волосы у больных фенилкетонурией светлее, чем у их сибсов. Это обусловлено ингибированием реакции гидроксилирования тирозина – первого этапа в образовании пигмента меланина под влиянием высокой концентрации фенилаланина.
Лечение фенилкетонурии сводится к приему пищи с низким содержанием фенилаланина. Задача состоит в том, чтобы поступление фенилаланина в организм при данном заболевании не превышало потребности в нем для роста и замещения.
В связи с резко выраженной умственной отсталостью, развивающейся при фенилкетонурии, важное значение приобретает ранняя диагностика. С этой целью исследуют мочу новорожденного, добавляя в нее FeCI3. В присутствии фенилпирувата развивается оливково-зеленое окрашивание. Еще более надежным тестом считается определение фенилаланина в крови.
Частота встречаемости фенилкетонурии составляет 1 случай на 20000 новорожденных. Болезнь наследуется как аутосомный рецессивный признак. Гетерозиготы, составляющие 1,5% популяции, не обнаруживают видимых отклонений от нормы. Однако гетерозиготных носителей гена фенилкетонурии можно обнаружить с помощью теста толерантности к фенилаланину или по измерению кинетики исчезновения внутривенно введенного фенилаланина. Эти тесты используются в генетической консультации для определения риска рождения больного ребенка.
Другим наследственным заболеванием, развивающимся как результат нарушения метаболизма тирозина, является алкаптонурия. Его непосредственной причиной является дефект фермента гомогентизат-диоксигеназы. В результате гомогентизат накапливается в жидкостях организма и выделяется с мочой, которая при стоянии чернеет, поскольку гомогентизат окислятся и полимеризуется в меланиноподобное соединение. Болезнь обычно обнаруживают по появлению черных пятен на пеленках. Других клинических проявлений и, прежде всего, нарушения умственного развития при данном заболевании не наблюдается.
