- •Обмен белков
- •1. Азотистый баланс
- •2. Переваривание белков в желудочно-кишечном тракте
- •3. Обмен белков в тканях
- •4. Катаболизм аминокислот
- •5. Обмен аммиака: источники, связывание в тканях, транспорт
- •Глутаминсинтетаза обладает высоким сродством к аммиаку, и благодаря этой реакции в крови и тканях поддерживается низкая концентрация nh3.
- •Образование и экскреция аммиака в почках
- •Биосинтез мочевины
- •Биологическая роль синтеза мочевины
- •Регуляция биосинтеза мочевины
- •Энергетическая цена синтеза мочевины
- •Гипераммониемия
- •6. Судьба углеродных скелетов аминокислот
- •7. Биосинтез заменимых аминокислот
- •Непосредственно путем переаминирования метаболитов опк с глутаматом синтезируются аланин, аспартат и глутамат:
- •8. Обмен метионина и реакции трансметилирования
- •Регенерация метионина
- •9. Обмен одноуглеродных фрагментов
- •10. Обмен фенилаланина и тирозина
- •Биосинтез меланина
- •11. Обмен гистидина
- •12. Биогенные амины: их образование, функции и инактивация
- •Образование гистамина
- •Образование 4-аминобутирата (гамк)
- •Образование катехоламинов
3. Обмен белков в тканях
Белки организма человека постоянно обновляются. В норме у здорового взрослого человека обновление белков составляет 1-2% от общего количества белков тела за сутки и связано преимущественно с деградацией мышечных белков до аминокислот. При этом примерно 75-80% высвободившихся аминокислот повторно используется в синтезе белков. Оставшаяся часть метаболизируется до конечных продуктов азотистого обмена, удаляемых из организма, а также превращается в глюкозу, кетоновые тела и СО2. Суточная деградация белков составляет 30-40 г. Поскольку16% массы белка приходится на азот, суточная потеря азота составляет 5-7 г.
Распад белка в тканях происходит под действием тканевых протеиназ или катепсинов, локализованных преимущественно в лизосомах (рН 5-6). В зависимости от структуры активного центра ферментов, все катепсины подразделяются на
тиоловые (катепсины В, С, Н, L,N,S)
аспартильные (катепсин D)
сериновые (катепсин A)
Под действием катепсинов тканевые белки расщепляются до отдельных аминокислот.
4. Катаболизм аминокислот
Аминокислоты, поступающие в организм в количествах, превышающих потребности, связанные с биосинтезом белков, запасаться в организме не могут и используются как метаболическое топливо.
Катаболизм аминокислот чаще всего начинается с реакции дезаминирования – удаления α-аминогруппы. Дезаминированию подвергаются все аминокислоты, кроме лизина.
Различают следующие виды дезаминирования:
а) окислительное – для Glu
б) неокислительное – для Ser,Thr,His,Cys.
в) непрямое – для всех остальных аминокислот.
Непрямое дезаминирование аминокислот протекает в 2 стадии. Первая стадия – реакцияпереаминирования. Реакциями переаминирования называют реакции переноса аминогруппы от аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты, а ферменты, катализирующие эти реакции, получили название аминотрансфераз или трансаминаз. Основным акцептором (сборщиком) аминогрупп является 2-оксоглутарат.
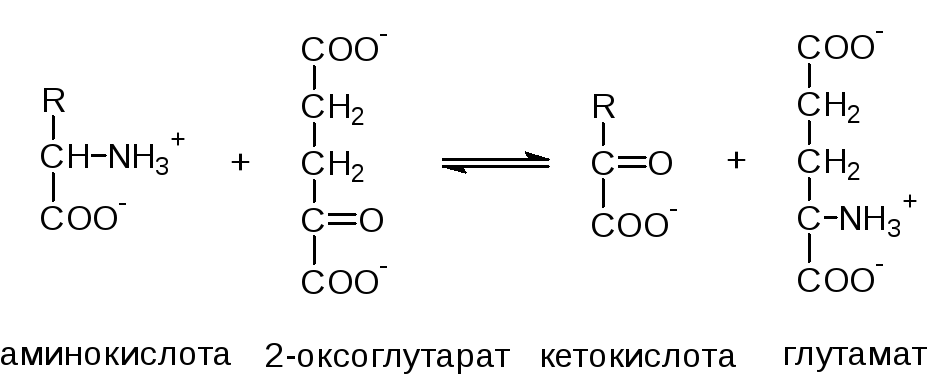
Кроме того, в роли промежуточных акцепторов аминогрупп могут выступать пируват и оксалоацетат. Образующиеся при этом, соответственно, аланин и аспартат могут передавать свою аминогруппу на 2-оксоглутарат с образованием глутамата. Таким образом, аминогруппы большинства аминокислот собираются в составе глутамата.
Вторая стадия: собственно дезаминирование. Реакция катализируется глутаматдегидрогеназой (ГДГ) – митохондриальным ферментом, использующим в качестве кофермента НАД+. Реакция обратима и функционирует как в процессах катаболизма, так и биосинтеза аминокислот.
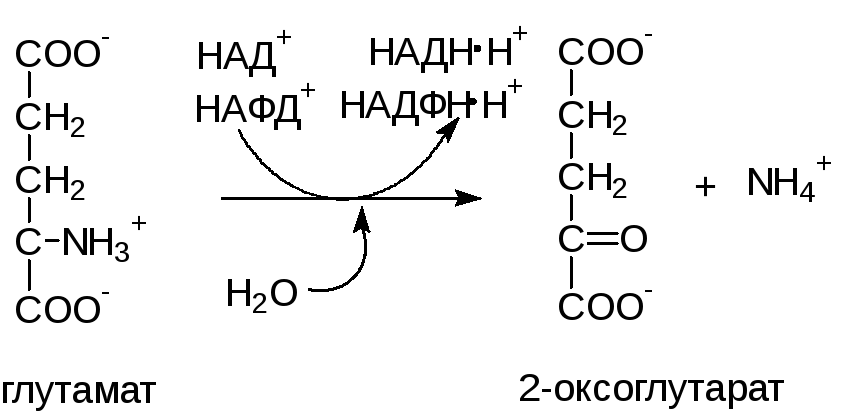
ГДГ печени является регуляторным ферментом. ГТФ и АТФ являются аллостерическими ингибиторами, тогда как ГДФ и АДФ служат аллостерическими активаторами. Следовательно, снижение энергетического заряда ускоряет окисление аминокислот.
Определение активности АлАТ в сыворотке крови широко используется в клинике с целью ранней диагностики и мониторинга заболеваний печени.
5. Обмен аммиака: источники, связывание в тканях, транспорт
Другими (помимо аминокислот) источниками аммиака в организме являются:
2) глутамин + Н2Оглутамат +NH3
3) амины (R-CH2-NH2+H2O+O2R-C=O+NH3+H2O2)
4) аденин + Н2Огипоксантин +NH3
5) распад пиримидиновых оснований:
3-уреидопропионат + Н2О-аланин + СО2+NH3
Образовавшийся аммиак – вещество крайне токсичное, особенно опасное для мозга. Причины токсичности аммиака:
а) аммиак сдвигает реакцию, катализируемую глутаматдегидрогеназой в сторону образования глутамата
2-оксоглутарат + НАДН·Н++NH3→ глутамат + НАД+
Снижение концентрации 2-оксоглутарата вызывает угнетение обмена аминокислот (переаминирования) и гипоэнергетическое состояние (угнетение ЦЛК).
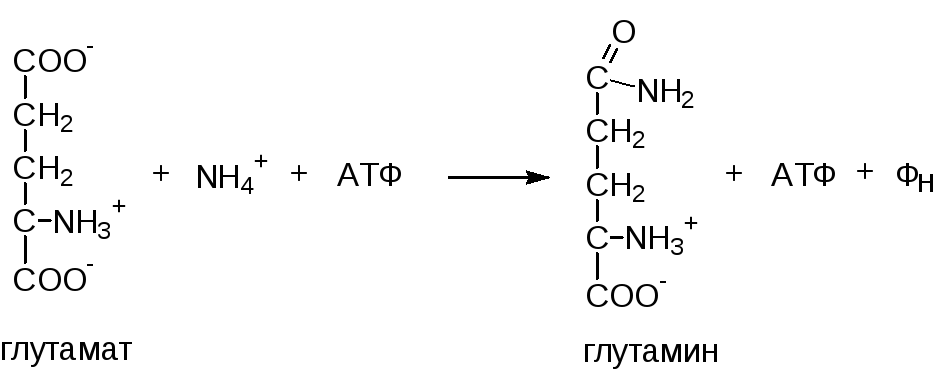
б) аммиак усиливает синтез глутамина из глутамата в нервной ткани
глутамат + NH3+ АТФ → глутамин + АДФ + Н3РО4
Накопление глутамина в нервных клетках приводит к повышению осмотического давления и в больших концентрациях может вызвать отек мозга. Снижение концентрации глутамата нарушает обмен нейромедиаторов, в частности синтез γ-аминомасляной кислоты (ГАМК) – основного тормозного медиатора.
Глутамат → ГАМК + СО2
Это приводит к преобладанию процессов возбуждения над процессами торможения и вызывает судороги.
в) Аммиак в крови и цитозоле образует ион NH4+
NH3+H+→NH4+
Накопление NH4+нарушает трансмембранный перенос ионов, в частности одновалентных катионовNa+и К+, что также влияет на проведение нервных импульсов.
Образовавшийся в клетках аммиак связывается (обезвреживается) и выводится из организма почками в виде конечных продуктов азотистого обмена: 1) мочевины – синтезируется в печени и 2) аммонийных солей – образуются в почках.
Существует несколько способов обезвреживания и выведения аммиака в разных тканях. 1) Образование глутамата из 2-оксоглутарата катализируется глутаматдегидрогеназой (ГДГ). Вклад этой реакции в обезвреживание аммиака невелик. 2) Основной реакцией обезвреживания аммиака почти во всех тканях является синтез глутамина под действием глутаминсинтетазы: