
15Обмен нуклеотидов
.doc
Обмен нуклеотидов
Распад пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов включает реакции гидролитического отщепления фосфатного остатка, фосфоролитического отщепления рибозного остатка и аминогруппы. Конечным продуктом расщепления пуринов в организме человека является мочевая кислота. Последняя выделяется с мочой.
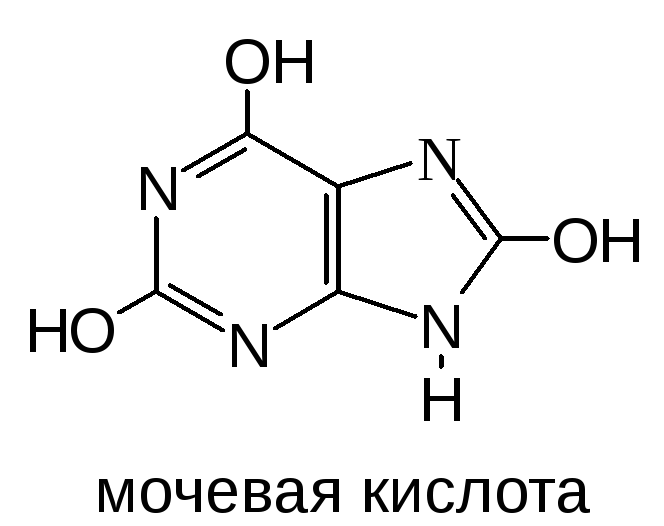
Распад АМФ
В результате вышеперечисленных реакций из АМФ образуется гипоксантин:
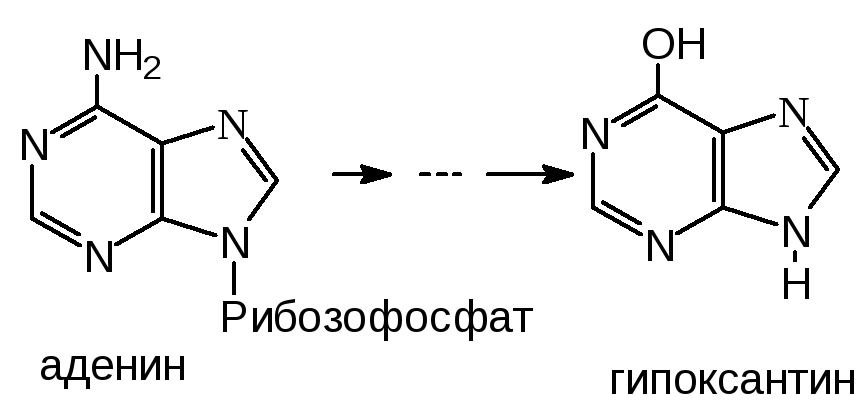
Гипоксантин далее превращается в ксантин, а ксантин в мочевую кислоту. Эти реакции катализирует ксантиноксидаза.
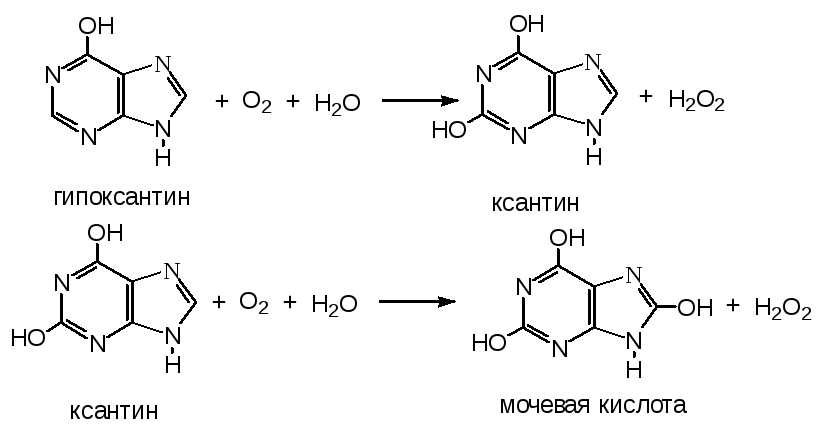
Распад ГМФ
Гуанозинмонофосфат превращается в ксантин и далее в мочевую кислоту.

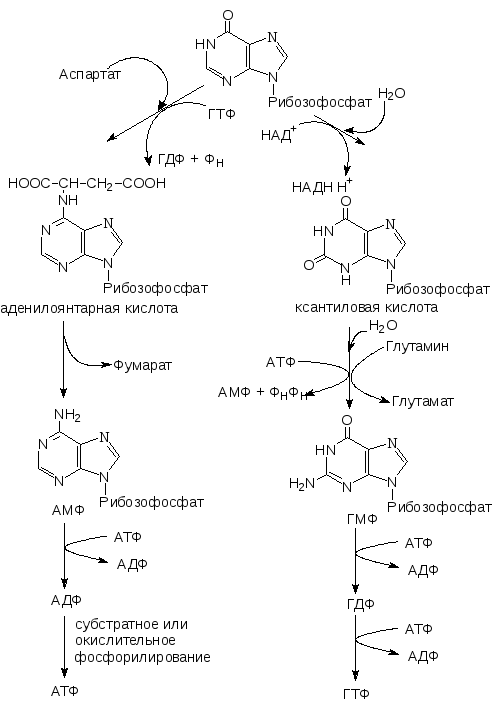
Биосинтез пуриновых нуклеотидов
В экспериментах с мечеными веществами еще в 50-ых годах ХХ века было выяснено происхождение атомов в пуриновом кольце пуриновых нуклеотидов. Оказалось, что пуриновая структура образуется из мелких фрагментов, поставляемых разными соединениями.
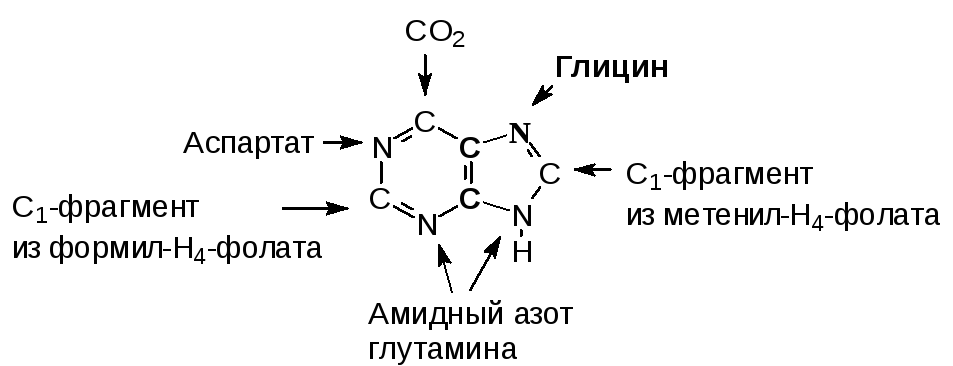
Позднее была изучена вся последовательность реакций, ведущих к образованию пуриновых нуклеотидов. Синтез начинается с образования 5-фосфорибозил-1-амина. Затем к аминогруппе присоединяется остаток глицина и далее последовательно протекают реакции образования пуринового ядра с использованием метенильной группы метенил-Н4-фолата, амидной группы глутамина, углекислого газа, аминогруппы аспарагиновой кислоты, формильного остатка формил-Н4-фолата. Результатом является образование инозиновой кислоты.
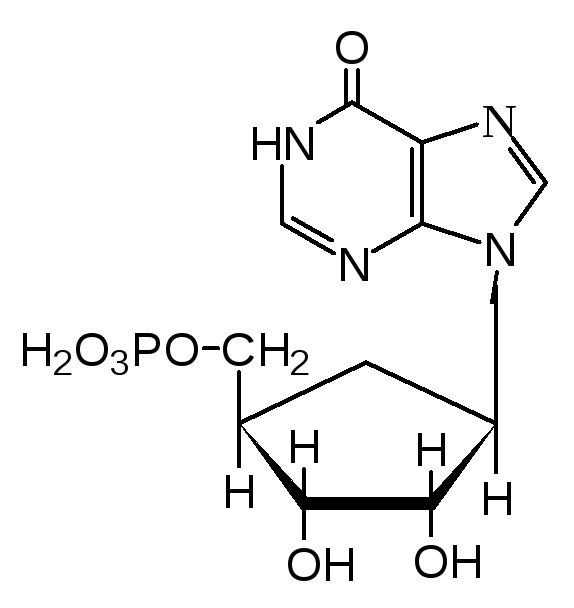
Инозиновая кислота – это нуклеотид, пуриновая часть которого представлена гипоксантином. Инозиновая кислота служит предшественником основных пуриновых нуклеотидов – АМФ и ГМФ.
Под действием специфических киназ нуклеозидмонофосфаты (АМФ и ГМФ) превращаются в нуклеозиддифосфаты и нуклеозидтрифосфаты.
Регуляция биосинтеза пуриновых нуклеотидов
Лимитирующей стадией биосинтеза пуриновых нуклеотидов является реакция образования 5’-фосфорибозил-1-амина. Фермент, катализирующий эту реакцию, ингибируется АМФ и ГМФ. Кроме того, эта метаболическая цепь регулируется в месте ее разветвления: АМФ ингибирует реакцию образования аденилосукцината, а ГМФ – реакцию образования ксантиловой кислоты.
Биосинтез пуриновых нуклеотидов из аденина и гуанина
В результате превращений нуклеотидов в тканях постоянно образуются свободные пуриновые основания – аденин и гуанин. Они могут повторно использоваться для синтеза нуклеотидов при участии ферментов аденинфосфорибозилтрансферазы и гипоксантин-гуанин-фосфорибозилтрансферазы:
аденин + фосфорибозилдифосфат АМФ + Н4Р2О7
гуанин + фосфорибозилдифосфат ГМФ + Н4Р2О7
Этот механизм повторного включения азотистых оснований в метаболизм называют “путем спасения”. Он имеет вспомогательное значение, давая от 10 до 20% общего количества нуклеотидов.
В результате совместного действия этих ферментов снижается выход конечного продукта обмена пуринов – мочевой кислоты.
Другой “запасной путь” включает фосфорилирование пуриновых нуклеотидов при участии АТФ. Так, аденозинкиназа катализирует фосфорилирование аденозина до АМФ или дезоксиаденозина до дАМФ:
Аденозин + АТФ → АМФ + АДФ
Гиперурикемия. Подагра
В крови здоровых мужчин содержится 0,18-0,53 ммоль/л и здоровых женщин – 0,15-0,45 ммоль/л мочевой кислоты. Хроническое повышение концентрации мочевой кислоты в крови (гиперурикемия) часто приводит к развитию подагры. Клиническая картина подагры характеризуется: 1) повторяющимися приступами острого воспаления суставов, чаще всего мелких, вследствие отложения кристаллов урата натрия в суставе 2) образованием подагрических узлов (тофусов), возникающих в результате местного отложения и накопления уратов. Образование узлов в суставах деформирует их и нарушает функцию. Отложение уратов в ткани почек приводит к почечной недостаточности – частому осложнению подагры.
Подагра – распространенное заболевание: в разных странах им страдает от 0,3 до 1,7% взрослого населения, причем мужчины болеют в 20 раз чаще, чем женщины. Гиперурикемия чаще всего имеет наследственный характер.
Известна тяжелая форма гиперурикемии – синдром Леша-Нихана, который наследуется как рецессивный признак, сцепленный с Х-хромосомой. У больных мальчиков кроме симптомов, характерных для подагры, наблюдаются церебральные параличи, нарушения интеллекта, попытки наносить себе раны (укусы пальцев, губ). Эта болезнь связана с дефектом фермента – гипоксантин – гуанин-фосфорибозилтрансферазы, вследствие чего гипоксантин и гуанин не могут использоваться повторно для синтеза нуклеотидов, а целиком превращаются в мочевую кислоту, что и ведет к гиперурикемии.
Основным препаратом, который используется для лечения гиперурикемии, является аллопуринол – структурный аналог гипоксантина. Аллопуринол является конкурентным ингибитором ксантиноксидазы и его прием снижает содержание мочевой кислоты до нормальных величин. Содержание гипоксантина при этом возрастает. Однако гипоксантин примерно в 10 раз лучше, чем мочевая кислота, растворяется в крови и моче, и поэтому легче выводится из организма.
Распад пиримидиновых нуклеотидов
Под действием нуклеотидаз и нуклеозидфосфорилаз уридиловая кислота (УМФ) распадается до урацила, цитидиловая кислота (ЦМФ) – до цитозина, тимидиловая кислота (ТМФ) – до тимина.
Биосинтез пиримидиновых нуклеотидов
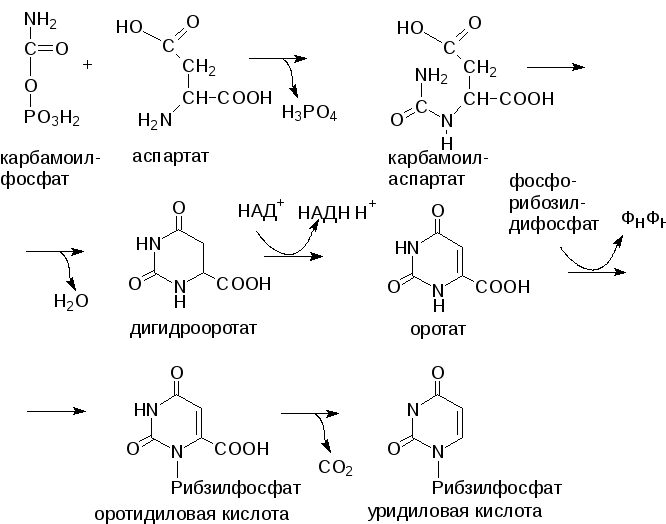
Предшественником цитидиловых и тимидиловых нуклеотидов служит уридиловая кислота (УМФ), которая образуется из углекислого газа, амидной группы глутамина и аспарагиновой кислоты.
Синтез УМФ de novo, включающий 6 последовательных стадий, протекает главным образом в цитозоле клеток при участии 3 ферментов, 2 из которых являются полифункциональными.
Первый полифункциональный фермент содержит домены, имеющие активность карбамоилфосфатсинтетазы II, аспартаткарбамоилтрансферазы и дигидрооротазы, и катализирует первые 3 реакции этого метаболического пути.
Митохондриальная НАД-зависимая дигидрооротатдегидрогеназа окисляет дигидрооротат в оротат.
Второй полифункциональный фермент катализирует превращение оротата в нуклеотид и его последующее декарбоксилирование до УМФ, т.е. проявляет оротатфосфорибозилтрансферазную и оротидилатдекарбоксилазную активности.
Первая реакция синтеза УМФ – это образование карбамоилфосфата:
СО2 + глутамин + 2 АТФ + Н2О карбамоилфосфат + глутамат + 2 АДФ + Фн
Реакция катализируется карбамоилфосфатсинтетазой II, локализованной в цитозоле всех клеток организма (в противоположность карбамоилфосфатсинтетазе I, локализованной в митохондриях печени).
Далее карбамоилфосфат в реакции с аспарагиновой кислотой образует карбамоиласпарагиновую кислоту, которая превращается в дигидрооротовую кислоту.
Из УМФ при действии специфических киназ образуются УДФ и УТФ:
УМФ + АТФ УДФ + АДФ
УДФ + АТФ УТФ + АДФ
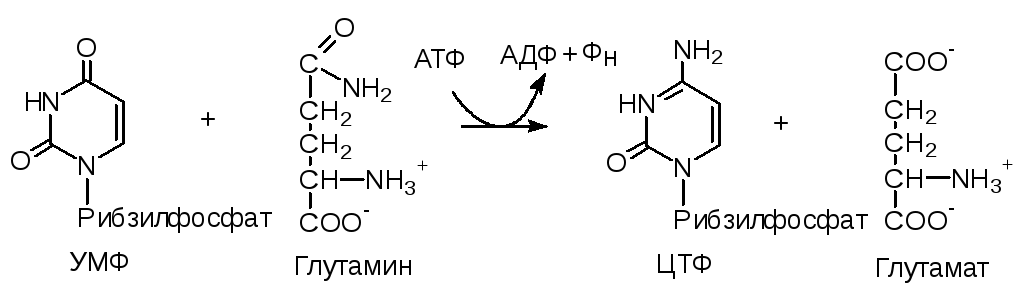
Путем аминирования УТФ образуется ЦТФ:
Регуляция биосинтеза пиримидиновых нуклеотидов
Осуществляется на уровне первого полифункционального фермента. УТФ является аллостерическим ингибитором карбамоилфосфатсинтетазы II, а ФРПФ – аллостерическим активатором. Этот механизм предотвращает избыточный синтез не только УМФ, но и других пиримидиновых нуклеотидов, поскольку они образуются из УМФ.
Биосинтез дезоксирибонуклеотидов
Дезоксирибонуклеотиды образуются из рибонуклеотидов при участии рибонуклеотидредуктазного комплекса, который катализирует восстановление гидроксильной группы во 2’ положении рибозного остатка. Субстратами являются дифосфаты нуклеотидов.
Рибонуклеотидредуктазный комплекс состоит из рибонуклеотидредуктазы (РНР), белкового кофактора тиоредоксина и системы его регенерации: фермента тиоредоксинредуктазы и НАДФН·Н+.
Другой тип рибонуклеотидредуктазного комплекса состоит из рибонуклеотидредуктазы (РНР), белкового кофактора глутаредоксина и системы его регенерации: глутаредоксинредуктазы и глутатиона (G-SH).
РНР – аллостерический фермент. Его активность зависит от концентрационных соотношений дезоксирибонуклеотидов. дАТФ является ингибитором восстановления всех рибонуклеотидов.
Биосинтез тимидиловых нуклеотидов
Тимидиловая кислота (дТМФ) образуется из дезоксиуридиловой кислоты (дУМФ) в реакции, катализируемой тимидилатсинтазой:
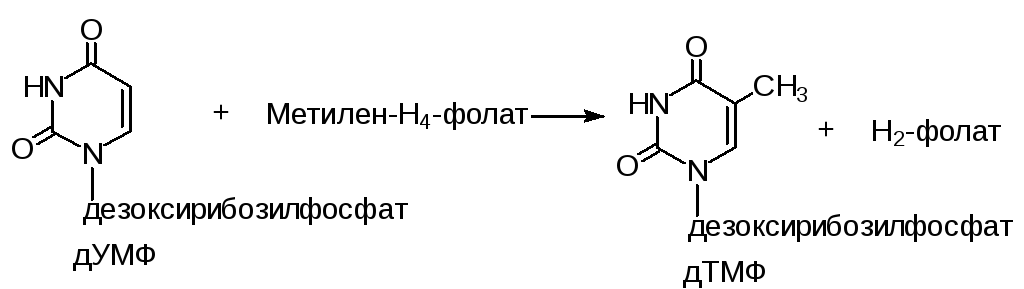
Скорость синтеза дТМФ зависит от скорости восстановления продукта реакции Н2-фолата в Н4-фолат под действием фолатредуктазы. Эта реакция ингибируется метотрексатом, который используется в комплексной терапии лейкозов.
Образование дУМФ осуществляется двумя путями: 1) дефосфорилированием дУДФ или дефосфорилированием дЦДФ и последующим гидролитическим дезаминированием дЦМФ с помощью дЦМФ-дезаминазы. В организме человека преобладает второй путь.
Синтез дезоксирибонуклеотидов в покоящихся клетках практически не происходит и активируется на стадиях клеточного цикла, предшествующих делению. Ингибиторы синтеза дезоксирибонуклеотидов делают невозможной репликацию ДНК и деление клетки. На этом основано применение ингибиторов тимидилатсинтазы (например, 5-фтордезоксиуридина) для лечения злокачественных опухолей.
Оротацидурия
Оротацидурией называют выделение с мочой больших количеств оротовой кислоты. Наследственная оротацидурия связана с недостаточностью ферментов, катализирующих реакции образования и декарбоксилирования оротидиловой кислоты. В результате возникает недостаточность пиримидиновых нуклеотидов, необходимых для синтеза нуклеиновых кислот, оротовая кислота при этом, наоборот, накапливается. При отсутствии лечения наследственная оротацидурия приводит к резкому отставанию в умственном и физическом развитии, что является следствием “пиримидинового голода”. Поэтому для лечения этой болезни применяют уридин или цитидин. Они обеспечивает образование УМФ:
уридин + АТФ УМФ + АДФ
а, следовательно, и других пиримидиновых нуклеотидов. Такое лечение устраняет “пиримидиновый голод”, но должно продолжаться без перерывов на протяжении всей жизни.
