
- •5. Металлургические основы сварки плавлением
- •1) Уменьшается стойкость против коррозии;
- •4) Усиливается рост зерен при нагреве;
- •5) Ухудшается обрабатываемость резанием и ковка;
- •Влияние водорода на свойства стали
- •Влияние окиси углерода на свойства стали.
- •Шлаковая фаза Шлаки и их назначение.
- •Свойства шлаков.
- •Главные системы сварочных шлаков
- •Взаимодействие между расплавленным металлом, газовой средой и шлаком
- •Материальный баланс сварки
- •Окислительные процессы. ____________________________________________
- •Виды раскислительных процессов.
- •Раскисление с получением оксидов, нерастворимых в металле и всплывающих в шлак.
- •Раскисление с получением газообразных продуктов реакции.
- •Легирование наплавленного металла.
- •Рафинирование металла.
- •Сера и ее удаление из металла шва.
- •Фосфор и его удаление из металла шва.
- •Процессы кристаллизации металла при сварке
- •2. Причиной возникновения пор может быть и водород, интенсивно растворяющийся в жидком металле и частично не успевающий в момент кристаллизации выделиться из него.
- •1) Способности шлаковых частиц к коагуляции, т. Е. Укрупнению путем слияния;
- •2) Скорости всплывания шлаковых частиц в жидком металле.
- •Процессы вторичной кристаллизации в металле шва и в основном металле. Вторичная кристаллизация в металле шва.
- •1) Избыточный феррит не успевает выделиться из аустенита и поэтому к моменту эвтектоидного превращения аустенит содержит повышенной содержание с,
Раскисление с получением газообразных продуктов реакции.
Рассмотрим две типичные реакции этого вида раскисления металла.
Раскисление углеродом.
Этот процесс может протекать в два этапа:
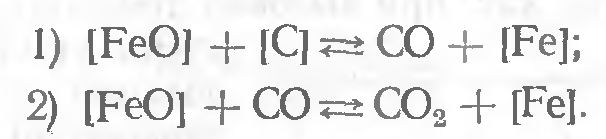
При этом наблюдается одновременное присутствие железа, закиси железа, углерода, окиси углерода и углекислого газа.
При сварке наиболее вероятны следующее:
1) при окислении металла устойчивой формой оксида железа будет FeO;
2) раскисление металла углеродом идет только до образования окиси углерода, так как при высоких температурах этот продукт очень устойчив, т. е. по 1-й реакции.
Константа равновесия для этой реакции
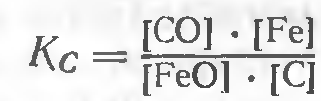
После принятых допущений:
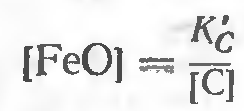
На рис. 126 показаны кривые зависимости равновесного содержания закиси железа от содержания углерода в стали для различных температур.

Из рис. 126 следует:
с увеличением содержания углерода в металле интенсивно уменьшается содержание в нем закиси железа,
с ростом температуры процесса раскисляющая способность углерода повышается и раскисление идет значительно полнее, чем при низких температурах.
Однако, несмотря на хорошую раскисляющую способность, углерод как раскислитель находит ограниченное применение. Это объясняется двумя обстоятельствами (углерод – очень эффективный компонент, недостаток или избыток которого очень существенно отражается на свойствах металла):
1) возможностью образования пор в металле шва
если в металле высокое содержание углерода и FeO, то реакция выгорания углерода может протекать бурно,
на участках, кристаллизующихся в последнюю очередь, где выгорание затянулось.
2) при добавлении углерода во флюс в качестве раскислителя возможностью повышения содержания углерода в металле шва, которое не всегда допустимо.
Раскисление водородом
представляется следующим уравнением:
![]()
Отсюда концентрация закиси железа, отвечающая состоянию равновесия,
![]()
Восстановление металла водородом имеет много общего с восстановлением его окисью углерода. Однако водород слабее, чем СО, раскисляет металл.
Недостатком водорода как раскислителя является его высокая растворимость в металлах, которая может привести к образованию пор и трещин.
………………………………………………………………………………………………………..
По характеру воздействия можно выделить химическое и физическое раскисление.
Химическое раскисление -
раскисления на основе обменных реакций как с образованием шлаков, так и газообразных продуктов.
Говоря об эффективности раскисления на основе обменных реакций, следует иметь в виду, что даже в условиях большой металлургии, когда процесс плавки стали протекает достаточно длительно, состояние равновесия реакции раскисления не достигается.
При сварке отклонения от равновесности концентраций будут еще большими (в сторону более высокого содержания закиси железа).Учитывая эти особенности, в сварочной практике часто применяют одновременно несколько раскислителей в количестве, превышающих стериохимические коэффициенты.Для сравнения раскисляющей способности некоторых элементов на рис. 127 приведены кривые зависимости равновесной концентрации закиси железа от содержания соответствующего элемента-раскислителя при температуре 1600 °С.
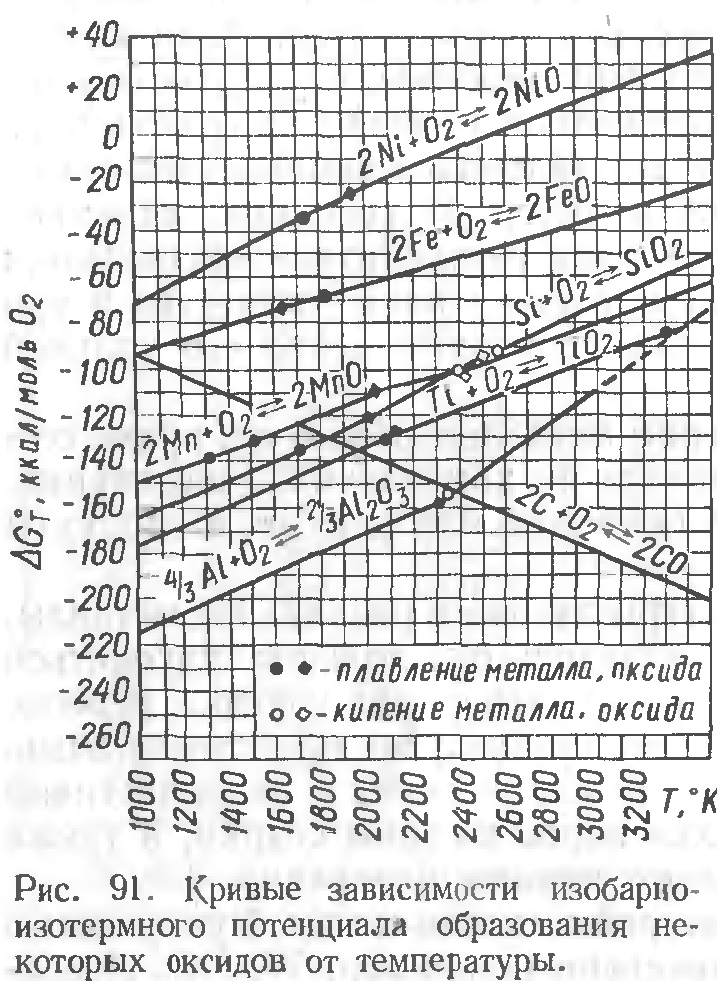
Очевидно, что наибольшей раскисляющей способностью обладает А1, затем — Ti, далее при малых концентрациях раскислителя — Si, С и, наконец, Мп и Сr.
Физическое раскисление -
диффузионное раскисление, основанное на частичном переходе закиси железа из жидкого металла в шлак, так как ее распределение между этими двумя фазами подчиняется закону распределения Hepнста:
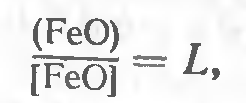
где L — константа распределения.
Для развития этого вида раскисления важно, чтобы концентрация свободной закиси железа в шлаке уменьшалась, тогда новые порции закиси железа будут переходить из металла в шлак.
Уменьшение содержания свободной закиси железа в шлаке достигается различными путями:
1) связыванием ее в комплексные соединения кислотными оксидами (образованием силикатов, титанатов);
2) проведением раскислительных обменных реакций;
3) разбавлением шлаков нейтральными в химическом отношении добавками.
Константа распределения L, определяющая собой степень перехода закиси железа из металла в шлак, с увеличением температуры уменьшается(рис. 128).
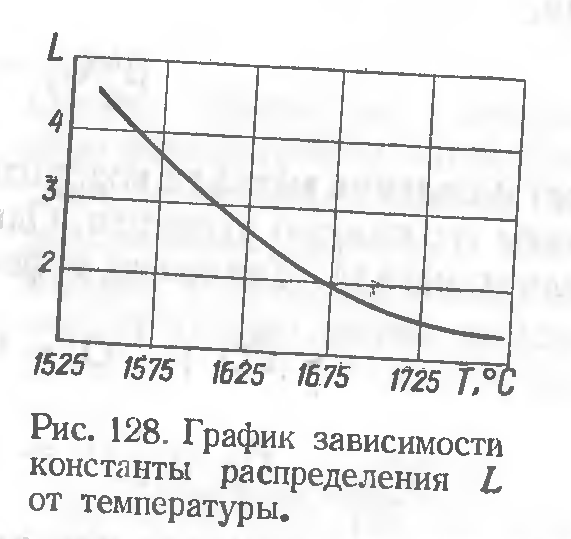
Это значит, что при высоких температурах закись железа может перейти из металла в шлак в меньшем количестве, чем при низких,ироль диффузионного раскисления снижается.
При диффузионном раскислении закись железа удаляется из металла в шлак путем диффузии, поэтому ванна жидкого металла спокойна, а все химические процессы совершаются на границе «металл— шлак» и в самом шлаке. Однако само раскисление протекает медленно.Поэтому,хотя L при температурах, близких к температуре затвердевания металла, высока,скорость диффузии замедляется и общий эффект от раскисления оказывается невысоким.
Процесс диффузионного раскисления наиболее заметен при образовании капли на электроде и ее переносе, так как ему способствует достаточно высокая температура, энергичное перемешивание металла капли и непрерывный контакт свежих порций металла со шлаком. Процесс раскисления металла в капле происходит одновременно с интенсивным процессом окисления – это взаимно противоположные реакции.
В сварочной ванне диффузионное раскисление протекает слабо и лишь в верхнем, тонком слое металла, прилегающем к шлаку. Вследствие отмеченных особенностей диффузионное раскисление в процессах сварки обычно не играет большой роли.
В целом, благодаря своим физическим свойствам, основные шлаки обеспечивают лучшее раскисление металла, чем кислые.
