
- •5. Металлургические основы сварки плавлением
- •1) Уменьшается стойкость против коррозии;
- •4) Усиливается рост зерен при нагреве;
- •5) Ухудшается обрабатываемость резанием и ковка;
- •Влияние водорода на свойства стали
- •Влияние окиси углерода на свойства стали.
- •Шлаковая фаза Шлаки и их назначение.
- •Свойства шлаков.
- •Главные системы сварочных шлаков
- •Взаимодействие между расплавленным металлом, газовой средой и шлаком
- •Материальный баланс сварки
- •Окислительные процессы. ____________________________________________
- •Виды раскислительных процессов.
- •Раскисление с получением оксидов, нерастворимых в металле и всплывающих в шлак.
- •Раскисление с получением газообразных продуктов реакции.
- •Легирование наплавленного металла.
- •Рафинирование металла.
- •Сера и ее удаление из металла шва.
- •Фосфор и его удаление из металла шва.
- •Процессы кристаллизации металла при сварке
- •2. Причиной возникновения пор может быть и водород, интенсивно растворяющийся в жидком металле и частично не успевающий в момент кристаллизации выделиться из него.
- •1) Способности шлаковых частиц к коагуляции, т. Е. Укрупнению путем слияния;
- •2) Скорости всплывания шлаковых частиц в жидком металле.
- •Процессы вторичной кристаллизации в металле шва и в основном металле. Вторичная кристаллизация в металле шва.
- •1) Избыточный феррит не успевает выделиться из аустенита и поэтому к моменту эвтектоидного превращения аустенит содержит повышенной содержание с,
Раскисление с получением оксидов, нерастворимых в металле и всплывающих в шлак.
К числу раскислителей, образующих такие оксиды, относятся Ti, Si, Мn, Аl и др.
В общем виде реакция раскисления железа представляется таким уравнением:
![]()
где Ра — раскислитель.
Константа равновесия реакции
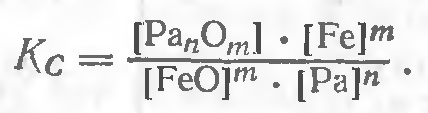
Но в сталях [Fe] ~1, поэтому равновесная концентрация свободной закиси железа в металле
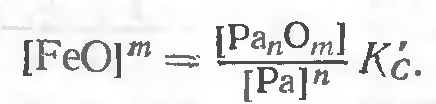
Следовательно, концентрация свободной закиси железа уменьшается с повышением содержания раскислителя и уменьшением концентрации оксидов данного раскислителя в металле.Если же учесть, чтораскислителями, как правило, служат элементы, образующие нерастворимые в металле оксиды, удаляемые в шлак,то концентрацию [Pan0m] можно считать величиной постоянной. Тогда, включая величину [Pan0m] в константу равновесия реакции, получим

Таким образом, для определенных температур можно установить зависимость между концентрацией раскислителя и находящейся с ней в равновесии концентрацией свободной закиси железа. Тогда, задаваясь допустимым содержанием [FeO], определяют отвечающую этому содержанию концентрацию раскислителя в металле.
Рассмотрим характерные черты наиболее важных раскислителей этой группы, применяющихся в сварочной технике:
Кремний— Si (Тпл = 1440 °С; Ткип = 2630 ºС; ρ =2,37 г/см3).При окислении образует нерастворимый в расплаве железа кислотный оксид Si02, который легко создает комплексы, в том числе и с FeO.Силикаты железа всплывают на поверхность металла и переходят в шлак, вследствие чего раскисляющая способность кремния не снижается.
С повышением концентрации кремния в металле уменьшается содержание в нем закиси железа.
При этом раскисляющая способностькремния заметноувеличивается с понижением температуры.
Так как оксиды кремния увеличивают кислотность шлака, а вместе с тем и его вязкость, введение кремния в сварочную ванну ограничивают.
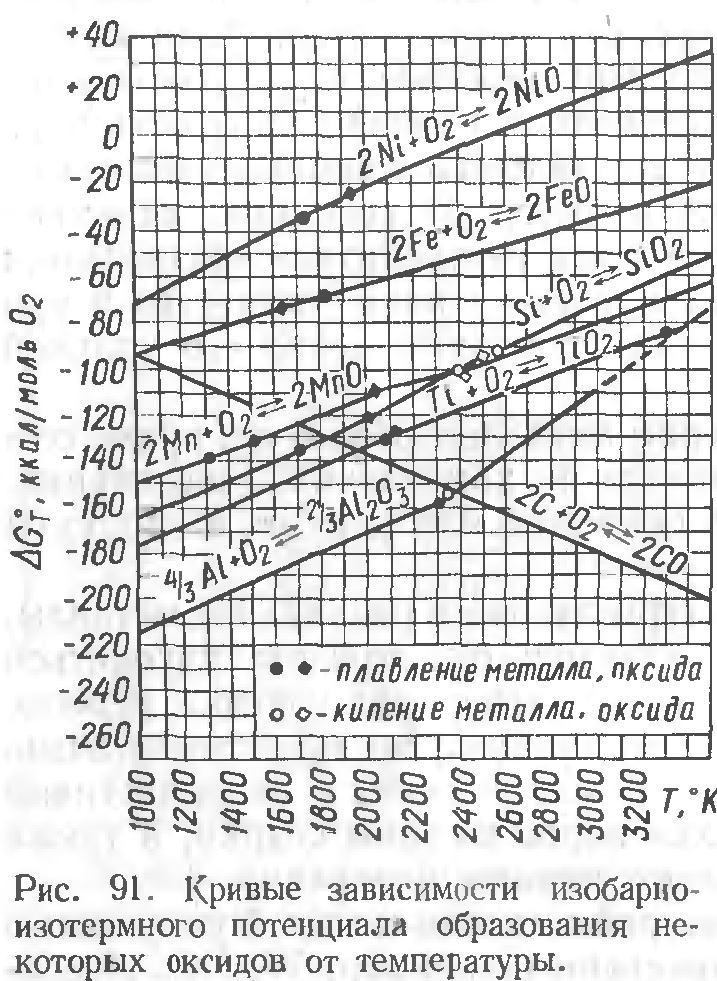
2. МарганецМп (Тпл = 1244 °С; Ткип = 2027 ºС; ρ =7,46 г/см3). При окислении марганец превращается в закись MnO —относительно сильный основной оксид, нерастворимый в металле.
Закись марганца образует с закисью железа непрерывный ряд растворов как в жидком, так и в твердом состоянии.Взаимное физическое растворение их приводит к уменьшению содержания в шлаке свободной закиси железа, и поэтому создаются условия для соответствующего перехода из металла в шлак новых порций FeO.
Как и для кремния, с увеличением содержания марганца в металле уменьшается концентрация в нем закиси железа, однаковлияние кремния сказывается сильнее.
С увеличением температуры действие марганца как восстановителя слабеет.
3. ТитанTi (Тпл = 1660 °С; Ткип = 3260 ºС; ρ = 4,54 г/см3) относится кчислу сильных раскислителей, более сильных, чем кремний и марганец.Образующийсякислотный оксид ТiО2 нерастворим в металле, легко вступает в комплексы, переходящие в шлак.
С увеличением содержания титана в стали количество закиси железа также уменьшается.
Титан активно реагирует с азотом, образуя прочные нитриды, нерастворимые в металле.Вместе с тем, он сильный модификатор, т. е. элемент, способствующий измельчению зерна в металле.
4. Алюминий—А1 (Тпл =658 °С; Тисп =2500 °С; ρ =2,7 г/см3) -наиболее сильный раскислитель этой группы. Образуетамфотерный оксид А1203.
Раскисление жидкого металла алюминием сопровождается значительным выделением тепла, обеспечивающим дополнительный подогрев металла сварочной ванны, что благотворно влияет на протекающие процессы.
Однако окись алюминия с трудом всплывает на поверхность сварочной ванны и частично остается в шве в виде неметаллических включений.Это одна из причин незначительного применения алюминия как раскислителя при сварке сталей.
Как и титан, алюминий склонен образовывать с азотом стойкие нитриды.
