
Beusheva_fr1
.pdfМинистерство образования и науки Российской Федерации
ФБГОУ «Алтайский государственный технический университет им. И. И. Ползунова»
Н. Г. Комарова, О. С. Беушева
ФАЗОВЫЕ РАВНОВЕСИЯ В ОДНОКОМПОНЕНТНЫХ
СИСТЕМАХ
Методическое пособие с указаниями к лабораторному практикуму по физической химии
Барнаул 2013
УДК 541.1.
Комарова Н. Г., Беушева О. С. Фазовые равновесия в однокомпонентных системах. Методическое пособие с указаниями к лабораторному практикуму по физической химии / Н. Г. Комарова, О. С. Беушева; Алт. гос. техн. ун-т им. И. И. Ползунова. – Барнаул: Изд-во АлтГТУ, 2013. – 30 с.
Методическое пособие посвящено одному из разделов физической химии - гетерогенному равновесию. В нем содержатся теоретические вводные пояснения, примеры решения задач, методика динамического способа определения давления насыщенного пара, указания к выполнению лабораторной работы, вопросы и задания для контроля знаний по данной теме.
Методическое пособие предназначено для студентов вечерне-заочного факультета, обучающимся по следующим направлениям и профилям:
направление 240100 «Химическая технология» по профилям: «Химическая технология неорганических веществ», «Технология переработки пластмасс и эластомеров»;
направление 241000 «Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии» по профилям: «Охрана окружающей среды и рациональное использование природных ресурсов», «Машины и аппараты химических производств»;
направление 260100 по профилям: «Технология хранения и переработки зерна», «Технология хлеба, макарон и кондитерских изделий», «Технология бродильных производств и виноделие»;
направление 260800 «Технология продукции и организация общественного питания»;
направление 260200 «Продукты питания животного происхождения», профиль «Технология молока и молочных продуктов».
Рассмотрена и одобрена на заседании кафедры ТППиЭ. Протокол № 6 от 18.03.2013
2
|
|
СОДЕРЖАНИЕ |
|
СОДЕРЖАНИЕ....................................................................................................... |
3 |
||
1 |
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ............................................................................... |
4 |
|
|
1.1 |
Основные понятия и определения................................................................ |
4 |
|
1.2 |
Однокомпонентные системы........................................................................ |
6 |
|
1.2.1 Универсальное уравнение Клапейрона – Клаузиуса ........................... |
6 |
|
|
1.2.2 Равновесие между двумя конденсированными фазами....................... |
7 |
|
|
1.2.3 Равновесие между конденсированными и газообразными фазами... |
8 |
|
|
1.2.5 Диаграмма состояния воды при высоких давлениях......................... |
13 |
|
|
1.2.6 Диаграмма состояния серы................................................................... |
14 |
|
2 |
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ...................................................................... |
17 |
|
3 |
ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ................................................................. |
23 |
|
|
3.1 |
Описание установки и порядок работы.................................................... |
23 |
|
3.2 |
Обработка результатов эксперимента........................................................ |
25 |
4 |
ВОПРОСЫ И ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО КОНТРОЛЯ |
|
|
ЗНАНИЙ................................................................................................................. |
27 |
||
5 |
ЛИТЕРАТУРА................................................................................................... |
30 |
|
3

1ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1Основные понятия и определения
Фаза - совокупность однородных частей системы, обладающих в любом элементе объёма одинаковыми химическими и термодинамическими свойствами и отделенных от других однородных частей поверхностями раздела.
Системы, содержащие одну фазу, называются гомогенными, две и более
- гетерогенными.
Таблица 1 – Примеры различных систем
|
Система |
Фазы |
Составные |
Компоненты |
|
|
|
части |
|
|
|
|
|
|
1 |
Н2О(тв)+Н2О(ж)+Н2О(г) |
1тв+1ж+1г= 3 |
1 |
1 |
2 |
Р (белый) + Р (красный) |
2 тв. |
1 |
1 |
3 |
Раствор(NaCl+KNО3+H2О)+NaС1тв |
1ж +1тв = 2 |
5 |
4 |
4 |
Раствор (С6Н6+С6Н5СН3) |
1ж |
2 |
2 |
5 |
С6Н6(ж)+Н2О(ж) |
2ж |
2 |
2 |
Составная часть системы (с.ч.) - химически индивидуальное вещество, которое можно выделить из системы и которое может устойчиво существовать вне её. Так, в системе 1 составная часть одна; в системе 2 тоже одна (фосфор); в системе 3 можно выделить пять химически индивидуальных веществ: NaCl, KNО3, NaNО3, KCI, H2О - следовательно, здесь пять составных частей.
Независимые компоненты, или просто компоненты системы (к), - это химически индивидуальные вещества, наименьшее число которых достаточно для образования системы. Если в системе между составными частями нет химического взаимодействия, то число составных частей равно
4
числу компонентов. Например, системы 4 и 5 имеют по две составные части и по два компонента. В системе 3 соли реагируют между собой по реакции:
NaCl + KNO3 
 NaNO3 + KCl
NaNO3 + KCl
и, следовательно, для составления системы 3, кроме Н2О, достаточно взять три любые соли из четырех. Значит, эта система, имея пять составных частей, является четырехкомпонентной.
Число независимых компонентов равно разности между числом составных частей и числом химических реакций (х.р.), протекающих между ними:
К = с.ч. – х.р.
Система является простой, если в ней между составляющими вещества ми не происходит химических взаимодействий.
Система является сложной, если в ней протекают химические реакции и составляющие ее вещества (все или часть их) зависят друг от друга.
Термодинамические степени свободы - параметры системы, которые можно произвольно и независимо друг от друга менять, не вызывая изменения числа и природы фаз системы.
Число термодинамических степеней свободы (С), (так называемая вариантность системы) при равновесии связано с числом компонентов (К) и числом фаз (Ф) закономерностью, которая называется правилом фаз Гиббса:
С = К - Ф + П,
где П - число внешних параметров; для однокомпонентной системы П = 2 (Р и Т), для двухкомпонентной системы П = 1 (Т, при Р = const). Если С = 0 - система инвариантна; С = 1 - моновариантна; С = 2 -дивариантна.
5

1.2Однокомпонентные системы
Воднокомпонентных системах могут быть одна, две или три устойчиво
существующих фазы: твердая, жидкая, газообразная. Наибольший практический интерес представляют двухфазные равновесные системы.
1.2.1 Универсальное уравнение Клапейрона – Клаузиуса
Фазовые превращения протекают при постоянстве температуры и давления. Условием фазового равновесия системы является равенство химического потенциала в обеих фазах, µl = µll. Химический потенциал µ равен приращению энергии Гиббса G данной фазы при добавлении к ней 1 моля компонента при P,T=const и постоянстве состава, то есть 



 p,Т.
p,Т.
Для однокомпонентной системы µi = Gi0 (энергия Гиббса чистого компонента), следовательно, для двухфазной системы Gl = Gll.
При изменении условий (Р, Т) система переходит из одного равновесного состояния в другое равновесное состояние, при этом Gl и Gll изменяются на одну и ту же величину:
dGΙ = dGΙΙ ,
V ΙdP − S ΙdT =V ΙΙdP − S ΙΙdT , (V ΙΙ −V Ι )dP = (S ΙΙ − S Ι )dT , dTdP = ∆∆VS .
Поскольку при фазовом превращении:
∆Sф.п. = |
∆Нф.п. |
, то |
dP |
= |
∆H ф.п. |
. |
(1) |
|
Тф.п. |
dT |
Тф.п. ∆Vф.п. |
||||||
|
|
|
|
|
Это уравнение называется универсальным уравнением Клапейрона – Клаузиуса. Оно дает зависимость давления от температуры равновесной однокомпонентной двухфазной системы. В форме (1) оно применимо к любому двухфазному равновесному превращению.
6
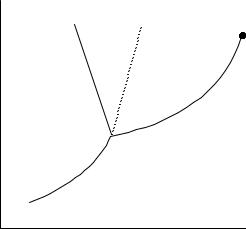
Пример диаграммы однокомпонентной системы приведен на рисунке 1.
Р |
|
А |
A' |
|
С |
|
ж |
тв |
О |
|
|
|
газ |
В |
|
|
Т |
Рисунок 1 – Диаграмма состояния однокомпонентной системы
ОВ – кривая возгонки; ОС – кривая кипения; ОА – кривая плавления (для Н2О); ОАl – плавление прочих веществ; точка С – критическая точка; точка О
– тройная точка.
Критическая точка отвечает критическому состоянию системы, при котором две фазы вещества, находящиеся между собой в термодинамическом равновесии, становиться тождественными по своим физическим свойствам.
Проанализируем это уравнение Клапейрона – Клаузиуса применительно к двум типам фазовых равновесных превращений.
1.2.2 Равновесие между двумя конденсированными фазами
Конденсированными называют обычно жидкие и кристаллические фазы. Между ними возможны равновесия: кристаллы 
 жидкость; кристаллы (α)
жидкость; кристаллы (α) 
 кристаллы (β) и т.п. Для фазового равновесия кристаллыжидкость уравнение (1) имеет вид:
кристаллы (β) и т.п. Для фазового равновесия кристаллыжидкость уравнение (1) имеет вид:
dP |
|
∆H пл. |
|
|
|
= |
|
. |
(2) |
dT |
Тпл. ∆Vпл. |
|||
|
|
7 |
|
|

При плавлении теплота поглощается (∆Нпл. > 0). Если Vж. > Vкр., то
∆Vпл.> 0 и ddPT f 0 или dTdP f 0 . Это значит, что увеличение давления вызывает
повышение температуры плавления. Подавляющее большинство веществ подчиняются этой закономерности (кривая ОАl, рисунок 1).
Однако, некоторые вещества, такие как вода, галлий, висмут, некоторые сорта чугуна, характеризуются меньшей плотностью кристаллической
решетки по сравнению с жидкой. Для них ∆Vпл < 0 и dTdP < 0, т.е. увеличение
давления приводит к понижению температуры плавления (кривая ОА, рисунок 1). Обычно ∆Vпл. мало (5·10-6 - 15·10-6 м3/моль) и мало зависит от Р и Т, поэтому dTdP имеет большие значения. Так, для С6Н6 ≈ 350·105 Па/К; для Н2О ≈ - 130·105 Па/К; для Sn ≈ 300·105 Па/К.
Приняв, что в небольшом |
интервале температур |
∆Нф.п. |
≈ соnst |
|||||||||
∆V |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
ф.п |
|
|
уравнение (1) можно проинтегрировать: |
|
|
|
|
|
|
|
|
||||
P |
|
|
∆H |
|
|
|
T |
dT |
|
|
|
|
∫2 dP = ∫ |
|
dT = |
∆H ∫2 |
, |
|
|
||||||
|
|
|
|
|
||||||||
P |
|
T∆V |
|
|
|
∆V T |
T |
|
|
|
||
1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
P = P + |
∆H ln |
T2 |
. |
|
|
|
|
(3) |
||||
|
|
|
|
|
||||||||
2 |
1 |
|
∆V |
|
T |
|
|
|
|
|
||
|
|
|
|
1 |
|
|
|
|
|
|
||
Это уравнение применимо только для равновесия между конденсированными фазами.
1.2.3 Равновесие между конденсированными и газообразными фазами
Это равновесие типа кристаллы 
 пар; жидкость
пар; жидкость 
 пар. Для этих фазовых равновесий dTdP всегда положительны, так как ∆Н > 0 и ∆V > 0. Это
пар. Для этих фазовых равновесий dTdP всегда положительны, так как ∆Н > 0 и ∆V > 0. Это
значит, что нагревание системы всегда вызовет увеличение давления насыщенного пара, а повышение внешнего давления приведет к повышению температуры кипения (линии ОВ и ОС на рисунке 1).
8
Приведем уравнение (1) к виду, более удобному для практического применения. Используем два приближения:
1. При температурах, далеких от критической, Vпар >> Vж; Vпар >> Vтв.;
∆V ≈ Vпар.
2. Вдали от критической температуры насыщенный пар подчиняется уравнению состояния идеальных газов, в случае n = 1 моль
Vпар = RTPкип. .
Тогда уравнение (1) преобразуется следующим образом:
|
|
|
dP |
= |
∆H P |
(4) |
|||
|
|
|
|
RT 2 |
|||||
|
|
|
dT |
|
|||||
или |
|
d ln P |
|
= |
∆H |
. |
(5) |
||
|
|
dT |
|
||||||
|
|
|
|
RT 2 |
|
||||
Учитывая, что ∆Нвозг |
= ∆Нисп + ∆Нпл, то есть ∆Нвозг |
> ∆Нисп, то |
|||||||
согласно уравнению (4) при одинаковых значениях Р и Т в этих процессах
( dTdP ) возг > ( dTdP )исп. Это означает, что угол наклона кривой возгонки больше
угла наклона кривой испарения.
Интегрирование уравнения (5) при условии ∆H ≠ f (T ) дает линейную
зависимость ln P от |
1 |
: |
d ln P |
= |
∆H |
|
dT , |
|
|
|
|
||||
T |
RT 2 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
ln P = − |
|
∆H |
|
1 |
+const |
|
(6) |
|||||
|
|
|
|
R |
T |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
∆H |
|
1 |
|
(7) |
|
|
|
|
P = const exp |
− |
|
|
|
|
|||||||
|
|
|
R |
T |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Таким образом, получили уравнение линейной зависимости
ln P = a T1 +b .
9
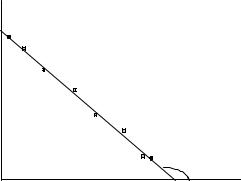
lnP |
(x1,y1) |
(x2,y2) |
tgα |
1/T |
Рисунок 2 – Зависимость давления насыщенного пара от температуры в координатах (ln P;1/Т)
a = − |
∆H |
= tgα - тангенс угла наклона прямой к оси абцисс: tgα = |
y2 |
− y1 |
, |
|
x2 |
|
|||
|
R |
|
− x1 |
||
где (y2; х2), (y1; х1) – координаты двух точек, лежащих на прямой. Определив «a», можно найти теплоту испарения:
∆Н = - Rtgα,
где R=8,31 Дж/(моль·К).
Интегрирование уравнения в определенных пределах приводит к уравнению:
|
P2 |
∆H |
|
1 |
1 |
|
, |
(8) |
|
|
|
|
|
|
|
|
|
||
ln P |
= − R |
|
− T |
||||||
T |
|
||||||||
1 |
|
|
2 |
1 |
|
|
|
||
с помощью которого можно рассчитать теплоту испарения по двум экспериментальным значениям давлений и температур.
Согласно эмпирическому правилу Трутона, молярная энтропия испарения при нормальной температуре кипения для многих жидкостей постоянна и равна:
∆Sисп = |
∆Нисп ≈89 |
Дж |
, |
(9) |
|
моль К |
|||||
|
Тн.т.к. |
|
|
||
|
10 |
|
|
|
