
Beusheva_fr1
.pdf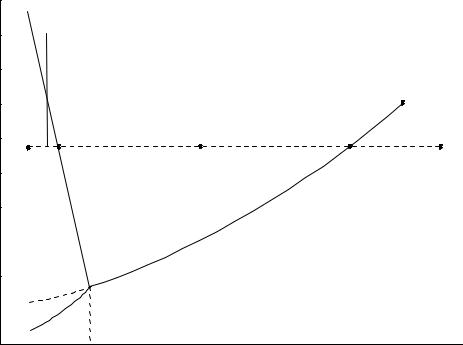
где Тн.т.к. – нормальная температура кипения при Р = 1 атм.
Для полярных жидкостей с сильными межмолекулярными взаимодействиями ∆Sисп. превышает данную величину. Например, для воды она равна 109 Дж/(моль·К).
1.2.4 Диаграмма состояния воды при средних давлениях
В однокомпонентных системах фазы состоят из одного вещества в различных агрегатных состояниях. На рисунке 3 приведена диаграмма воды в области средних давлений (до нескольких десятых МПа).
р A
n
m |
|
|
C |
a b |
c |
d |
e |
k |
|
|
|
D |
0 |
|
|
B |
t,0С |
|
E |
Рисунок 3 – Диаграмма состояния воды при средних давлениях (до 1 МПа)
Три кривые разбивают диаграмму на поля, каждое из которых отвечает одному из агрегатных состояний воды – пару, жидкости или льду. Кривые отвечают равновесию между соответствующими двумя фазами. Кривая ОС характеризует зависимость давления насыщенного пара жидкой воды от температуры и называется кривой испарения; эта кривая описывается уравнением (4) Клапейрона – Клаузиуса. Кривая ОА – зависимость
11
температуры замерзания воды от внешнего давления, называется кривой плавления и описывается уравнением (1) Клапейрона – Клаузиуса. Кривая ОВ
– зависимость давления насыщенного пара льда от температуры и называется кривой возгонки и также может быть описана уравнением (4) Клапейрона – Клаузиуса. Кривая ОD определяет давление насыщенного пара над переохлажденной водой. Такое состояние неустойчиво, так как переохлажденная вода всегда обладает бóльшим давлением пара, то есть бóльшим химическим потенциалом, чем лед при той же температуре. Переохлажденная вода находится в метастабильном равновесии с паром. При внесении в такую воду нескольких кристалликов льда произойдет быстрое замерзание ее. Точка О выражает условия одновременного равновесия между паром, льдом и жидкой водой.
Проведем изобарический нагрев воды через точки a, b, c, d, e. В точке а находится одна твердая фаза, число степеней свободы С = 3 - 1 = 2. Это означает, что в известных пределах можно изменять независимо температуру и давление и это не вызовет изменения числа и вида фаз системы. В точке b в равновесии находятся две фазы: твердая и жидкая, поэтому число степеней свободы С = 3 – 2 = 1. Это указывает на возможность произвольного изменения или температуры, или давления. В точке с находится одна жидкая фаза, число степеней свободы С = 3 - 1 = 2. В точке d в равновесии находятся две фазы: жидкая и пар, поэтому число степеней свободы С = 3 – 2 = 1. В точке е находится одна фаза - пар, число степеней свободы С = 3 - 1 = 2.
В точке О в равновесии сосуществуют три фазы и число степеней свободы С = 3 - 3 = 0, то есть система безвариантна. Это означает, что фазы воды могут находиться в равновесии только при определенных условиях: Р = 610 Па и Т = 273,1576 К (0,0076 0С). Если к системе в тройной точке подводить теплоту, то она будет расходоваться на плавление льда, но ни температура, ни давление пара не изменятся до тех пор, пока в системе
сосуществуют три фазы, так как С = 0. Охлаждение |
системы в тройной |
точке вызовет образование льда, и пока вся вода не |
превратится в лед, |
12 |
|
температура и давление пара будут оставаться постоянными; при дальнейшем охлаждении системы, когда останутся только две фазы (лед и пар), система станет одновариантной и процесс конденсации пара пойдет в соответствии с кривой ОВ.
При атмосферном давлении (1,0133·105 Па) лед тает при более низкой температуре, чем в тройной точке. Это объясняется тем, что кривая равновесного сосуществования воды и льда наклонена влево и плотность льда меньше, чем воды.
Если изотермически повышать давление (например, как показано на рисунке 3, через точки k, m, n), то лед расплавится.
1.2.5 Диаграмма состояния воды при высоких давлениях
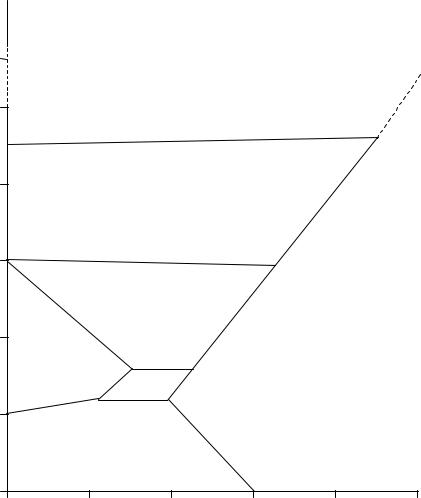
Лед имеет семь модификаций I-VII. Диаграмма состояния воды при высоких давлениях представлена на рисунке 4.
Наименьшей плотностью обладает обычный лед I, устойчивый при невысоких давлениях; с повышением давления температура его плавления понижается. Обычный лед обладает очень рыхлой кристаллической структурой, но при высоких давлениях он переходит в более плотные кристаллические модификации. Лед II находится в равновесии только с твердыми фазами I, III и V, остальные же модификации льда – в равновесии как с твердыми фазами, так и с водой. Модификации льда III – VII обладают бóльшей плотностью, чем жидкая вода; поэтому их кривые плавления имеют на диаграмме наклон вправо. Плотность льда VI при 273 К почти 1,5 раза больше, чем льда I.
В рассмотренной диаграмме имеется семь тройных точек, отвечающих безвариантным системам. Каждой из них соответствуют определенные температура и давление.
13
р |
|
|
|
|
|
|
|
40000 |
|
|
|
|
|
|
1920 |
|
|
|
|
|
|
VII |
|
10000 |
|
|
|
|
|
39000 |
|
|
|
|
|
|
G |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
820 |
|
|
|
|
|
|
|
22000 |
|
8000 |
|
|
|
|
|
|
|
|
|
VI |
|
|
|
|
|
K |
|
|
|
|
|
|
|
6000 |
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
4000 |
|
V |
|
|
|
|
|
II |
S |
|
|
|
|
|
|
|
D |
|
|
|
|
||
|
F |
III |
|
IV |
|
|
|
|
C |
|
|
|
|
||
2000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
0 |
|
|
|
|
|
|
0 |
-60 |
-40 |
|
-20 |
0 |
20 |
40 |
t, С |
Рисунок 4 – Диаграмма состояния воды при высоких давлениях |
|||||||
|
|
(до 4000 МПа) |
|
|
|
|
|
1.2.6 Диаграмма состояния серы
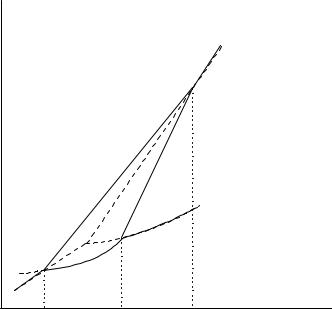
Сера может находиться в четырех фазах: парообразной, жидкой и двух кристаллических (сера ромбическая и сера моноклинная), условия существования фаз приведены на диаграмме состояния серы (рисунок 5). На диаграмме имеются четыре области Sромб, Sмон, Sж, Sп, отвечающие
устойчивому существованию четырех фаз серы.
14
р
Е
В
Sромб
|
S |
м |
о |
н |
|
С |
|||
H |
|
|||
|
|
|||
|
|
|
|
G A
D
95,40 1200
жидк. F
пар
t,0С
1510
Рисунок 5 – Диаграмма состояния серы
Полиморфное превращение, когда данная кристаллическая модификация при изменении внешних условий, например температуры, переходит в другую модификацию и при восстановлении прежних условий возвращается в первоначальную форму, называется энантиотропным превращением.
Полиморфное превращение, когда самопроизвольный переход одной метастабильной модификации в другую возможен, а обратный самопроизвольный переход неосуществим, называется монотропным
превращением.
Примером энантиотропного превращения может служить переход ромбической серы в моноклинную и обратно. Если ромбическую серу Sромб нагревать, то выше 368,5 К она будет превращаться в моноклинную серу Sмон; при 368,5 К обе формы находятся в равновесии.
Кривая АВ показывает, как изменяется температура превращения
Sромб Sмон с изменением давления. Кривая СВ характеризует изменение
15

температуры плавления Sмон с изменением давления: с повышением давления температура плавления Sмон увеличивается и поэтому кривая СВ имеет наклон вправо. Из универсального уравнения Клапейрона – Клаузиуса
dTdP = Тф.п. ∆Vф.п. следует, что для процесса плавления величина ∆Vпл
положительна, то есть удельный объем Sж больше удельного объема Sмон. При давлении больше 130 МПа (выше точки В) сера ромбическая
превращается при нагревании в жидкую фазу, минуя фазу Sмон, которая является устойчивой только в области АВС.
Кривая DA характеризует равновесие Sромб - Sп, кривая АС – равновесие Sмон - Sп, кривая CF – равновесие Sж - Sп.
Кривые АН, НС, НВ, GA относятся к метастабильным равновесиям. Кривая GA – продолжение кривой АС в области устойчивости Sромб –
показывает давление паров Sмон в метастабильном состоянии.
Кривая АН - продолжение кривой DA в области устойчивости Sмон – кривая упругости пара над перегретой Sромб.
Кривая НС - продолжение кривой CF - кривая упругости пара над переохлажденной Sж.
Кривая НВ показывает, как изменяется метастабильная точка плавления Sромб с давлением.
На диаграмме состояния серы имеются четыре тройные точки. Точка А отвечает безвариантному равновесию трех фаз: двух твердых (Sромб и Sмон) и одной газообразной и называется точкой превращения. В точке С при 393 К моноклинная сера плавится; здесь осуществляется безвариантное равновесие трех фаз серы: жидкой, твердой Sмон и парообразной. В точке В в равновесии с жидкой серой Sж находятся две ее кристаллические модификации. В точке Н сосуществуют перегретая Sромб (кривая НВ), переохлажденная Sж (кривая НС) и пересыщенный пар (кривая АН), давление которого выше давления пара, равновесного с моноклинной серой (кривая АС). В точке Н три неустойчивые фазы образуют метастабильную, малоустойчивую систему.
16
2 ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Задача 1
Зависимость температуры плавления нафталина от давления выражается уравнением: tпл = 80,10 + 0,0371 10-5P(Па) – 186,99 10-18Р2 (Па).
Рассчитать изменение объема при плавлении 1 кг нафталина при Р = 1 атм, если его теплота плавления равна 138,6 Дж/г.
Дано:
mнафт. = 1 кг
∆Нпл. = 138,6 Дж/г Р = 1 атм = 1,0133 105 Па
∆Vпл. - ?
Решение
C10H8 (тв)  C10H8 (ж)
C10H8 (ж)
Для фазовых переходов конденсированных фаз применяется уравнение:
dP |
= |
|
∆Η |
. |
|
|
|
|
|
|
dT |
|
|
|
|
|
|
|
|||
|
|
Τ∆V |
|
|
|
|
|
|
||
|
|
Определим сначала производную |
dT |
. Так как Т = t + 273,15; |
dT |
= |
dt |
; |
||
|
|
dP |
dP |
dP |
||||||
|
|
|
|
|
|
|
|
|||
dPdt = 0,0371 10−5 −2 186,99 10−18 Ρ = 0.0371 10−5 −2 186,99 10−18 1,0133 105 =
= 0,0371 10−5 К / Па
Откуда dPdt = ddPT = (0,0371 10−5 )−1 = 2,69 106 Па/ К
tпл =80,10 +0,0371 10−5 1,0133 105 −186,99 10−18 (1,0133 105 )2 =80,14 0С
Тпл = 273,15 +80,14 = 353,29К |
|
||||
∆V = |
∆Н |
= |
138,6 1000 |
=145,8 10−6 м3 =145,8 см3 |
|
(dP / dT ) T |
2,69 106 353,29 |
||||
|
|
|
|||
Задача 2
Давление пара хлороформа при 50 0С равно 535 мм рт. ст., теплота испарения хлороформа 30,836 кДж/моль. Определить нормальную температуру кипения хлороформа.
Дано:
T1=50 0C = 323 К
Р1 = 535 мм рт. ст.
Р2 = 1 атм = 760 мм рт.ст.
17
∆Нисп. = 30,836 кДж/моль
Т2 кип. - ?
Решение
Нормальная температура кипения (н.т.к.) – температура кипения при Р = 1 атм.
CHCl3 (ж) 
 CHCl3 (пар)
CHCl3 (пар)
Для решения используется уравнение для фазового перехода с участием газов:
|
|
|
P2 |
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|||||
ln |
|
|
|
|
|
∆Hисп |
|
|
|
|||||||||||
|
|
|
|
= − |
|
R |
|
|
|
− |
|
|
||||||||
|
P |
|
T |
T |
||||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
2 |
|
|
1 |
|
||||
|
|
|
|
|
|
1 |
|
|
|
P2 |
|
|
|
R |
||||||
|
1 |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
− T |
|
|
P |
|
∆Η |
|
|||||||||||
T |
|
|
= − ln |
|
|
исп |
||||||||||||||
|
2 |
|
|
1 |
|
|
|
1 |
|
|
|
|
|
|||||||
1 |
|
|
= |
|
1 |
|
|
−0,946 10−5 |
|
|
||||||||||
T |
|
|
323 |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
760 |
8,31 |
|
|
−5 |
|
= − ln |
|
|
|
= −9,46 |
10 |
|
535 |
30,836 103 |
|
||||
|
|
|
|
|
||
Т2 = 333 К
Примечание. В данной задаче теплота испарения в данном температурном интервале принята постоянной, поэтому было использовано уравнение для ∆Н = соnst.
Если же ∆Нисп. = f (Т), то надо использовать дифференциальное уравнение для нахождения ∆Нисп или ∆Нвозг.
Задача 3
Под давлением 0,1013 МПа лед плавится при 273 К. Удельный объем льда при 273 К равен 991,1 см3/кг, а воды – 916,6 см3/кг. Молярная теплота плавления льда равна 6010 Дж/моль. Вычислить давление, при котором лед будет плавиться при 271 К.
Дано:
P1=1,013·105 Па
T1=273 К
Vл=991,1·10-6 м3/кг
Vв=6010 10-6 Дж/моль
Т2=271 К
18

Р2 - ?
Решение
|
Дж |
|
Дж |
||
∆Н |
|
|
→ ∆Н |
|
|
|
кг |
||||
|
моль |
|
|
||
∆Нпл = 6010 103 /18,01 = 333,6 103 Дж/ кг
Изменение удельного объема при плавлении льда:
∆V =Vж −Vт = (916,6 −991,1) 106 = −74,5 10−6 м3 / кг
Знак минус показывает, что при плавлении льда объем системы уменьшается (вода тяжелее льда).
Вычислим величину |
dT |
по уравнению |
dT |
= |
T∆V |
; |
|
dP |
|
dP |
|
∆Hпл |
|
dTdP = −273 74,5 10−6 /(333,6 103 ) = −0,061 10−9 К/Па
Отрицательное значение dTdP показывает, что при увеличении давления
(dP f 0) температура плавления понижается (dT p 0) .
Учитывая слабую зависимость температуры перехода между конденсированными фазами от давления, можно записать: dTdP ≈ ∆∆TP . Из этого
уравнения |
∆P = ∆T / |
dT |
; |
∆T = 271−273 = −2 |
|
dP |
|||||
|
|
|
|
||
∆P = −2 /−0,0612 10−9 |
= 328 105 Па |
||||
∆P = P2 − P1
P2 = P1 + ∆P =1,013 105 +328 105 = 329,01 105 Па
Задача 4
Спомощью фазовой диаграммы однокомпонентной системы (Рисунок
6)показать соотношение объемов для фаз 1,2 и 3 вблизи тройной точки. Фаза 1 – твердая; 2 – пар; 3 – жидкость.
Решение:
19

р |
|
тв. |
ж. |
|
|
|
3 |
|
1 |
|
2 |
|
пар |
|
T |
Рисунок 6 – Фазовая диаграмма к задаче 4 |
|
|
|
Из рисунка 6 |
видно, что для фазовых переходов 1 → 2 ; |
и 3 → 2 |
||||
производные |
dP |
f 0 , следовательно, больше нуля и правая часть уравнения |
||||||
|
||||||||
|
|
|
|
|
dT |
|
|
|
|
dP |
= |
∆H |
. |
Для |
всех трех фазовых переходов имеем ∆H ф.п. f 0 , т.к. |
||
|
dT |
|
||||||
|
|
T∆V |
|
|
|
|
||
процессы плавления и превращения в пар жидких и твердых тел являются эндотермическими.
Для фазового перехода 1 → 2 ∆V =V2 −V1 f 0 , т.е. V2 fV1 ;
для перехода 1 →3 ∆V =V3 −V1 f 0 , то есть V3 fV1 ;
для перехода 3 → 2 ∆V =V2 −V3 f 0 , т.е. V3 fV2 .
Таким образом, V2 fV3 fV1 .
Задача 5
Плотность твердого фенола 1072 кг/м3, жидкого 1056 кг/м3, теплота его плавления 1,044·105 Дж/кг, температура замерзания 314,2 К. Вычислите dP/dT и температуру плавления фенола при 5,065·107 Па.
20
