
Beusheva_fr1
.pdf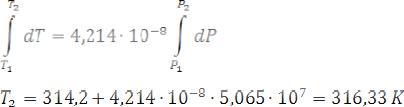
Дано:
ρтв =1072 кг/м3
ρж =1056 кг/м3
∆Нпл =1,044·105 Дж/кг
Тзам=314,2 К
Р=5,065·107 Па
Тпл - ?
dP/dT - ?
Решение
По уравнению Клапейрона-Клаузиуса рассчитываем dP/dT:
|
dP |
= |
|
∆H пл |
|
|
; |
|
|
|
|
|
|
|||||
|
dT |
|
Т(V |
- V |
) |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
ж |
|
тв |
|
|
|
|
|
|
|
|
|
∆V = |
1 |
− |
|
1 |
= |
|
1 |
|
− |
|
1 |
= (0,947 −0,933) 10−3 |
= 0,014 10−3 |
|||||
|
|
|
1056 |
|
1072 |
|||||||||||||
|
|
|
|
ρж |
ρтв |
|
|
|
|
|||||||||
dP |
= |
|
|
1,044 105 |
= 2,373 107 Па/К |
|
||||||||||||
dT |
314,2 0,014 10−3 |
|
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||
dT |
= 4,214 10−8 К/Па |
|
|
|
|
|
||||||||||||
dP |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Чтобы вычислить Тпл при заданном внешнем давлении, принимаем, что dP/dT в интервале давлений 1,0133·105 – 5,065·107 Па – величина постоянная, равная 4,214·10-8 К/Па. Тогда
Задача 6
Вычислите среднюю теплоту испарения СН4 в интервале температур от 88,2 до 113 К, использую следующие данные:
21
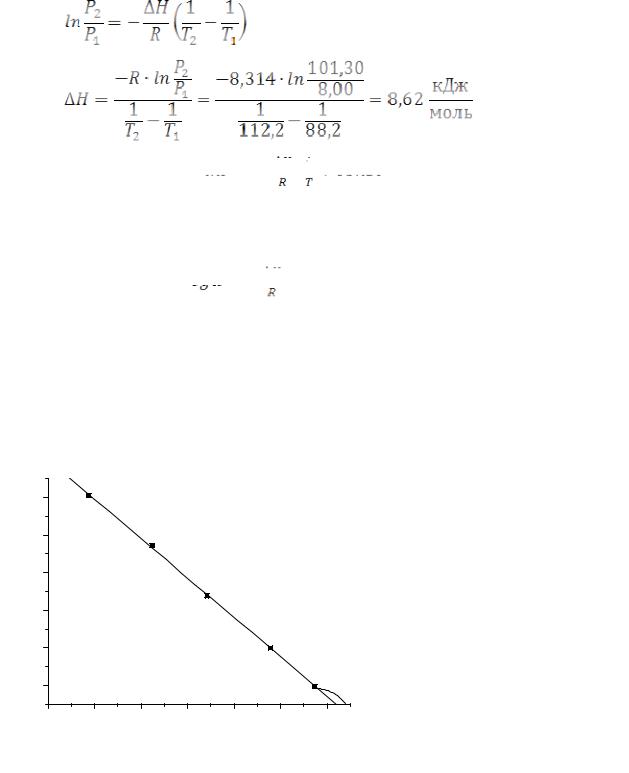
Т, К |
88,2 |
92,2 |
98,2 |
104,2 |
112,2 |
Р·10-3, Па |
8,00 |
13,31 |
26,62 |
52,24 |
101,30 |
Решение:
Расчет можно провести двумя путями: 1) По уравнению:
2) По уравнению 


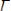















 , из которого следует, что
, из которого следует, что
зависимость lnP от 1/Т выражается прямой линией (Рисунок 7). Теплоту испарения можно определить по тангенсу наклона прямой,
который равен: 





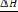 -. Вычисляем lnP и 1/Т:
-. Вычисляем lnP и 1/Т:
|
|
|
|
|
|
(1/Т) ·103 |
11,37 (х1) |
10,89 |
10,21 |
9,62 (х2) |
8,94 |
lnP |
8,987 (у1) |
9,496 |
10,189 |
10,864 (у2) |
11,526 |
lnp
11,5 |
|
|
|
|
|
|
11,0 |
|
|
|
|
|
|
10,5 |
|
|
|
|
|
|
10,0 |
|
|
|
|
|
|
9,5 |
|
|
|
|
|
|
9,0 |
|
|
|
|
|
α |
8,5 |
9,0 |
9,5 |
10,0 |
10,5 |
11,0 |
1/T .103 |
11,5 |
||||||
|
Рисунок 7 - Зависимость lnP от 1/Т для испарения СН4 |
|||||
22
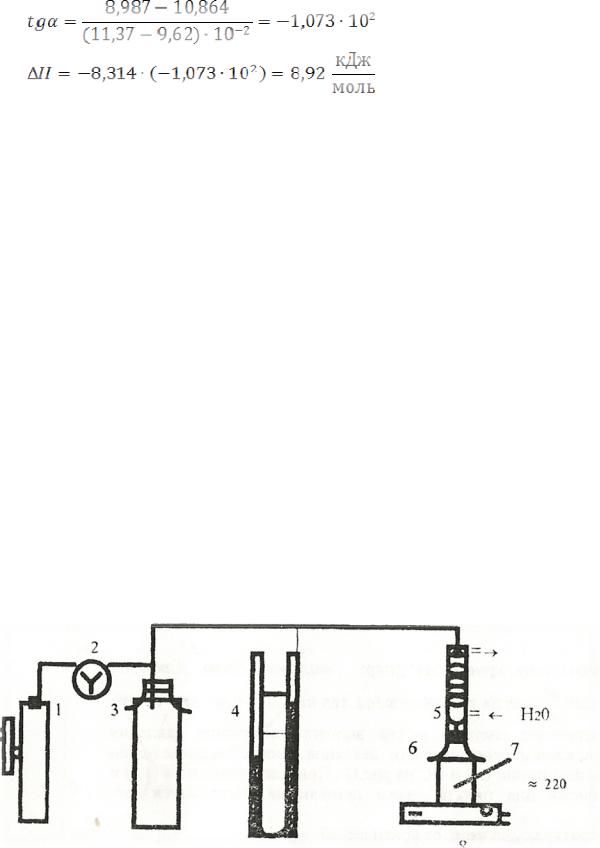
3 ЭКСПЕРЕМЕНТАЛЬНАЯ ЧАСТЬ Целью данной работы является исследование динамическим методом
температурной зависимости давления насыщенного пара при испарении жидкости и определение теплоты испарения.
При испарении при Т = const со временем наступает такое состояние, когда число молекул, переходящее в любой отрезок времени из жидкости в пар, сравняется с числом молекул, переходящих за то же время из пара в жидкость. Это состояние называется динамическим равновесием. Пар, находящийся в динамическом равновесии с жидкостью, называется насыщенным паром. Давление насыщенного пара зависит от температуры и определяется уравнениями (4-8).
3.1 Описание установки и порядок работы
Установка (Рисунок 8) состоит из вакуумного насоса 1, последовательно соединенного резиновым вакуумным шлангом с трехходовым краном 2, буферной емкостью 3, ртутным манометром 4, шариковым водяным холодильником 5, колбы 6 с исследуемой жидкостью, термометра 7, электронагревательного прибора 8 и барометра.
Рисунок 8 - Установка для изучения динамического равновесия жидкостьпар
23
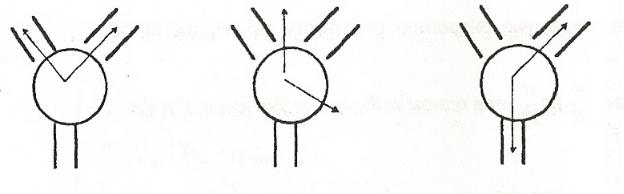
Перед началом работы необходимо подсоединить резиновым шлангом шариковый водяной холодильник 5 к водопроводному крану и заполнить его проточной холодной водой. Затем, поставив кран 2 в положение 1 (Рисунок 9), с помощью вакуумного насоса создать в системе разрежение ∆P=600 мм рт. ст., т.е. правый столбик ртути в U-образной трубке должен подняться на 300 мм вверх, а левый – опуститься на 300 мм.
Установить кран 2 в положение 2 и включить нагревательный прибор 8 в сеть. Подождать пока жидкость начнет стабильно кипеть, а температура ее перестанет подниматься. Полученное значение температуры занести в таблицу. Затем кран 2 поставить в положение 3 и уменьшить ∆Р на 40 мм рт. ст., т.е. правый столбик ртути должен опуститься на 20 мм, а левый подняться на 20 мм. Установить кран в положение 2 и замерить температуру кипения при установленном давлении.
Рисунок 9 - Положение крана, соединяющего систему с насосом (1); атмосферой (3); перекрывающего систему (2).
Таким образом, повторяют опыт каждый раз, повышая давление в системе на 40 мм рт. ст. до установления нулевого перепада давления. После окончания эксперимента записывают с барометра барометрическое давление. Полученные результаты заносят в таблицу 1.
24
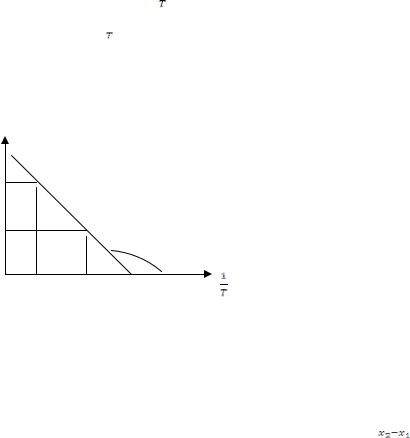
Таблица 1 – Зависимость давления от температуры кипения по экспериментальным данным
∆Р |
Рсист = Рбар - ∆Р |
lnРсист |
Ткип, К |
1/Т |
600 |
|
|
|
|
560 |
|
|
|
|
520 |
|
|
|
|
480 |
|
|
|
|
440 |
|
|
|
|
400 |
|
|
|
|
360 |
|
|
|
|
320 |
|
|
|
|
280 |
|
|
|
|
240 |
|
|
|
|
200 |
|
|
|
|
160 |
|
|
|
|
120 |
|
|
|
|
80 |
|
|
|
|
40 |
|
|
|
|
0 |
|
|
|
|
3.2 Обработка результатов эксперимента
По измеренным значениям давления и температуры выполнить следующее:
1.Построить график зависимости ln P = ƒ( )
)
2.Найти уравнение прямой ln P = a  + b по данным рисунка 10.
+ b по данным рисунка 10.
Коэффициенты а, b можно наиболее точно рассчитать методом наименьших квадратов. Приближенное значение a можно найти из графика (Рисунок 10)
ln P
(y1,x1)
(y2,x2)
α
Рисунок 10 - Зависимость давления насыщенного пара от температуры в координатах lnP - 1/T
а = - (∆Н / R) = tgα – определяется как тангенс угла наклона прямой к оси абсцисс. Тангенс рассчитывают следующим образом: tgα =  ,
,
25

где {y1,x2} ,{y1,x1}- координаты двух точек, лежащих на прямой. Точки (не обязательно экспериментальные) выбирать отстоящими подальше друг от друга.
Коэффициент b из графика найти невозможно, если в начале координат не 0. Поэтому найти b можно из уравнения (6) для какой-либо точки, лежащей на прямой.
3.Рассчитать теплоту испарения из графика: ∆H = -R tgα, где tgα = а, R = 8,13 Дж\моль·К.
4.Построить график зависимости P = f(T).
5.Рассчитать теплоту испарения по двум экспериментальным значениям давления и температуры по уравнению
|
P2 |
|
|
|
1 |
1 |
|
|
|
|
∆Hисп |
|
|||||
ln |
|
= − |
R |
|
|
− |
|
. |
P |
T |
T |
||||||
|
1 |
|
|
|
2 |
1 |
|
|
Чтобы избежать большой ошибки, следует брать значение Р1 и Р2 в таблице экспериментальных значений не соседние, а с большой разницей.
6.Вычислить молярную энтропию испарения, используя значения ∆H, рассчитанные в п.3 и 5. Проверить правило Трутона.
Молярная энтропия испарения рассчитывается по уравнению



 .
.
По правилу Трутона ∆S ≈ 88 Дж/моль·К
Ткип - это средняя температура изучения фазового превращения:
,
где Т1 - температура кипения при максимальном разрежении; Т2 - температура кипения при атмосферном давлении.
7. Определить |
|
|
и |
|
|
|
при одном выбранном значении Р и Т по |
||
|
|
|
|||||||
уравнению |
|
|
dP |
|
= |
∆H P |
, используя значение ∆H, при котором |
||
|
|
dT |
|
RT 2 |
|||||
|
|
|
|
|
|
||||
получилось значение ∆S ближе к правилу Трутона.
26
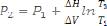
4 ВОПРОСЫ И ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО КОНТРОЛЯ ЗНАНИЙ
1.Что называется фазой, составной частью системы, независимым компонентом?
2.Что называется термодинамической степенью свободы? Сформулируйте правило фаз Гиббса.
3.Поясните термины «гомогенная система», «гетерогенная система», «простая система», «сложная система».
4.Вывести уравнение Клапейрона - Клаузиуса (универсальное).
5.Получить уравнение Клапейрона – Клаузиуса для перехода жидкостьпар. Проинтегрировать его.
6.Получить уравнение Клапейрона – Клаузиуса для перехода жидкостьтвердая фаза.
7. |
Можно ли для расчета ∆Нпл использовать уравнение |
dP |
= |
∆H P |
? |
|||||
|
|
RT 2 |
||||||||
|
|
|
dT |
|
|
|||||
8. |
Можно ли для расчета ∆Нпл использовать уравнение |
d ln P |
= |
∆H |
|
? |
||||
|
dT |
RT 2 |
|
|||||||
|
|
|
|
|
|
|
||||
9. |
Можно ли рассчитать ∆Нисп по уравнению |
|
|
|
|
|
? |
|
|
|
|
|
|
|
|
|
|
||||
10.Какими точками начинается и заканчивается кривая зависимости давления насыщенного пара жидкости от температуры на диаграмме воды?
11.Путем анализа уравнения Клапейрона - Клаузиуса объясните, почему давление насыщенного пара над твердой фазой всегда растет при увеличении температуры.
12.Путем анализа уравнения Клапейрона - Клаузиуса объясните, почему с повышением давления температура плавления льда понижается, а ртути – повышается.
13.Сколько термодинамических степеней свободы в тройной точке?
14.Изобразить диаграмму состояния серы и охарактеризовать линии равновесия устойчивых состояний серы.
15.Изобразить диаграмму состояния серы и охарактеризовать линии равновесия метастабильных состояний серы.
27
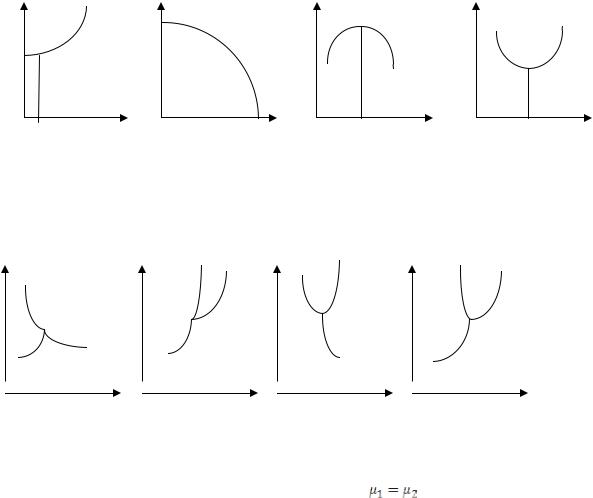
16.Изобразить диаграмму состояния серы и охарактеризовать тройные точки.
17.В чем различие энантиотропных и монотропных превращений.
18.Плотность жидкого галлия больше плотности твердого галлия. Как изменится температура плавления этого металла при повышении давления?
19.Как можно осуществить непрерывный переход из жидкого состояния в газообразное, чтобы система все время оставалась однофазной?
20.Чему равно изменение энтропии при переходе жидкости в пар при критической температуре?
21.В чем заключается правило Трутона?
22.Выбрать правильный график. Объясните, исходя из свойств фаз в критическом состоянии
∆Hисп |
∆Нисп |
∆Нисп |
∆Нисп |
Tkp |
T |
Tkp T |
Tkp T |
Tkp T |
23.Что такое насыщенный пар?
24.Диаграмма воды: выбрать правильный график и объяснить ход кривых.
P P P P
T T T T
25. Найти условие фазового равновесия:
а) U1 = U2 , б) H1 = H2, в) Т1 = Т2, г)
26. Какая из кривых: плавления, возгонки, испарения идет наиболее круто? Обосновать, исходя из уравнения Клапейрона - Клаузиуса.
28

27. Для какого перехода  будет больше:
будет больше:
а) сера ромбическая → сера моноклинная, б) сера ромбическая → сера парообразная.
28.Какая из кривых давлений насыщенного пара будет иметь более крутой наклон: а) над твердой фазой; б) над жидкой фазой? Пояснить, применяя уравнение Клапейрона - Клаузиуса.
29.Почему при нагревании на воздухе твердый йод, минуя жидкое состояние, сразу переходит в газообразное? Объясните, используя диаграмму.
30.Объясните, почему при нагревании на воздухе твердый нафталин, минуя жидкое состояние, сразу переходит в газообразное состояние?
31.Зависимость давления насыщенного пара ртути от температуры имеет
вид lnP = - 7535\T - 1,500 lnT + 27,83.
Выведите уравнение зависимости теплоты испарения ртути от температуры.
32. |
Теплоты испарения TiCl4, CS2 |
и C6 |
H6 при Р = 1 атм |
равны |
||
соответственно: 40,2; |
27,5; и 33,9 |
кДж/моль. Расположите эти вещества в |
||||
порядке уменьшения нормальной температуры кипения. |
|
|
||||
33. |
Нормальные |
температуры |
кипения |
CCl4, TiCl4, |
PCl3 |
равны |
соответственно: 76,7; 136,0 и 74,2 ˚С. Расположите эти вещества в порядке увеличения молярной теплоты испарения.
34.Что называется критической температурой?
35.Почему с повышением давления температура плавления висмута понижается, а калия повышается?
36.Плотность жидкого галлия больше плотности твердого галлия. Как изменится температура плавления этого металла при повышении давления?
37.Давление насыщенного пара H2SO4 при 178 ˚С равна 5 мм рт.ст., а при 24,5 ˚С - 20 мм рт.ст. Найти теплоту испарения.
29
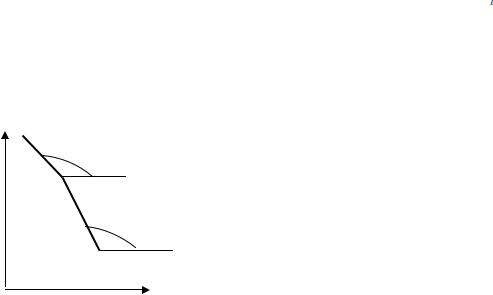
38.Рассчитайте молярное изменение энтропии при изотермическом испарении CBr4 при Р =1атм, если зависимость давления насыщенного пара от температуры выражается уравнением lnP (Па) = 25,05 - 6130 .
.
39.Для серебра зависимость давления насыщенного пара от температуры имеет вид (аb - над жидкой фазой; ас - над твердой фазой):
lnP b |
ж. |
|
β |
|
а |
г. |
тв. |
α |
|
|
с |
1\T
Рассчитайте молярную теплоту плавления серебра в тройной точке, если tg α = -14020; tg β = -13340.
40. До какого значения нужно снизить давление, чтобы температура кипения диэтиланилина упала до 190 ˚С, если в нормальных условиях он кипит при 215,5 ˚С, а средняя теплота его испарения равна 48,5 кДж/моль?
5 ЛИТЕРАТУРА
1 Стромберг, А. Г. Физическая химия [Текст] / А. Г. Стромберг, Д. П. Семченко. - М.: Высшая школа, 2006. - 527 с.
2 Стенникова, М. Ф. Руководство по физической химии. Часть 1: учебное пособие: в 2 ч. / М. Ф. Стенникова, Н. П. Мусько, О. С. Беушева, Н. Г. Комарова; Алт. гос. техн. ун-т им. И. И. Ползунова. – Барнаул: Изд-во АлтГТУ, 2011. Ч. 1. - 77 с.
3Краткий справочник физико-химических величин / под ред. А. А. Равделя, А. М. Пономаревой. - СПб.: «Иван Федоров», 2002.-240 с.
4Базаров И.П. Термодинамика: Учебник. 5-е изд., стер. – СПб.: Изд-во
«Лань», 2010. – 384 с.
30
