
- •Свойства
- •Введение
- •1 Общая характеристика растворов
- •2 Внутреннее строение растворов
- •3 Процесс растворения. Растворимость. Энергетика процесса растворения
- •4 Концентрации растворов
- •4.7 Расчеты, связанные с взаимным переходом одних форм выражения концентраций в другие
- •4.8 Расчеты, связанные со смешиванием растворов разных концентраций; из сухих солей и воды
- •Общие примеры решения задач при смешивании и разбавлении растворов
- •4.9 Расчеты по уравнениям реакций. Закон эквивалентов
- •5 Диффузия и осмос
- •6 Давление насыщенного пара растворов. Тонометрический закон рауля
- •7 Температура кипения
- •И кристаллизация растворов.
- •Эбулиоскопический и криоскопический
- •Законы рауля
- •8 Свойства растворов электролитов. Методы определения стеПени электролитической диссоциации
- •9 Рекомендации для самостоятельной работы, контрольные вопросы и требования к знаниям и умениям
- •9.1. Рекомендации
- •9.2. Вопросы для самоконтроля
- •9.3 Требования к знаниям и умениям
- •10 Задачи и упражнения
- •10.1 Растворимость. Энергетика процесса растворения
- •10.2 Процентная концентрация
- •10.3. Молярная и эквивалентная концентрация. (молярность, нормальность)
- •10.4. Моляльная концентрация (моляльность) , мольная доля, титр
- •10.5. Свойства растворов неэлектролитов, зависящие от концентрации частиц
- •10.5.1. Осмотическое давление разбавленных растворов неэлектролитов. Закон Вант-Гоффа
- •10.5.2. Давление насыщенного пара растворов. Тонометрический закон Рауля.
- •10.5.3. Температура кипения и кристаллизации растворов. Эбулиоскопический и криоскопический законы Рауля.
- •10.6 Свойства растворов электролитов. Методы определения степени электролитической диссоциации
- •11 Экспериментальная часть приготовление растворов заданной концентрации
- •Варианты расчетов
- •Библиографический список
- •Содержание
- •Свойства растворов электролитов и неэлектролитов
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
4.9 Расчеты по уравнениям реакций. Закон эквивалентов
Пример 15. На нейтрализацию 200 мл раствора щелочи израсходовано 300 мл 0,3 н раствора кислоты. Определите нормальную концентрацию раствора щелочи. Дополните условие задачи так, чтобы можно было определить: а) молярность; б) процентную концентрацию. Произведите расчет.
Решение: Зная, что объемы нормальных объемов веществ, вступивших в реакцию, обратно пропорциональны нормальным концентрациям веществ в растворах, запишем V1:V2=Cн2:Сн1 или V1:Сн1=V2:Сн2,
откуда 200·у = 300·0,3. (3)
Это соотношение легко вывести. Известно, что всегда количества моль-эквивалентов двух веществ, вступающих в реакцию, равны. Определим количество моль-эквивалентов кислоты, вступившей в реакцию.
1000 мл раствора содержат 0,3 моль-экв. кислоты
300 мл раствора содержат х моль-экв. кислоты
![]() кислоты.
кислоты.
Находим количество моль-эквивалентов щелочи.
1000 мл раствора содержат у моль-экв. щелочи
200 мл раствора содержат z моль-экв. щелочи
![]() щелочи.
щелочи.
Эти количества
моль-эквивалентов кислоты и щелочи
равны ![]() или
или
![]()
что аналогично соотношению (3).
Отсюда можно определить нормальную концентрацию раствора щелочи
![]()
Чтобы определить молярную концентрацию, следует ввести в условие задачи основность щелочи (z), т.е. количество гидроксильных групп, входящих в ее молекулу. Если их количество равно 1, то молярная концентрация будет соответствовать нормальной; если 2, молярность будет в 2 раза ниже нормальности раствора: СнА= z·СмА
Чтобы определить процентную концентрацию, следует ввести значение плотности раствора и указать, какая щелочь взята.
Предположим, взят раствор едкого калия и плотность раствора равна 1,1. Производим расчет.
Масса 1 л раствора равна 1100 г (1,1·1000), масса грамм - молекулы КОН 56 г. Составим пропорцию:
в 1100 г раствора содержится (56·0,45) г КОН;
в 100 г раствора содержится х1 г КОН;
![]() или
22,9 %.
или
22,9 %.
Пример 16. Определить нормальность раствора КОН, если на нейтрализацию 35 мл 0,3 н Н3РО4 израсходовано 20 мл раствора КОН.
Решение: "Золотое правило":
![]()
![]()
5 Диффузия и осмос
В разбавленных растворах неэлектролитов молекулы растворенного вещества практически не взаимодействуют друг с другом из-за большого расстояния между ними. Поведение этих молекул в растворе аналогично поведению молекул идеального газа. Если, например, налить в стакан концентрированный раствор сахара, а сверху слой чистой воды, то через некоторое время концентрация молекул сахара станет одинаковой во всем объеме раствора. Такое взаимное проникновение молекул называется диффузией.
Иная картина наблюдается, если вода и раствор сахара разделены пористой полупроницаемой перегородкой (мембраной - целлофан, животный пузырь и т.д.), через которую свободно проходят молекулы воды, но не могут проникать молекулы сахара. Если в сосуд из полупроницаемой мембраны, переходящей сверху в узкую трубку (рисунок 2), налить раствор сахара и погрузить в чистую воду, то выравнивание концентраций будет происходить только за счет молекул воды, которые в большем количестве диффундируют в раствор, чем обратно.
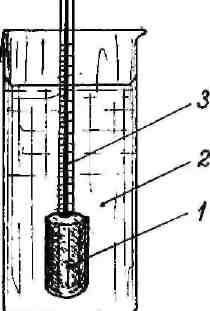 1-сосуд
с полупроницаемыми стенками;
1-сосуд
с полупроницаемыми стенками;
2-сосуд с водой;
3-трубка
Рисунок 2- Схема прибора для измерения осмотического давления раствора
(осмометр)
В результате уровень жидкости в трубке повышается, концентрация раствора уменьшается. Такая односторонняя диффузия через полупроницаемую мембрану называется осмосом. В сосуде с раствором создается давление, под действием которого жидкость поднимается в трубке до тех пор, пока не наступит равновесие (осмос прекращается). Давление столба жидкости в трубке, которое необходимо и достаточно для прекращения осмоса, называется осмотическим давлением. На основании измерения осмотического давления при различных концентрациях и температурах было установлено, что осмотическое давление раствора пропорционально концентрации растворенного вещества и абсолютной температуре раствора.
Сходство в поведении разбавленных растворов неэлектролитов с идеальными газами голландский химик Вант-Гофф выразил в виде закона:
осмотическое давление разбавленного раствора равно тому газовому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора. Для количественной оценки характеристики осмотического давления Вант-Гофф воспользовался уравнением газового состояния pV=nRT:
πосмV=nRT,
где π-осм осмотическое давление, кПа;
V – объем раствора, л;
n- число молей растворенного вещества;
R - универсальная газовая постоянная;
Т - абсолютная температура.
Несколько преобразуя уравнение, найдем
![]()
![]()
где См - концентрация раствора, моль/л .
Тогда πосм=СмRT, кПа.
Заменив молярную концентрацию выражением m/(MV),
где m - масса растворенного вещества в 1 л раствора, М - его молекулярная масса, а V - объем раствора, получим
![]()
![]()
Отсюда, зная осмотическое давление (измерив его), легко можно вычислить молекулярную массу растворенного вещества.
Пример 17. Вычислить осмотическое давление раствора, содержащего
63 г глюкозы С6H12O6 в 1,4 л раствора при 0 ºС.
Решение:
![]()
![]()
![]()
M (С6H12O6 )=180 г;
R=8,314 кДж/(моль К)*;
T=t+273=0+273=273К.
![]()
*) Величина газовой постоянной выбирается в зависимости от того, в каких единицах (Па, атм или мм рт. ст.) необходимо выразить осмотическое давление:
Росм. кПа; R= 8,314 Дж/(моль∙К);
Росм. мм Нg ст.; R= 62,36 (л∙ мм рт. ст.) /(град.∙моль);
Росм. атм. R = 0,082 (л∙атм)/(моль·град.).
Пример 18. Вычислить молекулярную массу неэлектролита, если в 5л раствора содержится 2,5 г растворенного вещества. Осмотическое давление раствора равно 0,23∙105 Па при 20 °С.
Решение: Заменив число молей n выражением m/М, где m-масса растворенного вещества, а М - его молярная масса, получим
![]()
Отсюда ![]()
