
- •Свойства
- •Введение
- •1 Общая характеристика растворов
- •2 Внутреннее строение растворов
- •3 Процесс растворения. Растворимость. Энергетика процесса растворения
- •4 Концентрации растворов
- •4.7 Расчеты, связанные с взаимным переходом одних форм выражения концентраций в другие
- •4.8 Расчеты, связанные со смешиванием растворов разных концентраций; из сухих солей и воды
- •Общие примеры решения задач при смешивании и разбавлении растворов
- •4.9 Расчеты по уравнениям реакций. Закон эквивалентов
- •5 Диффузия и осмос
- •6 Давление насыщенного пара растворов. Тонометрический закон рауля
- •7 Температура кипения
- •И кристаллизация растворов.
- •Эбулиоскопический и криоскопический
- •Законы рауля
- •8 Свойства растворов электролитов. Методы определения стеПени электролитической диссоциации
- •9 Рекомендации для самостоятельной работы, контрольные вопросы и требования к знаниям и умениям
- •9.1. Рекомендации
- •9.2. Вопросы для самоконтроля
- •9.3 Требования к знаниям и умениям
- •10 Задачи и упражнения
- •10.1 Растворимость. Энергетика процесса растворения
- •10.2 Процентная концентрация
- •10.3. Молярная и эквивалентная концентрация. (молярность, нормальность)
- •10.4. Моляльная концентрация (моляльность) , мольная доля, титр
- •10.5. Свойства растворов неэлектролитов, зависящие от концентрации частиц
- •10.5.1. Осмотическое давление разбавленных растворов неэлектролитов. Закон Вант-Гоффа
- •10.5.2. Давление насыщенного пара растворов. Тонометрический закон Рауля.
- •10.5.3. Температура кипения и кристаллизации растворов. Эбулиоскопический и криоскопический законы Рауля.
- •10.6 Свойства растворов электролитов. Методы определения степени электролитической диссоциации
- •11 Экспериментальная часть приготовление растворов заданной концентрации
- •Варианты расчетов
- •Библиографический список
- •Содержание
- •Свойства растворов электролитов и неэлектролитов
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
4 Концентрации растворов
Важнейшей характеристикой любого раствора является его состав, который выражается концентрацией. Концентрацией раствора называется количество растворенного вещества в определенном массовом или объемном количестве раствора или растворителя.
Для приблизительного выражения концентрации растворов используют термины концентрированный и разбавленный растворы.
Концентрированный раствор содержит такие количества растворенного вещества, которые сравнимы с количеством растворителя. Например, в 100г воды растворено 20г поваренной соли. Это концентрированный раствор (20 и 100 сравнимые величины).
Разбавленный раствор содержит очень малое количество растворенного вещества по сравнению с количеством растворителя. Например, в 100г воды растворено 0,2г поваренной соли. Это разбавленный раствор (0,2г соли очень мало по сравнению со 100г растворителя).
Границы между концентрированными и разбавленными растворами условны.
Существуют различные способы численного выражения концентрации растворов: массовая доля (%), объемная доля (%), молекулярные и атомные проценты, молярность, нормальность или молярная концентрация эквивалента, моляльность, мольная, атомная и массовые доли, титр и т.д.
4.1 Процентная концентрация (массовая доля ) раствора показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Процентная концентрация - это безразмерная величина и выражается соотношением
![]()
где С% - концентрация раствора, %;
m1 - масса растворенного вещества, г;
m - масса раствора, г.
Пример 1. Найти процентную концентрацию раствора хлорида калия, содержащего 53г КС1 в 500 мл раствора. Плотность раствора ρ=1,063 г/см3.
Решение: Масса раствора равна произведению объема раствора V на его плотность ρ :
m = ρV, тогда
С%=
![]() =
=
![]() .
.
Процентная концентрация раствора КС1 10 %.
4.2 Молярная концентрация раствора (молярность) показывает число молей растворенного вещества, содержащихся в 1 л раствора.
Молярная концентрация имеет размерность моль/л и выражается формулой
См=![]() ,
моль/л,
,
моль/л,
где m1 - масса растворенного вещества, г;
М - молярная масса растворенного вещества, г/моль;
V - объем раствора, л.
Пример 2. Найти массу NаОН, содержащегося в 0,2 л раствора, если молярная концентрация раствора равна 0,2 моль/л.
Решение: Молярная масса NаОН = 40г/моль.
mNaОН = СмМV = 0,2∙40∙0,2 =1,6 г.
4.3 Молярная концентрация эквивалента (нормальная концентрация) вещества (нормальность) показывает число моль-эквивалентов растворенного вещества, содержащихся в 1 л раствора (моль∙экв/л; н):
![]() моль∙экв/л,
моль∙экв/л,
где m1- масса растворенного вещества, г;
Мэ- молярная масса эквивалента растворенного вещества, г/моль;
V - объем раствора, л.
Закон эквивалентов:
Все вещества взаимодействуют между собой в соотношениях масс, пропорциональных их эквивалентам. Один эквивалент одного вещества всегда реагирует с одним эквивалентом другого вещества:
![]() или
или ![]()
![]() или
или
![]() ~
~
![]() ,
,
где mA и mB – массы взаимодействующих веществ А и В, г;
МЭА МЭВ – молярные массы эквивалентов этих веществ, г/моль;
![]() и
и ![]() -
эквивалентные количества Аи В.
-
эквивалентные количества Аи В.
Эквивалент вещества – это целая часть формульной единицы вещества, которая в данной реакции химически равноценна 1 атому водорода.
Молярная масса эквивалента вещества рассчитывается в общем случае по формуле
![]() [г/моль], где
[г/моль], где
М(ЭА)- молярная масса эквивалента вещества,
z- фактор эквивалентности, определяется типом вещества и реакции, в которой оно участвует.
Для кислот в реакции нейтрализации z равно числу протонов, замещающихся на катионы металла.
Для оснований в реакции нейтрализации z равно числу гидроксогрупп, замещающихся на кислотные остатки.
Для солей в реакциях обмена z равно произведению числа катионов на заряд катиона.
Для окислителей (восстановителей) z равно числу электронов, которые принимает (отдает) в данной реакции одна формульная единица окислителя (восстановителя).
Молярная масса эквивалента вещества зависит от типа реакции и для одного вещества может иметь разные значения. Следовательно, нормальная концентрация одного и того же раствора будет иметь разные значения для различных превращений этого вещества.
В общем случае молярная масса эквивалента вещества Мэ определяется реакцией, в которой он участвует. Например:
а) взаимодействие фосфорной кислоты со щелочью в реакции нейтрализации:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
![]() г/моль,
z=2,
т.к. молекула кислоты реагирует с двумя
молекулами NaOH,
что соответствует замещению двух ионов
водорода;
г/моль,
z=2,
т.к. молекула кислоты реагирует с двумя
молекулами NaOH,
что соответствует замещению двух ионов
водорода;
б) взаимодействие бихромата калия с иодидом калия в кислой среде:
K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O
![]() г/моль,
z=6,
т.к. бихромат калия принимает в данной
реакции шесть электронов:
г/моль,
z=6,
т.к. бихромат калия принимает в данной
реакции шесть электронов:
![]() г/моль.
г/моль.
Пример 3. Определить молярную концентрацию эквивалента хлорида железа (III), если в 0,3л раствора содержится 32,44г FеС13.
Решение: Молярная масса эквивалента FеС13 равна
МэFeС13=
![]()
Молярная концентрация эквивалента раствора FeCl3 равна
![]()
4.4 Моляльная концентрация раствора (моляльность) показывает число молей растворенного вещества, растворенного в 1000 г (1 кг) растворителя. Размерность моляльной концентрации моль/кг:
Сm
= 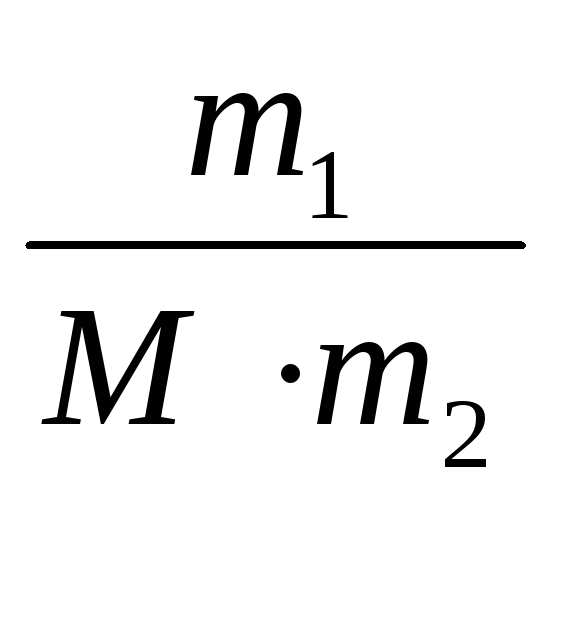 ,
моль/кг,
,
моль/кг,
где Сm - моляльная концентрация, моль/кг;
m1 - масса растворенного вещества, г;
m2 - масса растворителя, кг;
М - молярная масса растворенного вещества, г/моль .
Пример 4. В каком количестве эфира надо растворить 3,0 г анилина С6H5NH2, чтобы получить раствор, моляльность которого равна 0,3 моль/кг?
Решение: Моль С6H5NH2 = 93 г/моль.
Масса растворителя (эфира) равна
m2
= ![]()
4.5 Мольная доля растворенного вещества и растворителя в растворе
Мольная доля Ni вещества в растворе равна отношению числа молей данного вещества к сумме чисел молей всех компонентов, содержащихся в растворе. Например, если раствор состоит из двух компонентов (растворитель + одно растворенное вещество), мольные доли компонентов будут равны
N1=![]() и N2=
и N2=![]()
где N1 и N2- мольные доли растворителя и растворенного вещества соответственно;
n1 - число молей растворителя;
n2 - число молей растворенного вещества.
![]() где
m1-
масса растворенного вещества, г;
где
m1-
масса растворенного вещества, г;
М1- молярная масса растворенного вещества, г;
![]() где m2-
масса растворителя, г;
где m2-
масса растворителя, г;
М2- молярная масса растворителя, г;
Пример 5. Рассчитать мольные доли глюкозы С6H12O6 и воды в 36%-ном водном растворе глюкозы.
Решение: В 100 г 36%-ного раствора глюкозы содержится 36 г глюкозы и 64 г воды. Определяем число молей глюкозы и воды
(М (С6H12O6) =180; М Н2O=18):
n
(С6H12O6)
![]()
n
(Н2O)
![]()
N
(С6H12O6)
= ![]()
N
(С6H12O6
)
= ![]()
Сумма мольных долей компонентов раствора всегда равна 1.
N (С6H12O6 ) + N (H2O) = 0,053 + 0,947 = 1,0.
4.6 Титр раствора Титр раствора Т показывает количество граммов растворенного вещества, содержащегося в 1 мл раствора. Размерность титра - г/мл.
![]() г/мл,
г/мл,
где mA- масса растворенного вещества, г;
VА – объем раствора, мл.
Пример 6. Определить титр 0,01н КОН.
Решение: В 1л 0,01н раствора КОН содержится
(МЭ KOH=56)
![]()
Титр этого раствора равен
ТКОН
=![]()
