
- •Свойства
- •Введение
- •1 Общая характеристика растворов
- •2 Внутреннее строение растворов
- •3 Процесс растворения. Растворимость. Энергетика процесса растворения
- •4 Концентрации растворов
- •4.7 Расчеты, связанные с взаимным переходом одних форм выражения концентраций в другие
- •4.8 Расчеты, связанные со смешиванием растворов разных концентраций; из сухих солей и воды
- •Общие примеры решения задач при смешивании и разбавлении растворов
- •4.9 Расчеты по уравнениям реакций. Закон эквивалентов
- •5 Диффузия и осмос
- •6 Давление насыщенного пара растворов. Тонометрический закон рауля
- •7 Температура кипения
- •И кристаллизация растворов.
- •Эбулиоскопический и криоскопический
- •Законы рауля
- •8 Свойства растворов электролитов. Методы определения стеПени электролитической диссоциации
- •9 Рекомендации для самостоятельной работы, контрольные вопросы и требования к знаниям и умениям
- •9.1. Рекомендации
- •9.2. Вопросы для самоконтроля
- •9.3 Требования к знаниям и умениям
- •10 Задачи и упражнения
- •10.1 Растворимость. Энергетика процесса растворения
- •10.2 Процентная концентрация
- •10.3. Молярная и эквивалентная концентрация. (молярность, нормальность)
- •10.4. Моляльная концентрация (моляльность) , мольная доля, титр
- •10.5. Свойства растворов неэлектролитов, зависящие от концентрации частиц
- •10.5.1. Осмотическое давление разбавленных растворов неэлектролитов. Закон Вант-Гоффа
- •10.5.2. Давление насыщенного пара растворов. Тонометрический закон Рауля.
- •10.5.3. Температура кипения и кристаллизации растворов. Эбулиоскопический и криоскопический законы Рауля.
- •10.6 Свойства растворов электролитов. Методы определения степени электролитической диссоциации
- •11 Экспериментальная часть приготовление растворов заданной концентрации
- •Варианты расчетов
- •Библиографический список
- •Содержание
- •Свойства растворов электролитов и неэлектролитов
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
4.7 Расчеты, связанные с взаимным переходом одних форм выражения концентраций в другие
Пример 7. Вычислить молярность, молярную концентрацию эквивалента (нормальность) и моляльность 10%-ного раствора СuSO4, плотность которого =1,107 г/см3.
Решение: Определяем молярную массу и молярную массу эквивалента СuSO4. М=159,6 г/моль; МЭ CuSO4= 159,6/2 = 79,8г/моль.
В 100 г 10%-ного раствора СuSO4 содержится 10 г СuSO4 и 90г Н2O. Найдем массу СuSO4, содержащуюся в 1000 г Н2O:
![]()
Моляльность раствора равна
Сm
=![]()
Молярность и нормальность относятся к 1 л раствора, поэтому вначале определяем массу 1 л раствора:
![]()
В этой массе
раствора содержится ![]() СuSO4,
что составляет
СuSO4,
что составляет
110,7/159,6 = 0,693 моля
и 0,693 · 2 = 1,386 моль∙экв.
Молярность раствора См = 0,693 моль/л.
Нормальность Сн = 1,386 моль∙экв/л.
4.8 Расчеты, связанные со смешиванием растворов разных концентраций; из сухих солей и воды
Общие закономерности
- -
- -
- -
- -
- -
- -
- -
- - -
- - -
- - -
-
+ →
Раствор 1 Раствор 2 Раствор 3
m1р-ра + m2р-ра = m3р-ра
mраств. вещества 1 + mраств. вещества 2 = mраств. вещества 3
mраств. вещества + mрастворителя = mраствора
V1р-ра + V2р-ра = V 3р-ра
5) ν1 + ν2 = ν3
=> См1·V1 + См2·V2 = См3·V3,
где ν1 ; ν2 ; ν3 – количество молей в растворах 1; 2; 3;
См1; См2; См3 – молярные концентрации растворов 1; 2; 3;
V1; V2;V3 – объемы растворов 1; 2; 3 соответственно
6) ν(Э)1 + ν(Э)2 = ν(Э)3
=> Сн1·V1 + Сн2·V2 = Сн3·V3,
где ν(э)1 ; ν(Э)2 ; ν(Э)3 – количество молей эквивалентов в растворах 1; 2; 3;
Сн1; Сн2; Сн3 – молярные концентрации растворов 1; 2; 3 соответственно.
Общие примеры решения задач при смешивании и разбавлении растворов
1 Вывести формулу для расчета при решении задач типа: «Сколько граммов соли нужно добавить к Аг a%-ного раствора для получения в%-ного раствора?»
Решение::
В Аг
a%-ного
раствора содержится ![]() растворенного вещества. Пусть уг
– количество добавляемого вещества.
растворенного вещества. Пусть уг
– количество добавляемого вещества.
Масса полученного раствора будет (А+у) г.
В нем содержится
![]() вещества.
вещества.
Раствор должен получиться в%-ным:
(А+у) г раствора
содержат ![]() вещества.
вещества.
100 г раствора содержат в г вещества
Откуда ![]()
2 Вывести формулу для расчета при решении задач типа: «В каком соотношении масс необходимо смешать А% и В%-й растворы вещества для получения С%-ного раствора? » - математический вывод «правила креста».
Решение: Пусть растворы надо смешать в отношении масс х : у.
Масса полученного раствора будет (х+у) г.
В х граммах А%-ного
раствора будет содержаться ![]() и
и
В у граммах В%-ного
раствора будет содержаться ![]() растворенного вещества.
растворенного вещества.
Тогда (х+у) г
конечного раствора - ![]() вещества
вещества
100 г конечного
раствора с граммом вещества => ![]() если
В > А (т.е. концентрация второго исходного
раствора выше концентрации первого).
если
В > А (т.е. концентрация второго исходного
раствора выше концентрации первого).
При А > В ![]()
Если выразить полученное соотношение в виде диагональной схемы, для случая А > В =>

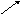 А (С - В)
А (С - В)
 С
С
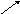 В (А - С)
В (А - С)
Пример 8. Сколько грамма 15 %-ного раствора Na2SO4 надо прибавить к 100 г 80%-ного раствора, чтобы получить 30%-ный раствор?
Решение:
I способ: Пусть mх- масса 15%-ного раствора.
mр-ра = mх +100
mNa2SO4= 0,15· mх + 0,8·100
Составим уравнение
в соответствии с определением концентрации
массовой доли (%): 30 %=![]() %
%
![]()
![]()
![]()
II способ: Вычисления также можно производить по «правилу креста», согласно которому количества смешиваемых растворов обратно пропорциональны разностям концентраций смешиваемых растворов и концентрации смеси:
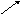
 15% (80-30)=50
15% (80-30)=50
 30%
30%
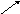
80% (30-15)=15
![]()
Пример 9. Сколько граммов медного купороса нужно добавить к 270 г воды, чтобы получить 10%-ный раствор сульфата меди?
Решение: Пусть mх- масса медного купороса; определим в ней количество сульфата меди.
М CuSO4×5Н2О=250 г/моль; М CuSO4=160 г/моль
Тогда в 250 г купороса – 160 г сульфата меди
В mх г купороса – а г сульфата меди
Масса полученного раствора будет (270+ mх) г.
В нем содержится
![]() сульфата меди.
сульфата меди.
Составляем пропорцию:
(270+ mх)
г раствора CuSO4
содержат ![]() CuSO4
CuSO4
100 г раствора CuSO4 содержат 10 г CuSO4
mх = 50 г CuSO4×5Н2О
Пример 10. Сколько кристаллической соды и 10%-ного раствора карбоната натрия следует взять для приготовления 400 г 20%-ного раствора карбоната натрия?
Решение: Пусть mх- масса кристаллической соды, г;
mу- масса 10 % раствора, г.
Тогда (mх+ mу) = 400 г- масса всего раствора.
М Na2CO3×10H2O=286 г/моль М Na2CO3=106 г/моль
В 286 г Na2CO3×10H2O содержится 106 г Na2CO3
в mх г Na2CO3×10H2O содержится а г Na2CO3
![]() Na2CO3
Na2CO3
Составляем пропорцию
в mу г раствора - в г Na2CO3
в 100 г раствора – 10 г Na2CO3
![]() г Na2CO3
г Na2CO3
Тогда в 400 г 20%-ного раствора масса Na2CO3
![]() или
или ![]()
Решаем систему двух уравнений
![]()

![]()
![]()
![]()
Пример 11. Сколько воды и кристаллической соды необходимо взять для приготовления такого количества насыщенного при 32 °С раствора, который при охлаждении до 0 °С выделит 14,3 г кристаллической соды? Растворимость безводной соды при 0 °С и 32 °С соответственно равна 6,75 и 30,8 г на 100 г раствора?
Решение: Пусть хг воды и уг кристаллической соды необходимо взять: (хг и уг). В этом растворе Na2CO3×10H2O будет:
![]() Na2CO3
и
Na2CO3
и ![]() H2O.
H2O.
Тогда общее количество H2O (х+0,63·у) г.
По условию из раствора должно выделиться 14,3 г кристаллической соды:
В 286 г Na2CO3×10H2O - 106 г Na2CO3 – 180 г Н2О
В 14,3 г Na2CO3×10H2O - 5,3 г Na2CO3 – 9 г Н2О
После охлаждения в растворе останется
(0,37·у - 5,3) г Na2CO3 и (х + 0,63·у - 9) г H2O.
Этот раствор будет насыщенным при 0°С и должен удовлетворять условию: (х + 0,63·у - 9) г H2O растворяют (0,37·у - 5,3) г Na2CO3;
(100 – 6,75) г H2O растворяют 6,75г Na2CO3.
6,75·х – 30,25·у = - 433,475. (1)
При 32 °С в растворе будет:
(х + 0,63·у) г Н2О – 0,37·у г Na2CO3
(100-30,8) г Н2О – 30,8 г Na2CO3
х = 0,2·у (2)
Решаем систему двух уравнений:

![]()
![]()
![]()
![]()
Пример 12. Какие количества воды и глауберовой соли (ГС) необходимо взять для приготовления 500 г раствора с 0,01 мольной долей сульфата натрия?
Решение: Пусть mх- масса воды, г;
mу- масса ГС, г.
Мr Na2SO4×10H2O = 332 г/моль; Мr Na2SO4= 142 г/моль.
В mу г ГС содержится 0,44· mу г или 0,0031·mу моль Na2SO4
Тогда для 0,01мольной доли раствора Na2SO4:
на 0,01 моль Na2SO4 приходится 0,99 моль Н2О
на (0,01·142) г Na2SO4 приходится (0,99·18) г Н2О
mр-ра = (0,01·142) + (0,99·18) = 19,24 г.
Составляем пропорцию:
в 19,24 г раствора содержится 0,01 моль Na2SO4
в 500 г раствора содержится а моль Na2SO4
а = 0,26 моль Na2SO4 – количество молей Na2SO4 в конечном растворе Na2SO4.
Тогда (mх +mу) г раствора – 0,0031· mу моль Na2SO4
500 г раствора – 0,26 моль Na2SO4
С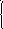 оставляем
систему уравнений:
оставляем
систему уравнений:
![]()
![]()
![]()
![]()
Пример 13. Сколько килограммов воды надо прибавить к 5 кг 20%-ного раствора, чтобы получить 12%-ный раствор?
Решение: Приняв концентрацию воды равной нулю и используя для решения "правило креста", получим
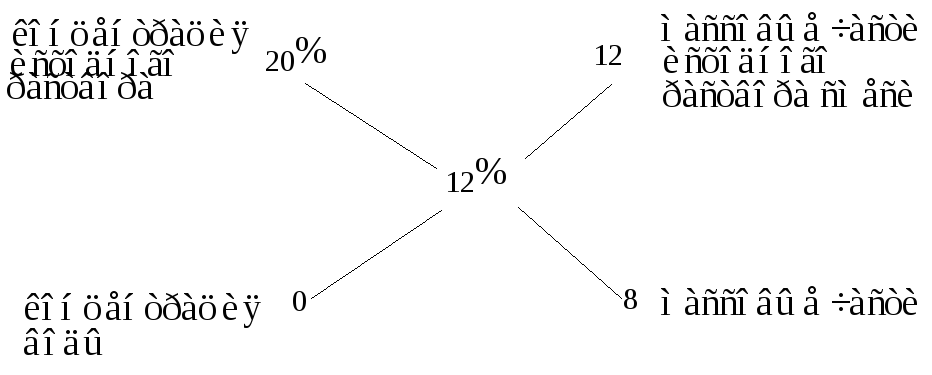
![]()
![]()
3 Вывести формулу для расчета при решении задач типа: «В каком объемном соотношении необходимо смешать А- и В- нормальные растворы некоторого вещества для получения С-нормального раствора?» Будет ли эта формула справедливой, если нормальную концентрацию в ней заменить молярной?
Решение: Пусть
растворы смешаны в соотношении ![]()
Если при смешивании не происходит изменения объема =>
Vобщий= (Vх+Vу) мл.
В Vх
мл А- нормального раствора – ![]() эквивалентов.
эквивалентов.
В Vу
мл В- нормального раствора – ![]() эквивалентов
растворенного вещества.
эквивалентов
растворенного вещества.
Всего в конечном
растворе ![]() эквивалентов растворенного вещества.
эквивалентов растворенного вещества.
Т.к. конечный раствор должен быть С-нормальным, то
(Vx+Vy)
мл конечного раствора содержат ![]() экв.;
экв.;
1000 мл конечного раствора содержат С экв.
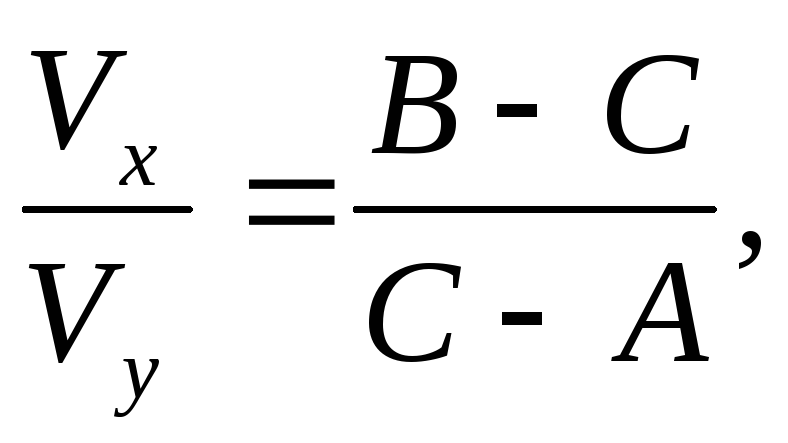 если
В >
А
или
если
В >
А
или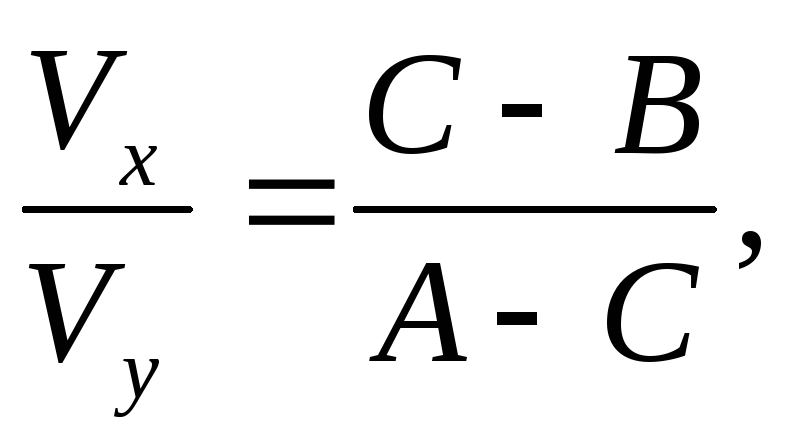 если
А > В.
если
А > В.
Формула будет справедливой, если нормальные концентрации заменить молярными.
Пример 14. Какой объем 0,6 н раствора нужно прибавить к 750 мл 0,2н раствора, чтобы получить 0,3н раствор?
Решение: 1. По правилу смешения:
![]()
![]()
![]()
