
- •Свойства
- •Введение
- •1 Общая характеристика растворов
- •2 Внутреннее строение растворов
- •3 Процесс растворения. Растворимость. Энергетика процесса растворения
- •4 Концентрации растворов
- •4.7 Расчеты, связанные с взаимным переходом одних форм выражения концентраций в другие
- •4.8 Расчеты, связанные со смешиванием растворов разных концентраций; из сухих солей и воды
- •Общие примеры решения задач при смешивании и разбавлении растворов
- •4.9 Расчеты по уравнениям реакций. Закон эквивалентов
- •5 Диффузия и осмос
- •6 Давление насыщенного пара растворов. Тонометрический закон рауля
- •7 Температура кипения
- •И кристаллизация растворов.
- •Эбулиоскопический и криоскопический
- •Законы рауля
- •8 Свойства растворов электролитов. Методы определения стеПени электролитической диссоциации
- •9 Рекомендации для самостоятельной работы, контрольные вопросы и требования к знаниям и умениям
- •9.1. Рекомендации
- •9.2. Вопросы для самоконтроля
- •9.3 Требования к знаниям и умениям
- •10 Задачи и упражнения
- •10.1 Растворимость. Энергетика процесса растворения
- •10.2 Процентная концентрация
- •10.3. Молярная и эквивалентная концентрация. (молярность, нормальность)
- •10.4. Моляльная концентрация (моляльность) , мольная доля, титр
- •10.5. Свойства растворов неэлектролитов, зависящие от концентрации частиц
- •10.5.1. Осмотическое давление разбавленных растворов неэлектролитов. Закон Вант-Гоффа
- •10.5.2. Давление насыщенного пара растворов. Тонометрический закон Рауля.
- •10.5.3. Температура кипения и кристаллизации растворов. Эбулиоскопический и криоскопический законы Рауля.
- •10.6 Свойства растворов электролитов. Методы определения степени электролитической диссоциации
- •11 Экспериментальная часть приготовление растворов заданной концентрации
- •Варианты расчетов
- •Библиографический список
- •Содержание
- •Свойства растворов электролитов и неэлектролитов
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
3 Процесс растворения. Растворимость. Энергетика процесса растворения
Растворение - одно из наиболее убедительных проявлений взаимодействия между частицами компонентов раствора.
Процесс растворения твердых веществ в жидкостях можно представить так: под влиянием растворителя от поверхности твердого вещества постепенно отрываются отдельные ионы или молекулы и равномерно распределяются по всему объему (рисунок 1) . По количеству растворенного вещества, содержащегося в растворе, растворы делятся на насыщенные, ненасыщенные и пересыщенные.
Насыщенным называется такой раствор, который находится в динамическом равновесии с избытком растворяемого вещества: сколько частиц вещества будет переходить в раствор в единицу времени, столько же частиц будет выделяться (переходить в осадок) из раствора.
растворение, V1
О садок Раствор V1=V2
садок Раствор V1=V2

Здесь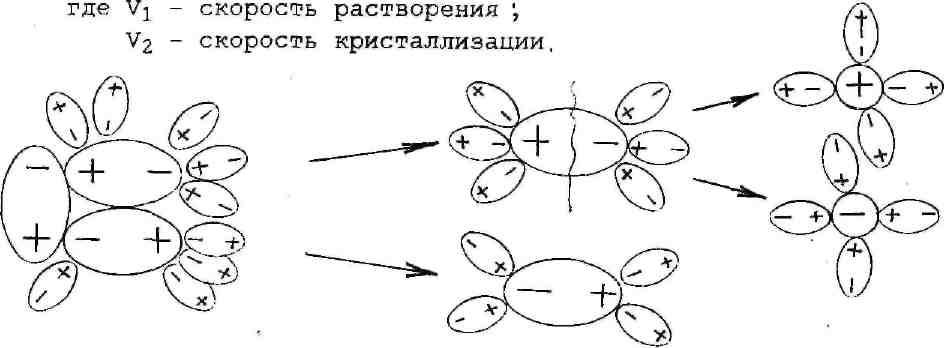
Рисунок 1 - Схема процесса растворения
В ненасыщенном растворе содержится меньше вещества (V1>V2), а в пересыщенном - больше, чем в насыщенном. Пересыщенные растворы весьма неустойчивы. Простое сотрясение сосуда или введение в раствор кристаллика соли вызывает выпадение в осадок избытка растворенного вещества.
Растворение веществ сопровождается тепловым (энергетическим) эффектом. При образовании растворов разрушаются связи между молекулами (атомами, ионами) в растворяемом веществе и растворителе, что связано с затратой энергии. Одновременно протекает процесс гидратации (сольватации), который сопровождается выделением энергии. Общий энергетический эффект растворения в зависимости от соотношения количеств выделяемой и поглощаемой энергии может быть как положительным, так и отрицательным. При растворении газов и жидкостей теплота обычно выделяется. В частности, с выделением теплоты протекает смешение воды и спирта. При растворении в воде твердых веществ теплота может и выделяться и поглощаться. Поэтому нагревание по-разному сказывается на их растворимости. Если растворение вещества сопровождается выделением теплоты, то при нагревании его растворимость падает, и наоборот, если вещества растворяются с поглощением теплоты, то нагревание вызывает увеличение растворимости.
Величина теплового эффекта, отнесенная к определенному количеству растворенного вещества, называется теплотой растворения. Если эта величина относится к одному молю растворенного вещества, то ее называют молекулярной (мольной) теплотой растворения.
Кроме энергетического эффекта растворение сопровождается также изменением объема. Например, при растворении спирта в воде объем раствора уменьшается примерно на 3,5 % по сравнению с общим объемом взятых веществ за счет образования сольватов.
Свойство вещества растворяться в воде или другом растворителе называется растворимостью. Растворимость выражают количеством граммов вещества, которое может раствориться в 100 г растворителя при определенной температуре, образуя насыщенный раствор.
Растворимость различных веществ зависит от природы растворенного вещества и растворителя и от термодинамических условий - температуры и давления. Количественно растворимость выражается концентрацией насыщенного раствора.
Растворимость твердого вещества в жидкости с повышением температуры чаще всего увеличивается, а давление практически не оказывает влияния на растворимость.
Растворимость газа в жидкости увеличивается с повышением давления и уменьшается с повышением температуры. Зависимость растворимости газа от давления выражается законом Генри: растворимость газа прямо пропорциональна давлению.
![]()
где СГ – растворимость газа в жидкой фазе;
РГ – давление газа над раствором (парциальное);
k–коэффициент пропорциональности, называемый постоянной Генри.
Растворимость жидкости в жидкости обычно увеличивается с повышением температуры и практически не зависит от давления. Лишь при давлениях порядка тысяч атмосфер растворимость начинает заметно возрастать.
Для удобства и большей наглядности изображения зависимости растворимости от условий равновесия широко пользуются графическими методами (кривые растворимости) и таблицами. На графиках и в таблицах растворимость выражают числом граммов растворенного вещества в 100 (или 1000)г растворителя.
Например, растворимость в воде некоторых неорганических соединений при различных температурах приведена в приложении Б в таблице Б.1.
