
- •Свойства высокомолекулярных соединений
- •Особенности физикохимии полимеров
- •Пространственная структура макромолекул.
- •Факторы, определяющие конформации полимерных цепей.
- •Формы полимерных макромолекул.
- •Полимеры в конденсированных фазах
- •Аморфные полимеры
- •Физические состояния аморфных полимеров.
- •Релаксационный характер физических состояний аморфных полимеров
- •Зависимость температур стеклования и текучести от различных факторов
- •2. Зависимость от характера полимера.
- •Стеклообразное состояние полимеров
Формы полимерных макромолекул.
А. В кристаллической фазе. В кристаллической фазе вращение вокруг связей невозможно; в большинстве случаев (за исключением глобулярных белков) в узлах решетки находятся малые части макромолекул (например, звенья). Естественно, в кристаллической фазе этих полимеров макромолекулы находятся в конформациях с высокой степенью регулярности, хотя и не полностью регулярных, т.к. кристаллическая структура полимеров достаточно дефектна. Для линейных полимеров с малыми боковыми группами (полиэтилен, поливиниловый спирт) характерна форма плоского транс-зигзага:
Если же размеры боковых групп увеличиваются (начиная уже с полипропилена), то плоский зигзаг становится энергетически невыгодным из-за взаимного отталкивания этих заместителей, и преимущество получает спираль, – пожалуй, наиболее распространенный тип регулярной структуры для полимеров вообще и биополимеров в частности.
В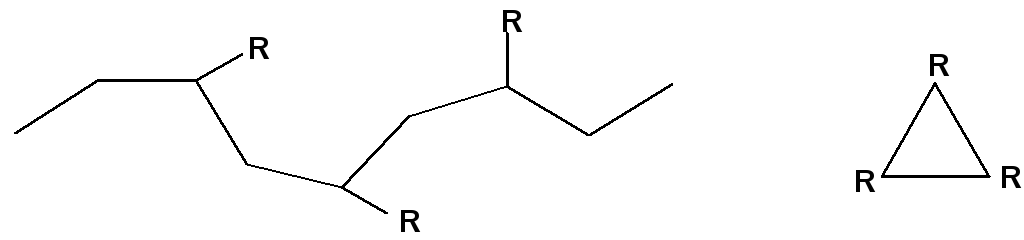 такой форме боковые группы “разведены”
в пространстве, что хорошо видно, если
спроектировать спираль на плоскость,
перпендикулярную оси спирали (треугольник
справа – для случая спирали, содержащих
тризвена
СН2-СН(R)
на один виток). Спиральные конформации
полимеров весьма многообразны: спирали
могут отличаться числом атомов (звеньев)
в одном витке, величиной шага спирали;
спирали могут быть правыми и левыми.
такой форме боковые группы “разведены”
в пространстве, что хорошо видно, если
спроектировать спираль на плоскость,
перпендикулярную оси спирали (треугольник
справа – для случая спирали, содержащих
тризвена
СН2-СН(R)
на один виток). Спиральные конформации
полимеров весьма многообразны: спирали
могут отличаться числом атомов (звеньев)
в одном витке, величиной шага спирали;
спирали могут быть правыми и левыми.
Иная картина наблюдается для особого типа кристаллов – глобулярных кристаллов белков: в узлах кристаллической решетки здесь находятся целые макромолекулы; они содержат как регулярно, так и нерегулярно построенные участки полипептидных цепей.
Б. В аморфных полимерах и в растворах. В этих случаях требование обязательной регулярности структуры снимается; форма макромолекул определяется совокупностью всех факторов, о которых говорилось выше.
Гибкость полимерной цепи приводит к тому, что макромолекулы приобретают в той или иной степени свернутую (скрученную форму). Степень сворачивания может быть различной. Для характеристики свернутости макромолекулы можно использовать расстояние между концами цепи (h). Естественно, величина h имеет максимальное значение для полностью вытянутой конформации. Длина такой конформации называется контурной или гидродинамической длиной макромолекулярной цепи L; в данном случае h=L; для свернутой макромолекулы h<L. Поскольку в процессе теплового движения конформации цепи, а значит, и величина h все время меняются, степень сворачивания цепи характеризуется усредненной величиной - среднеквадратичным расстоянием между концами цепи (h2)1/2.
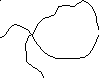
Если макромолекулы полимера обладают высокой гибкостью, то для них четко выражена тенденция к сворачиванию в статистический клубок. Для гибкоцепных полимеров, как уже упоминалось, силы взаимодействия относительно невелики; энтальпии различных конформаций мало различаются. Поэтому форма макромолекул во многом определяется энтропийным фактором. Нетрудно заметить, что полностью вытянутая цепь (hmax, h=L) имеет минимальную вероятность появления, поскольку ей соответствует всего одна конформация (рис.7, А); любому h1<L соответствует большее число конформаций (рис.15, В)
m ax h h 1



















































































А В
Рис. 15. Полностью вытянутая (А) и свернутая (В) формы макромолекулы.
Идеализированной моделью гибкой макромолекулы является свободно сочлененная макромолекулярная цепь. В этой модели фиксированы только длины связей, но не фиксированы валентные углы – они могут быть любыми; вращение вокруг связей свободное (энергетические барьеры вращения отсутствуют). Цепь может свободно пересекать саму себя. Естественно, форма свободно сочлененной цепи определяется только энтропией.
Для свободно сочлененной цепи вероятность (W) разных значений h выражается распределением Гаусса (рис.16):


Рис.16. Кривая распределения расстояний между концами макромолекул
для свободно сочлененной цепи
Среднеквадратичное расстояние между концами цепи определяется как
(h2)1/2 = l√n
где l – длина связи, n – число связей в цепи.
При переходе от свободно сочлененной цепи к реальным гибким макромолекулам необходимо учитывать, что валентные углы фиксированы, а цепь не может пересекать саму себя. Тем не менее, поскольку вращение вокруг связей происходит легко, здесь доминирует энтропийный фактор, и здесь можно с известной степенью приближения оперировать закономерностями, характерными для свободно сочлененной цепи (в качестве не очень точной, но все же аналогии можно привести соотношение между идеальным и реальным газом). В общем, для гибкоцепных полимеров характерны скрученные конформации макромолекул с довольно малой степенью организации.
 В случае
жесткоцепных
полимеров ситуация иная. Значительные
силы взаимодействия приводят к
неравноценности разных конформаций по
энтальпии;
поэтому конформации макромолекул
определяются сложным сочетанием
энтальпийных и энтропийных факторов;
в некоторых случаях всё определяется
только энтальпией. В таких полимерах
набор конформаций заметно
ограничен
по сравнению с гибкоцепными полимерами:
преобладают конформации с меньшей
энергией. Например, для ароматического
полиамида предпочтительны конформации
типа “коленчатый вал” (рис. 17).
В случае
жесткоцепных
полимеров ситуация иная. Значительные
силы взаимодействия приводят к
неравноценности разных конформаций по
энтальпии;
поэтому конформации макромолекул
определяются сложным сочетанием
энтальпийных и энтропийных факторов;
в некоторых случаях всё определяется
только энтальпией. В таких полимерах
набор конформаций заметно
ограничен
по сравнению с гибкоцепными полимерами:
преобладают конформации с меньшей
энергией. Например, для ароматического
полиамида предпочтительны конформации
типа “коленчатый вал” (рис. 17).
Рис.17. Предпочтительная конформация цепи ароматического полиамида
В наибольшей степени это сужение конформационного набора проявляется для наиболее важных биополимеров – полисахаридов, белков и нуклеиновых кислот. Здесь в целом ряде случаев в физиологических условиях реализуется единственная конформация, называемая нативной; эта конформация обладает наименьшей энергией по сравнению с остальными. Наиболее характерный пример – ферменты.
В случае персистентного механизма гибкости макромолекула приобретает характерную червеобразную форму (рис 18, А). Для характеристики таких структур используют персистентную длину макромолекулы а (рис. 18, В) – проекцию вектора расстояния между концами цепи (1) на направление касательной к началу цепи (2).



2 1
а

А В
Рис.18. Персистентная модель полимерной цепи (А) и персистентная длина цепи (В).
Разумеется, необходимо помнить, что при повышении температуры жесткость макромолекул уменьшается, поэтому набор возможных конформаций возрастает (а для персистентно-гибких макромолекул увеличивается степень искажения валентных углов). Поэтому, например, нативные конформации белков нарушаются, их макромолекулы становятся ближе к структуре статистиче- ского клубка (термическая денатурация).
Все высказанные здесь соображения о пространственных формах макромолекул ВМС наиболее четко проявляются для разбавленных растворов полимеров, где макромолекулы можно условно считать изолированными друг от друга. Здесь появляется еще ряд моментов (формы клубка и глобулы и их взаимные переходы), о которых пока не упоминалось и которые будут обсуждены при рассмотрении растворов ВМС.
В конденсированной фазе заметное (а иногда и весьма существенное) влияние на пространственную организацию макромолекул оказывает образование надмолекулярных структур, о которых речь пойдет ниже.
Резюме
Пространственная организация макромолекул полимеров имеет исключительное значение. Она определяет важнейшие свойства полимеров, основные направления их практического использования, а также биологические функции биополимеров. Решающую роль в пространственной организации макромолекул играют их конформации, теоретическое число которых неограниченно велико. Важнейшее значение имеют сравнительная устойчивость конформаций и способность к их изменению в конкретных условиях. И то и другое в очень большой степени определяется силами внутри- и межмолекулярного взаимодействия.
Если эти силы невелики, то: А. Конформации макромолекул мало различаются по энтальпии, и их распределение определяется, в основном, энтропийным фактором. Б. Конформации макромолекул относительно легко изменяются под воздействием теплового движения или внешнего поля; поэтому такие макромолекулы называются гибкими.
Если эти силы велики, то: А. Конформации заметно различаются по энергии; более устойчивы те, где силы взаимодействия наибольшие; распределение конформаций определяется, в основном, энтальпийным фактором. Б. Способность к изменению конформаций ограничена по сравнению с предыдущим вариантом; такие макромолекулы называются жесткими.
Кроме сил взаимодействия, конформационная подвижность макромолекул ограничивается (т.е. увеличивается их жесткость) наличием сопряжения и циклических структур в полимерной цепи. Мерой гибкости (жесткости) макромолекул является величина сегмента – кинетически независимой части макромолекулы: его величина растет с увеличением жесткости.
В аморфной фазе и в растворе гибкие макромолекулы в отсутствии напряжения предпочтительно принимают скрученные конформации; жесткие макромолекулы во многих случаях предпочтительно принимают более или менее вытянутые конформации, но в ряде случаев и здесь более выгодны скрученные или спиралевидные конформации. В отдельных случаях макромолекулы в растворах принимают единственную конформацию; наиболее характерный пример – нативные конформации глобулярных белков – ферментов.
НАДМОЛЕКУЛЯРНЫЕ СТРУКТУРЫ ПОЛИМЕРОВ.
Во всех реальных химических системах молекулы (или атомы в случае элементов) вступают в некие отношения между собой, в результате чего образуются те или иные агрегаты молекул (атомов). Эти образования могут быть еле намеченными или упорядоченными, весьма кратковременными или долгоживущими; это зависит от состояния вещества (кристаллическое или аморфное), от внешних условий (например, от температуры) и, наконец, от строения вещества. Но в любом случае возникновение таких агрегатов означает создание определенной упорядоченности в молекулярной структуре вещества.
В полимерах, состоящих из макромолекул, несоизмеримо больших, чем молекулы низкомолекулярных соединений, виды и формы межмолекулярной агрегации намного более разнообразны; это относится и к аморфной и к кристаллической фазам. При этом агрегация может затрагивать не только разные макромолекулы, но и участки одной и той же макромолекулы. Физическая структура полимеров, обусловленная различными видами упорядоченности во взаимном расположении макромолекул, называется надмолекулярной структурой полимера. Надмолекулярные структуры полимеров оказывают огромное влияние на их физические и химические свойства; надмолекулярные структуры важнейших биополимеров выполняют сложнейшие биологические функции и по существу являются промежуточным звеном между макромолекулами и клетками.
В данном разделе в основном будут рассмотрены надмолекулярные структуры аморфных полимеров; основные закономерности надмолекулярных структур кристаллических полимеров будут рассмотрены позднее, в специальном разделе, посвященном таким полимерам.
Среди надмолекулярных структур аморфных полимеров можно выделить две группы: 1.Надмолекулярные структуры неспецифического характера. 2. Межмолекулярные комплексы. Между этими группами существует принципиальное различие. В первом случае надмолекулярные агрегаты включают разное число макромолекул; во взаимном расположении макромолекул не наблюдается полной упорядоченности, хотя степень упорядоченности может значительно различаться. Такие структуры характерны для аморфных синтетических полимеров, а из биополимеров – для некоторых полисахаридов и полипептидов. Напротив, межмолекулярные комплексы имеют постоянный состав; во взаимном расположении макромолекул наблюдается полная упорядоченность или, по крайней мере, весьма высокая степень упорядоченности; многие такие комплексы способны к самосборке. Образование межмолекулярных комплексов характерно для белков и нуклеиновых кислот; именно они во многом создают основу для формирования клеточной структуры.
Между указанными двумя группами не существует четкой границы. Скорее можно говорить о некоей непрерывной «шкале специфичности» – от практически полного ее отсутствия до полной специфичности, так что данные группы находятся на «флангах» этой последовательности. Целый ряд очень важных комплексов, особенно с участием биополимеров (например, мышечные волокна, сухожилия, биомембраны) можно лишь условно отнести к той или иной из этих двух групп. Тем не менее, далее будет использоваться именно эта классификация.
Рассмотрим вначале надмолекулярные структуры, имеющие неспецифический характер. Возникновение и распад этих агрегатов протекают по закону случая; любая макромолекула или ее участок в принципе имеют равные шансы войти или не войти в состав надмолекулярной структуры. По сравнению с низкомолекулярными соединениями, эти образования в полимерах более упорядочены и имеют бòльшую продолжительность жизни. Такие структуры характерны для линейных полидисперсных полимеров, состоящих как из жестких, так и из гибких макромолекул. Они являются типичными структурами ближнего порядка – образованиями, имеющими ограниченную упорядоченность в ограниченном пространстве, сравнимом с размерами самих макромолекул (в отличие от характерного для кристаллических веществ дальнего порядка, где имеется четкая упорядоченность на расстояниях, во много раз превышающих размеры молекул).
В случае гибких макромолекул, где силы взаимодействия относительно невелики (по сравнению с жесткоцепными полимерами), надмолекулярные структуры менее организованы, но и здесь развиты в достаточной степени. Ранее считали, что гибкие макромолекулы, свернутые в статистические клубки (см. выше), беспорядочно перепутаны, образуя «молекулярный войлок». Однако ряд очень важных фактов не соответствует такой структуре.
Во-первых, плотность аморфных полимеров заметно выше, чем рассчитанная для «молекулярного войлока» – она лишь ненамного ниже плотности кристаллических полимеров, в которых степень упорядоченности весьма высока. Следовательно, плотность упаковки в аморфных полимерах выше, чем для набора беспорядочно перепутанных статистических клубков.
Во-вторых, скорость кристаллизации аморфных полимеров, (в том числе и гибкоцепных) достаточно высока; она, конечно, ниже, чем скорость кристаллизации низкомолекулярных веществ, но намного выше, чем для системы, состоящей из беспорядочно перепутанных макромолекул; реорганизация такой структуры в полностью упорядоченную потребовало бы намного большего времени.
В третьих, с развитием современных физических методов исследования (прежде всего рентгеноструктурного анализа и электронной микроскопии) были получены прямые доказательства существования в аморфных полимерах частично упорядоченных областей.
Все это убедительно доказывает существование надмолекулярных структур в аморфных полимерах. Однако получить абсолютно точную картину таких структур весьма затруднительно. В настоящее время существует несколько моделей структуры аморфных полимеров с гибкими цепями. Из них наиболее известна доменная модель. Согласно этой модели основными элементами надмолекулярных структур являются домены, образованные участками цепей, ориентированными более или менее параллельно (рис.19). Эти ориентированные участки могут принадлежать как одной (сложенной) цепи, так и разным цепям; размеры доменов – порядка 3-10 нм. Между доменами находятся мало организованные или совсем неорганизованные участки (междоменные области). Одна макромолекула может входить в два или более домена; участки таких макромолекул, которые находятся между доменами, называются проходными цепями.









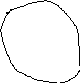
Рис. 19. Доменная модель аморфного полимера. Пунктирными кругами обведены домены, пунктирными стрелками показаны проходные цепи.
Предполагается, что домены могут агрегироваться друг с другом с образованием «наддоменных» структур. Особенно склонны к образованию таких структур некоторые блок-сополимеры, например блок-сополимер бутадиена со стиролом: величины гомополимерных блоков здесь примерно одинаковы, поэтому расстояния между доменами, которые образованы, допустим, полибутадиеновыми блоками, также примерно одинаковы, и эти блоки образуют нечто вроде кристаллической решетки (квазикристаллическую решетку) в «узлах» которой находятся домены. Стоит еще раз подчеркнуть, что такие относительно высокоорганизованные структуры образуют полимеры с гибкими макромолекулами (как упомянутый выше блок-сополимер).
В случае жесткоцепных полимеров надмолекулярные структуры развиты в еще большей степени; при этом часто они образованы макромолекулами, находящимися в вытянутых или спиральных конформациях. Например, в надмолекулярных структурах целлюлозы и амилозы параллельно уложены уже не фрагменты цепей, а целые цепи; эти структуры представляют собой пучки параллельно ориентированных цепей, при этом в целлюлозе цепи имеют почти вытянутую конформацию, а в амилозе – спиральную. Аналогичную структуру имеют некоторые белки, например, фиброин шелка. Надмолекулярные структуры такого типа называют фибриллами, а полимеры, включающие такие структуры – фибриллярными. Поскольку макромолекулы здесь ориентированы, такое состояние полимеров называют ориентированным.
Фибриллярную структуру (ориентированное состояние) для многих полимеров, в том числе с не очень жесткими макромолекулами, можно получить искусственно, путем растяжения (вытяжки) полимеров с неориентированными макромолекулами. В ориентированном состоянии полимер проявляет анизотропию свойств, т.е. их различие в разных направлениях. В частности, прочность такого полимера вдоль оси ориентации намного выше, чем в перпендикулярном направлении, причем прочность вдоль оси ориентации намного выше, чем прочность неориентированного полимера. Эти особенности свойств находят широкое практическое применение: ориентированные полимеры являются основой плёнок (двумерная, двухосная ориентация) и волокон (линейная, одноосная ориентация). Если гибкость макромолекул полимера относительно велика, ориентированное состояние термодинамически невыгодно, наблюдается тенденция к разориентации, тем большее, чем выше температура. Напротив, в таких жесткоцепных полимерах, как целлюлоза, фиброин, ориентированное состояние при обычных температурах выгодно, так как стабилизировано сильными межмолекулярными взаимодействиями, в первую очередь водородными связями (для фиброина фибриллярная структура возможна потому, что в его макромолекулах мало звеньев с объёмными боковыми группами).
Межмолекулярные комплексы. Под комплексом принято понимать нековалентные ассоциаты нейтральных или ионных частиц, имеющие постоянный состав; обычно они имеют точно определенную пространственную структуру. Отдельные части комплекса могут быть связаны между собой различными видами нековалентных взаимодействий, в том числе и ионными связями.
Высокомолекулярные соединения могут образовывать комплексы, состоящие только из макромолекул (комплексы полимер-полимер) или комплексы макромолекул с молекулами низкомолекулярных соединений. Образование комплексов характерно для биополимеров; такие комплексы выполняют весьма важные биологические функции.
В основе образования большинства комплексов биополимеров лежат различные варианты молекулярного узнавания (молекулярного распознавания). Под молекулярным узнаванием понимают селективное связывание между молекулами, определяемое считыванием молекулярной информации. Молекулярная информация – специфическое расположение фрагментов молекулы, прежде всего функциональных групп; как правило, эта специфичность включает совершенно определенное расположение этих фрагментов в пространстве. Считывание информации происходит путем осуществления нековалентных взаимодействий между специфическими участками ассоциирующихся молекул. Необходимым условием считывания молекулярной информации является комплементарность ассоциирующихся частиц, т.е. структурное соответствие их специфических участков (принцип ключа – замка).
Широко известным примером является образование двойной спирали ДНК
посредством комплементарного связывания гетероциклических оснований А-Т и G-С; здесь узнавание осуществляется путем образования водородных связей между соответствующими пиримидиновым и пуриновым основаниями. Для многих других биополимерных комплексов узнавание определяется совокупностью различных сил взаимодействия, расчет этих сил и предсказание места узнавания является весьма сложной, иной раз пока непосильной задачей; по мнению ряда авторов, во многих случаях основную роль, как и для случая ДНК, играет образование водородных связей; существует гипотеза о трех водородных связях как необходимом (но не достаточном) условии узнавания.
Вначале будут рассмотрены чисто полимерные комплексы. Здесь возможны два варианта: А. Комплексы построены из однотипных молекул; Б. Комплексы включают молекулы разных типов полимеров.
А. К первому варианту относятся четвертичные структуры белков. Как известно, многие клеточные белки представляют собой комплексы, состоящие из двух и более полипептидных цепей, связанных нековалентными взаимодействиями. Отдельные цепи в таких комплексах называют субъединицами или мономерами (здесь понятие «мономер» несколько отличается от такового для исходных веществ при синтезе ковалентно построенных полимеров); комплексы, состоящие из двух субъединиц, называют димерами, из трех - тримерами и т.д.; в общем случае используется название «мультимер». Субъединицы могут быть тождественными (как алкогольдегидрогеназа печени, состоящая из двух идентичных цепей или белковые оболочки некоторых вирусов, состоящие из множества идентичных цепей) или включать цепи с различной первичной структурой (например, гемоглобин, состоящий из двух -цепей и двух -цепей, или белковые оболочки других вирусов). При этом в любом индивидуальном мультимерном белке одинаково не только общее число субъединиц, но и число субъединиц с данной первичной структурой. Взаимное расположение субъединиц в пространстве строго задано и, как правило, подчиняется определенным правилам симметрии. Пространственное расположение субъединиц собственно и называют четвертичной структурой.
Полипептидные цепи – субъединицы мультимерных белков – имеют глобулярную третичную структуру; поверхности глобул в местах контактов хорошо «подогнаны» друг к другу; благодаря этому, контакты между глобулами весьма тесные. Поэтому силы взаимодействия между глобулами обеспечивают выигрыш в энтальпии, который превосходит проигрыш в энтропии (этот проигрыш очевиден, поскольку при образовании мультимера субъединицы теряют часть степеней свободы); в результате образование четвертичной структуры энергетически выгодно. Наиболее важные силы взаимодействия между глобулами – гидрофобные взаимодействия и силы Ван-дер-Ваальса; последние, как уже упоминалось, невелики, однако число этих взаимодействий очень велико из-за большой площади тесного контакта между субъединицами, так что эти силы вносят заметный вклад в стабилизацию комплекса. В ряде случаев большую роль играют водородные связи, а также ионные связи.
Четвертичная структура может возникать путем самосборки при смешении субъединиц.
Другим примером белок-белковых комплексов служат комплексы антител с антигенами; образование таких комплексов лежит в основе гуморального иммунного ответа. Каждый чужеродный белок (антиген) исключительно специфично связывается с комплементарным ему рецептором – антителом. Специфичность связывания здесь может превышать даже специфичность связывания ферментов со своими субстратами. Узнавание специфических участков антигена (антигенных детерминантов) осуществляется антигенсвязывающим участком (центром) антитела (рис. 20). Структуры этих центров изучены достаточно хорошо; считается, что антигенсвязывающий центр образован совокупностью нескольких небольших фрагментов (по 5-10 звеньев), входящих в состав разных полипептидных цепей антитела. Считается, что узнавание происходит за счет образования водородных связей, за счет сил Ван-дер-Ваальса, а также за счет электростатических взаимодействий.
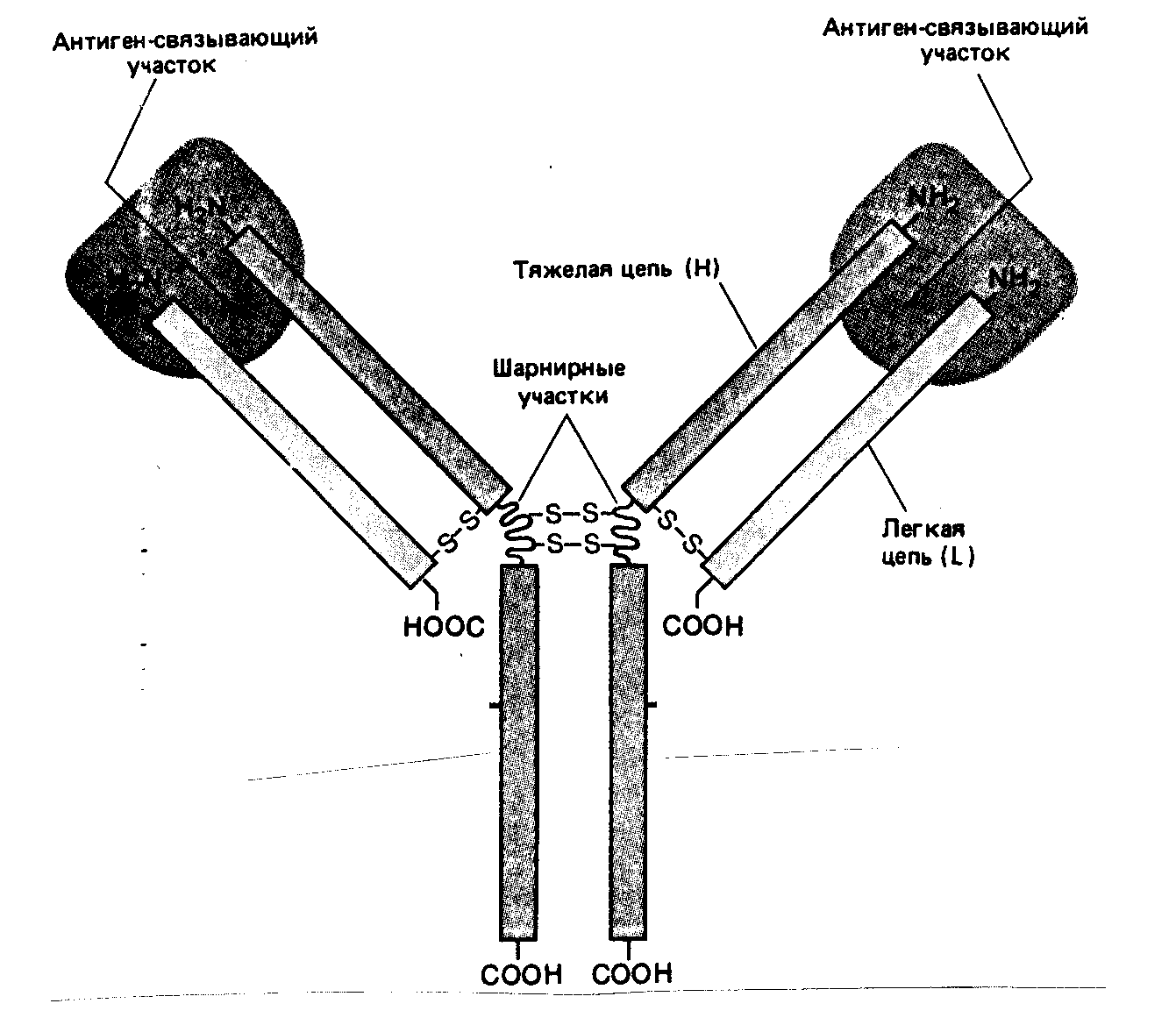
Рис. 20. Строение антитела.
Б. Среди комплексов, образованных макромолекулами разных биополимеров, пожалуй, наибольшее значение имеют белково-нуклеиновые комплексы, играющие исключительно важную биологическую роль. В образовании этих комплексов принимают участие макромолекулы, значительно отличающиеся друг от друга по химическому строению и в еще большей степени – по величине (поскольку большинство нуклеиновых кислот значительно превосходят белки по молекулярной массе). Белково-нуклеиновые комплексы весьма разнообразны по схемам межмолекулярной агрегации. В качестве иллюстрации можно рассмотреть четыре типа комплексов: хроматин, комплексы репрессор-оператор, рибосомы и вирусы.
Хроматин – основа хромосом эукариотических клеток; он представляет собой комплекс сверхспиральной ДНК с несколькими белками. Хроматин состоит из компактных образований – нуклеосом, связанных между собой проходными цепями ДНК. Нуклеосома представляет собой плотно упакованный комплекс (рис. 21); в центре находится четвертичная белковая структура – октамер, состоящий из четырех белков-гистонов (по две глобулы каждого гистона); этот октамер образует кольцевую структуру. Вокруг этой структуры по спирали навиты участки двойной спирали ДНК (порядка 200 нуклеотидных звеньев).

Рис. 21. Строение нуклеосомы.
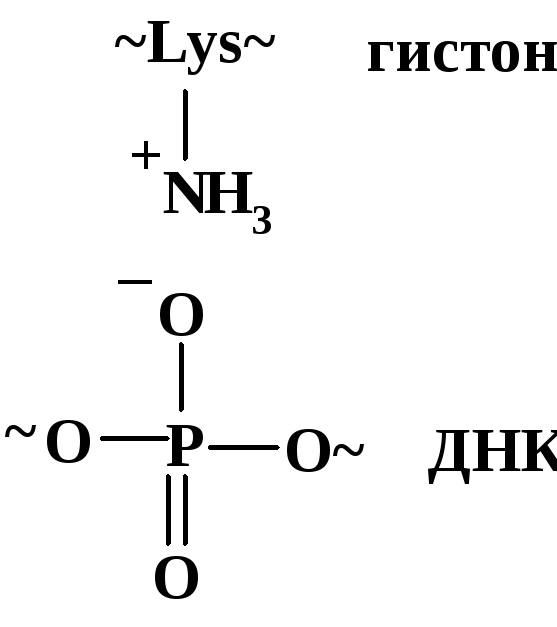 Основные силы
белково-нуклеинового взаимодействия
в нуклеосомах – электростатические
(ионные)
взаимодействия между ионизированными
фосфатными группами ДНК и аммонийными
группами лизиновых и аргининовых
звеньев, содержащихся в гистонах в
значительных количествах (гистоны
относятся к оснòвным белкам):
Основные силы
белково-нуклеинового взаимодействия
в нуклеосомах – электростатические
(ионные)
взаимодействия между ионизированными
фосфатными группами ДНК и аммонийными
группами лизиновых и аргининовых
звеньев, содержащихся в гистонах в
значительных количествах (гистоны
относятся к оснòвным белкам):
Эти взаимодействия неспецифичны, т.е. не зависят от первичной структуры
ДНК. В то же время белок-белковые взаимодействия, формирующие четвертичную структуру гистонового октамера, полностью специфичны и обеспечивают оптимальное расположение групп (в частности, лизиновых и аргининовых), взаимодействующих с ДНК.
Образование нуклеосом – основной способ плотной упаковки макромолекул ДНК, позволяющие весьма длинным (до десятков сантиметров) макромолекулам ДНК помещаться в клеточном ядре. Сама ДНК не может свернуться в плотную глобулу из-за отталкивания одноименно заряженных фосфатных групп;
Комплексы репрессоров с операторами. Это – комплексы, выполняющие важнейшие регуляторные функции в ходе генетических процессов (прежде всего транскрипции).
Репрессоры – специальные регуляторные белки, которые ингибируют транскрипцию. Обычно репрессоры – небольшие мультимерные белки, состоящие из нескольких идентичных субъединиц (двух, четырех и т.д.). Они связываются с определенными участками ДНК, которые называются операторами. При этом образуются весьма прочные комплексы; на рис. 22 представлена модель комплекса оператора с репрессором, состоящим из двух субъединиц.
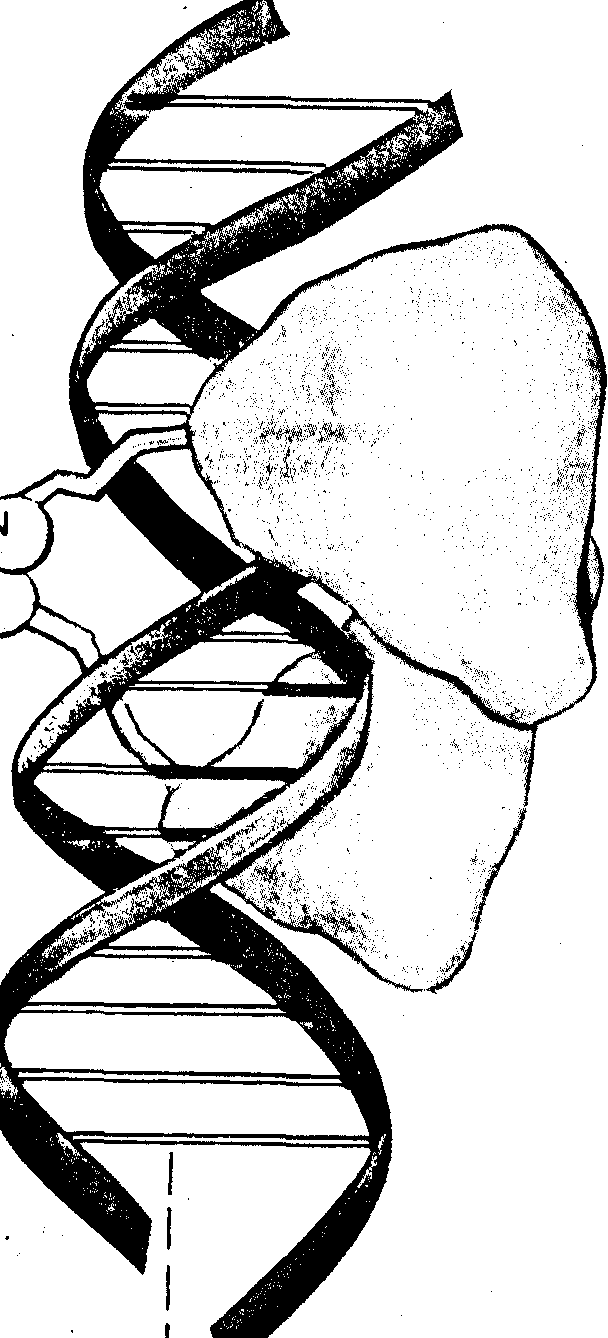
Рис.22. Модель взаимодействия оператора с репрессором бактериофага.
В изображенном здесь случае обе субъединицы белка расположены с одной стороны двойной спирали ДНК, а с другой стороны имеются только два контакта (N-концы обеих субъединиц). Можно отметить, что в отличие от хроматина, здесь контакт ДНК-белок является как бы точечным.
В отличие от комплексов хроматина, взаимодействия репрессоров с операторами являются специфическими: белок-репрессор комплексуется не с любым участком ДНК, а только с определенным (операторным), который он должен узнать. Например, репрессор так называемого лактозного оперона узнает в ДНК бактерии Escherichia coli единственную последовательность нуклеотидных звеньев из 107(!) других последовательностей того же размера. Операторный участок расположен в том месте макромолекулы ДНК, где должна начинаться транскрипция. Образование комплекса репрессор-оператор препятствует доступу к этому месту фермента РНК-полимеразы и, следовательно, блокирует транскрипцию. Такая блокировка – один из важнейших способов, обеспечивающих «молчание» гена, т.е. отсутствие его экспрессии.
Рибосомы. Как известно, это — органеллы, на которых происходит биосинтез белка, т. е. трансляция. Рибосомы состоят из двух субчастиц (субъединиц); например, 70S-рибосома бактерии Е. coli состоит из субчастиц: малой (30S) и большой (50S) (S — седиментационная единица Сведберга). Большая и малая субчастицы прилегают друг к другу очень плотно, оставляя лишь небольшую щель, в которую проходит молекула мРНК при трансляции.
Обе субчастицы представляют собой комплексы рибосомной РНК и белков. Так, например, малая субчастица рибосомы Е. соli состоит из одной молекулы рРНК и 21 молекулы белков; большая субчастица состоит из двух молекул рРНК (одной большой и одной малой) и 32 молекул белков.
Центральную часть (ядро) каждой субчастицы составляет РНК, которая свернута в компактную третичную структуру, при этом вторичная структура не меняется по сравнению с чистой РНК. Белки, повидимому, не попадают внутрь свернутой РНК, а располагаются как бы на поверхности (рис. 23); таким образом, геометрию субъединицы определяет РНК.
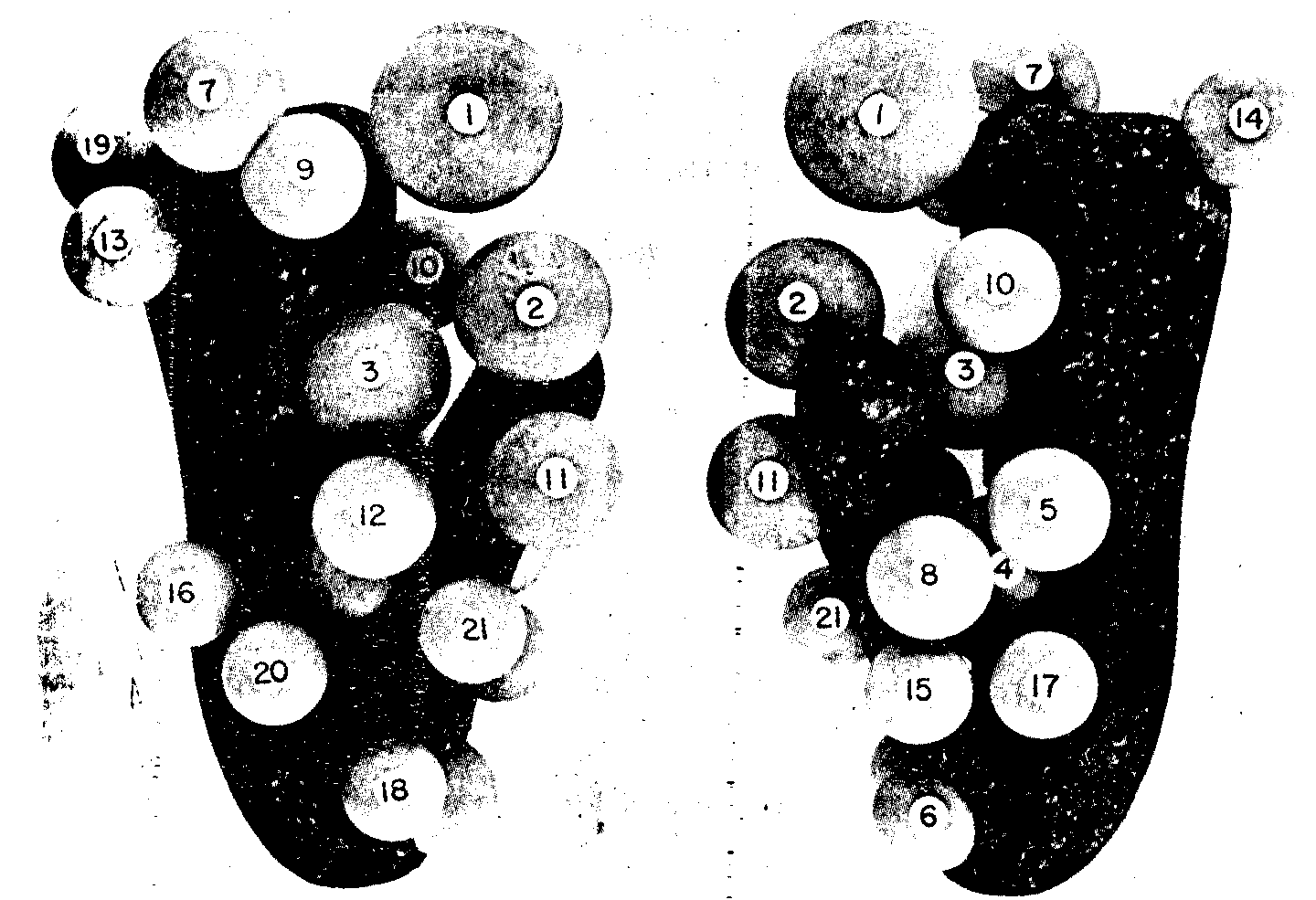
Рис. 23. Модель взаиморасположения РНК и 21 белка в рибосомной 30S субчастице.
Основные силы, стабилизирующие рибосомные субъединицы — взаимодействие РНК-белок, которое, по крайней мере, в значительной части имеет электростатический характер, но, вероятно, имеют место и другие взаимодействия. Кроме этого определенную роль играют и взаимодействия между белками, расположенными рядом.
Рибосомы можно создавать in vitro просто при контакте рибосомных РНК и необходимых белков, разумеется, в строго определенных условиях (температура, концентрация ионов Mg2+ и т.д.). Таким образом, рибосомы образуются путем самосборки, причем образуются точные копии природных рибосом. Это указывает, что определенные белки связываются со строго определенными местами рРНК и в ходе самосборки узнают эти места. Таким образом, и здесь имеет место молекулярное узнавание, детали которого пока неизвестны.
Вирусы. Вирусы — так называемые инфекционные единицы, которые могут размножаться лишь в клетке-хозяине, в которую они предварительно внедряются; при этом клетка в ряде случаев разрушается. Вне клетки вирусы размножаться не могут и являются по существу неживыми объектами; некоторые из них могут быть получены в кристаллическом виде. Вне клетки вирусные частицы называются вирионами. Их диаметр — от 20 до 300 нм. Вирусы могут инфицировать как эукариотические, так и бактериальные клетки (вирусы, внедряющиеся в бактериальные клетки, называются фагами).
Как и ранее рассмотренные структуры, вирусы являются нековалентными комплексами нуклеиновых кислот с белками.
В одних случаях вирусы содержат ДНК (ДНК-содержащие вирусы), в других — РНК (РНК-содержащие вирусы). Во всех случаях в НК закодирована генетическая информация, необходимая для их воспроизведения после попадания в клетку. Один вирус содержит в большинстве случаев одну молекулу НК, но иногда и несколько.
Вирусные белки образуют вокруг молекулы НК защитную оболочку или капсид. Вирусы могут быть весьма простыми по строению и весьма сложными, до изощренности, но основной принцип организации — молекула НК, окруженная капсидом — един для всех случаев. Капсид предохраняет молекулу НК от внешних воздействий вне клетки; при контакте с клеткой НК отделяется от капсида и внедряется внутрь клетки. Число белковых молекул в вирионе — от нескольких сот до нескольких тысяч, их молекулярная масса — в пределах 10-25 тысяч, т. е. молекулы относительно небольшие. В некоторых вирусах все молекулы капсида идентичны; капсиды других вирусов включают молекулы нескольких белков (5-10, иногда больше)
Капсиды являются по существу высокоорганизованными четвертичными структурами белков. Белковые молекулы — субъединицы — комплементарны друг к другу и весьма плотно упакованы, образуя структуры, подчиняющиеся правилам симметрии. Капсиды могут быть либо в спиральной форме, либо в форме многогранников. Например, простой по строению вирус табачной мозаики (ВТМ) (вызывает болезнь листьев табака) состоит из молекулы РНК (около 6000 нуклеотидных звеньев), окруженной капсидом из 2130 идентичных белковых молекул, уложенных по спирали.
Таким образом, рассмотренные выше нуклеопротеидные комплексы имеют различные схемы организации: «точечные контакты» (комплексы репрессор-оператор); «НК вокруг белка» (нуклеосомы); «белки на поверхности НК» (рибосомы); «белки вокруг НК» (вирусы). Все эти структуры идеально приспособлены для выполнения соответствующих биологических функций.
Резюме
Макромолекулы всех полимеров образуют в той или иной степени упорядоченные агрегаты – надмолекулярные структуры. Степень упорядоченности этих структур различна – от чисто флуктуационных образований до полностью детерминированных межмолекулярных комплексов. Наименьшая специфичность характерна для гибкоцепных полимеров; здесь основным элементом надмолекулярных структур является домен. Для жесткоцепных полимеров характерны более упорядоченные фибриллярные структуры. Для монодисперсных биополимеров характерно образование межмолекулярных комплексов; наиболее важные из них – белок-белковые и белково-нуклеиновые комплексы.
Надмолекулярные структуры, даже с не очень большой степенью упорядоченности, обеспечивают более плотную упаковку макромолекул и облегчают кристаллизацию аморфных полимеров. Межмолекулярные комплексы биополимеров позволяют осуществлять тончайшие биологические функции.
