
- •Министерство образования и наук Российской Федерации
- •Список сокращений
- •Введение
- •Глава 1. Обзор литературы
- •1.2. Химический состав и свойства чистотела большого
- •1.3. Функции алкалоидов в растениях
- •1.4. Химический состав и свойства цикория обыкновенного (Cichorium intybus l.)
- •1.5. Химический состав и свойства мать-и-мачехи обыкновенной (Tussilago farfara l.)
- •Глава 2.Экспериментальная часть
- •2.1. Материалы и методы
- •2.2.1. Определение токсического действия экстрактов лекарственных растений Chelidonium majus l., Cichorium intybus l., Tussilago farfara l. На выживаемость штамма Salmonella typhimurium ta 100
- •2.2.2. Мутагенные эффекты экстрактов лекарственных растений Chelidonium majus l., Cichorium intybus l., Tussilago farfara l.
- •1 2 3
- •1 2 3
- •2.2.3. Антимутагенные эффекты экстрактов лекарственных растений Chelidonium majus l., Cichorium intybus l., Tussilago farfara l.
- •Список использованных источников
1.5. Химический состав и свойства мать-и-мачехи обыкновенной (Tussilago farfara l.)
В листьях и цветках мать-и-мачехи содержатся: слизь (7-8%), горькие гликозиды (2,6%), сапонины, каротиноиды, инулин, яблочная и винная кислоты, аскорбиновая кислота, дубильные вещества [Веселовская, 2000].
В цветках мать-и-мачехи обнаружены стероидные соединения фитостерин, стигмастерин, фарадиол, флавоноиды рутин (0,36%), гиперозид (0,28%) и др [Племенков, 2001].
Противовоспалительное и мягчительное действие настоев и отваров листьев мать-и-мачехи обусловлено слизями. Растекаясь по слизистым оболочкам верхних дыхательных путей, слизи образуют защитную пленку, предохраняющую эпителий от раздражающего влияния холода, ингредиентов пищи, бактериальных токсинов, вирусов и др. Под защитной пленкой слизи снижается активность воспалительных процессов, регенерирует поврежденный эпителий, нормализуется его функция и движение ресничек [Веселовская, 2000].
Сапонины растения и органические кислоты разжижают патологические секреты дыхательных путей, образующиеся в результате воспаления, жизнедеятельности микроорганизмов и вирусов, способствуют более быстрой эвакуации их, очищению дыхательных путей и восстановлению газообмена. Противовоспалительное действие усиливают каротиноиды, дубильные вещества. Сумма полисахаридов мать-и-мачехи на экспериментальных моделях воспаления дает отчетливый противовоспалительный эффект, наиболее вероятно они обладают также иммуностимулирующим действием. По противовоспалительной активности полисахариды мать-и-мачехи не уступают индометацину, хотя фармакодинамика их различна [Spiller, Caffeine, 1997].
Настои и отвар листьев обладают отхаркивающим, мягчительным, противомикробным, потогонным, ранозаживляющим, желчегонным, спазмолитическим действием и являются специфическим средством в комплексном лечении при заболеваниях дыхательных путей (бронхиты, бронхиальная астма, абсцесс легких, пневмония, гангрена легких).
Кроме того, мать-и-мачеху применяют в виде водных извлечений при гастритах, язвенной болезни желудка и двенадцатиперстной кишки, заболеваниях печени [Aniszewski, 2007].
Глава 2.Экспериментальная часть
2.1. Материалы и методы
Растительный материал
В работе использованы алкалоиды, водный экстракт лекарственного растения чистотела большого (Ch. majus L.), водный экстракт цикория обыкновенного (C. intybus L.), водный экстракт мать-и-мачехи обыкновенной (T. farfaraL.).
Образцы водного экстракта из чистотела большого, цикория обыкновенного, мать-и-мачехи обыкновенной были получены следующим способом:
измельченную сухую траву чистотела большого (2,5г) заливали кипящей дистиллированной водой (50 мл/л) и кипятили в течение 15 мин. Полученный экстракт фильтровали через 4-6 слоев марли, далее пропускали через мембранный фильтр Synpor с диаметром пор 0,2 мкм. Стерильный экстракт разливали в пробирки Эппендорф и хранили при температуре –20°C.
Перед исследованием соки растений разводили стерильной дистиллированной водой до концентрации l:10, 1:100, 1:1000.
Метод выделения алкалоидов чистотела большого
Алкалоиды чистотела большого выделяли в лаборатории алкалоидов Ташкентского института химии растительных веществ им. академика С.Ю. Юнусова на основании методов, описанных А.П. Ореховым (1955).
Образцы алкалоидов из чистотела большого (Ch. majus L.) были получены следующим способом: чистотел (235 г) измельчили в ступке. К полученной массе добавили 5% соляную кислоту, после 1-часового выдерживания заливали 1,5л аммиака на 2 ч. После этого добавляли хлороформ таким образом, чтобы добиться полной экстракции веществ из сырья. Экстракцию растения чистотела помещали в аппарат Сокслета, который в нашем случае использовался как циркуляционный аппарат. Он убыстряет экстрагирование, выполняя ее в один этап. На выходе получили экстракт, в который добавили 5 % серную кислоту (H2SO4). В паровой перегонке кислоту смывали бензином для того, чтобы очистить от масел. На выходе получили кислоту без масленых примесей. После добавляется концентрированный аммиак, что бы получить щелочь. К щелочи добавили хлороформ и получили хлор - экстракт. Общий вес суммы алкалоидов был равен 1,3 г, что составляет 0,55 % от сухого веса лекарственного сырья.
Хроматограмма проводилась на пластинах Silufol UV-254 в системе растворителей ТМА (толуол/ метанол/ 25% аммиак - 4:1:0.04) [Волощук, 2010].
Бактериальные тест – системы для определения токсических эффектов соединений природного происхождения
В работе использовали штамм Salmonella typhimurium:
ТА 100 (his G46, rfa, uvr-, pKm 101, bio-), полученный из коллекции микроорганизмов каф.генетики МГУ (г. Москва).
Проведение эксперимента:
За 12-15ч. до проведения эксперимента делают пересев культуры тестерного штамма с косяка в 5мл LB-бульона для получения "ночной" культуры.
2% LB-агар разливают в чашки Петри.
Делают разведения "ночной" культуры в изотоничсеком 0,9% растворе NaCl.
Растопленный 0.6% LB-агар разливали стерильно по 3мл в пробирки и ставили в водяную баню при 45С.
В пробирки с 3мл полужидкого 0.6% LB-агар вносили 0.1мл бактериальной суспензии нужного разведения и 0.1мл вещества в исследуемой концентрации. Раствор перемешивали и наслаивали на нижний 2% питательный агар в чашки Петри. В негативный контроль вместо вещества добавляли 0.1мл растворителя. После 24ч. инкубации при 37С подсчитывают число колоний в опыте и контроле и вычисляют "процент выживания" или степень токсичности вещества:
число колоний в опыте
Процент выживания = ---------------------------------х 100%
число колоний в контроле
Опыт проводят в 2 – 3-х повторностях. Если процент выживания штамма составляет менее 3%, исследовать данную концентрацию в опытах на мутагенность не следует.
Необходимые среды:
1-LB-бульон: Пептон – 10 г, Дрожжевой экстракт – 5 г, NaCl- 5 г.
2-2% LB-агар Пептон – 10 г, Дрожжевой экстракт – 5 г, NaCl- 5 г, агар-8 г.
3-0,6% LB-агар.
Бактериальные тест – системы для определения мутагенных эффектов соединений природного происхождения
Сущность теста заключается в том, что тестерные штаммы бактерий Salmonella typhimurium культивируют на специальной среде, на которой могут расти лишь мутанты этих штаммов, у которых произошла мутация от ауксотрофности по гистидину к прототрофности. Без внешних воздействий такие мутации происходят с низкой частотой. Если в среду культивирования ввести химический мутаген, то частота мутаций значительно увеличивается, что регистрируется по числу колоний микроорганизмов, выросших на данной селективной среде.
Подготовка культуры и исследуемых препаратов:
Культуру с косяка переносили петлей в 5 мл ГПС и инкубировали при 37оС. При выращивании штаммов, несущих плазмиду рКm 101, в ГПС вносили ампициллин в концентрации 50мкг/мл.
В день постановки эксперимента 5мл "ночной" культуры переносили в 20мл свежего LB-бульон и инкубировали с принудительной аэрацией при 37оС в течение 2 – 2.5ч. Затем культуру переносили в стерильные центрифужные пробирки и центрифугировали 20 мин при 5000 об/мин. на центрифуге (MPW-310, Польша). Осадок ресуспендировали в 0,02М фосфатном буфере или растворе солевого концентрата, разведенном 1:4. Растворы исследуемых препаратов готовили в стерильной дистиллированной воде или диметилсульфоксиде (ДМСО). Растворы препаратов готовили с таким расчетом, чтобы при внесении в смесь 0,1 мл раствора доза препарата на чашку соответствовала бы исследуемой.
Проведение эксперимента:
В стерильные чашки Петри разливали нижний агар.
В пробирки разливали 0,6% верхний агар по 3 мл с микродобавками биотина и гистидина и ставят на водяную баню при температуре 45оС.
В верхний агар вносили 0,1мл бактериальной суспензии, 0,1 мл исследуемого соединения.
Предложена следующая система оценки соединений на мутагенную активность (Фонштейн с соавт., 1985):
Если число колоний-ревертантов в опыте и контроле достоверно различается менее чем в 2.5 раза, то делается заключение об отсутствии мутагенной активности. Если фиксируют превышение от 2.5 до 10 раз, то делается заключение о наличии мутагенной активности. Превышение от 10 до 100 раз говорит о средней мутагенной активности исследуемого соединения. Если фиксируют превышение более чем в 100 раз, – вещество обладает сильной мутагенной активностью.
Бактериальные тест – системы для определения антимутагенных эффектов соединений природного происхождения
Для изучения антимутагенных свойств соединений растительного происхождения использовали модификации теста Эймса: Тестерные бактерии предварительно инкубировали с разными концентрациями биокомплексов и мутагеном азидом натрия в течение 20 минутинкубировали с принудительной аэрацией при 37оС для оценки биоантимутагенного эффекта, а затем в верхний агар добавляли биотин с гистидином. Антимутагенный эффект исследуемого соединения оценивали, сравнивая число колоний прототрофов, индуцированных мутагеном без обработки клеток раствором исследуемых соединений, и после преинкубации клеток с раствором и мутагеном.
Антимутагенный эффект рассчитывали по формуле [Vorobjeva etal., 1995]:
Антимутагенный
эффект (%)
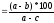 ;
;
Где a –число His+ ревертантов в положительном контроле,
b - числоHis+ ревертантов в опытном варианте,
c- числоHis+ ревертантов в негативном контроле.
Согласно Negi с соавторами [Negi etal., 2003], ингибирование мутагенного эффекта менее чем на 25 % свидетельствует о слабой, от 25 % до 40 % о средней, выше 40 % - о сильном антимутагеном эффекте.
Статистическая обработка результатов
Статистическую обработку результатов проводили с использованием стандартных математических методов в программе Microsoft Excel. Группу данных считали однородной, если среднеквадратическое отклонение в группе не превышало 15%. Различие между группами считали достоверным при Р ≤ 0.05.
Результаты исследований и их обсуждение
