
Продолжение табл. 25
|
Инвертаза |
Выработка кондитерских изделий |
|
Нуллуланаза |
Производство мальтазных (в сочетании с Р-амилазой) или глюконовых (в сочетании с глюкоамилазой) фрук- тозных сиропов из крахмала |
|
Р-Галактозидаза |
Освобождение молочной сыворотки от лактозы, приготовление мороженого и др. |
|
Пектиназа |
Осветление вин и фруктовых соков, обработка плодов цитрусов |
|
Целлюлаза |
Приготовление растворимого кофе, морковного джема, улучшение консистенции грибов и овощей, обработка плодов цитрусов |
|
Микробная протеаза |
Сыроварение, ускорение созревания теста, производство крекеров, улучшение качества мяса |
|
Пепсин, папаин |
Осветление пива |
|
Фицин, трипсин, бра- мелаин |
Ускорение процесса маринования рыбы, отделение мяса от костей |
|
Липазы |
Придание специфического аромата сыру, шоколаду, молочным продуктам, улучшению качества взбитых яичных белков |
|
Глюкозооксидаза, ка- талаза |
Удаление кислорода из сухого молока, кофе, пива, майонезов, фруктовых соков для их улучшения и удлинения сроков хранения |
|
Витамины |
|
|
А, В,, В2, В6, В12, С, D, Е, РР |
Повышение питательной ценности продуктов |
|
С, Е |
Антиоксиданты |
|
Терпены и родственные соединения |
|
|
Гераниол, нерол |
Ароматизаторы |
|
Органические кислоты |
|
|
Уксусная, бензойная, молочная, глкжоновая, лимонная, яблочная |
Консерванты, ароматизаторы |
|
Полисахариды |
|
|
Ксантаны |
Загустители и стабилизаторы кремов, джемов |
6. АВТОМАТИЗИРОВАННЫЕ
БИОТЕХНОЛОГИЧЕСКИЕ СИСТЕМЫ ДЛЯ УПРАВЛЯЕМОГО КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ
6.1. Принципы построения технического
обеспечения автоматизированных систем
Процессы микробиологического синтеза отличаются высокой степенью сложности. Многообразие функциональных связей, огромное количество взаимосвязанных параметров растущей популяции микроорганизмов, малоизученность взаимодействий культуры с окружающей средой определяют ряд требований к автоматизированным биотехнологическим системам. При разработке принципов технического и математического обеспечения автоматизированных биотехнологических систем учитываются следующие:
-
принцип системного подхода, заключающийся в том, что свойства объекта определяются не столько свойствами его отдельных элементов (параметров), сколько свойствами его структуры, особыми интегральными взаимосвязями рассматриваемого объекта. Применительно к автоматизированным системам этот принцип позволяет ускорить процесс выбора ЭВМ, внешних периферийных устройств, обеспечить гибкость математического обеспечения для решения технологических задач;
-
принцип многоуровневое™ и иерархичности, определяющий структурно-функциональную организацию автоматизированных биотехнологических систем. Одноуровневые реализации не позволяют оценивать индивидуальную эффективность параметров биотехнологического процесса с точки зрения эффективности процесса культивирования в целом;
-
принцип модульности и функциональной полноты, заключающийся в том, что отдельные модули технического и математического обеспечения автоматизированных биотехнологических систем имеют функциональную самостоятельность, а их комбинация дает возможность строить функционально полные системы различной степени сложности применительно к конкретным задачам биотехнологии;
-
принцип непрерывного развития автоматизированных биотехнологических систем, позволяющий при постоянном совершенствовании отдельных технических модулей осуществлять включение принципиально новых измерительных устройств, способных получать информацию о более сложных глубоких связях и изменениях объекта управления; основная структура автоматизированных биотехнологических систем при этом не изменяется, органически включает в себя новые элементы. Расширение функциональных возможностей и совершенствование математического обеспечения происходит при сохранении его основного ядра;
-
принцип новых задач, заключающийся в том, что разрабатываемые автоматизированные биотехнологические системы должны повышать эффективность биотехнологических процессов не за счет копирования старых технологических регламентов, а за счет решения новых задач, которые раньше не решались из-за неполного сбора и обработки информации о ходе процесса;
-
принцип максимально разумной типизации, расширяющий круг возможных заказчиков и область внедрения автоматизированных биотехнологических систем в новых отраслях народного хозяйства, позволяет снизить общую стоимость разработки новых проблемно-ориентированных автоматизированных биотехнологических систем, сократить сроки их внедрения. Принцип предполагает быструю адаптацию систем к изменению задач биотехнологии с сохранением основных пакетов прикладных программ математического обеспечения;
-
принцип эксплуатационной надежности, удобства работы и безопасности обслуживающего персонала. Реализация данного принципа существенно влияет на себестоимость конечного продукта микробиологического синтеза, позволяет снизить непроизводительные затраты на обслуживание и ремонт автоматизированных биотехнологических систем, ведет к экономии и рациональному использованию сырьевых ресурсов.
На основании вышеизложенных принципов была разработана общая схема организации комплекса технических средств автоматизированных биотехнологических систем, приведенная на рис. 24.
Данная схема состоит из четырех уровней. Первый уровень включает в себя блоки ферментации с набором датчиков, дополнительные измерительные модули, а также соответствующие исполнительные механизмы и устройство для автоматического отбора проб. Набор измерительных модулей, предназначенный для оценки физиологического состояния растущей популяции микроорганизмов, может быть различным в зависимости от целевого назначения микробиологического процесса.
Рис.
24. Блок-схема автоматизированной
биотехнологической системы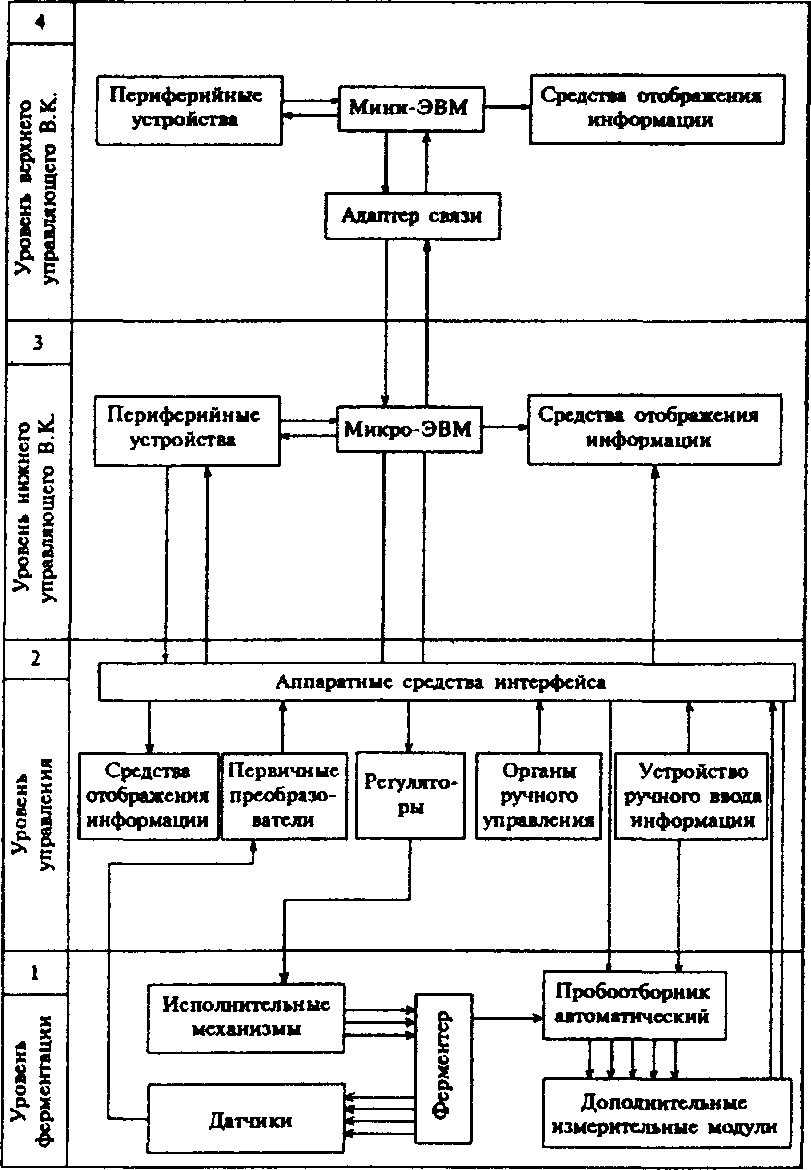
Второй уровень состоит из блоков управления, предназначенных для поддержания в заданных пределах параметров культивирования, а также из аппаратуры связи с комплексами вычислительных устройств.
Третий уровень предполагает использование микро-ЭВМ типа «Электроника-60» с периферийным оборудованием и средствами отображения информации в автоматическом режиме и в режиме диалога с оператором. Он предназначен для обработки поступающей от объекта управления информации, ведения протокола эксперимента или биотехнологического процесса и составления отчетной документации. Данный уровень обладает возможностью управления текущими параметрами процесса по определенным алгоритмам.
Четвертый уровень включает мини-ЭВМ и предназначен для построения в реальном масштабе времени моделей процессов культивирования микроорганизмов и организации по выбранным алгоритмам оптимального управления параметрами этих процессов.
Первым
этапом разработки автоматизированных
биотехнологических систем предложенной
структуры было создание лабораторной
установки для периодического и
непрерывного культивирования аэробных
и анаэробных культур микроорганизмов
«Фермус-1», блок-схема которой приведена
на рис. 25. В этой схеме реализовано два
уровня автоматизированных
биотехнологических систем. Она имеет
законченную блочно- модульную структуру,
ориентирована на решение задач
управляемого культивирования
микроорганизмов в режимах хемостата
и рН-стата.
i
I
Регуляторы
рН, рОг, t\ N
Нормализаторы
Датчики
Ферментер
4
Для расширения функциональных возможностей системы «Фермус-1» была создана система «Каскад», структура которой показана на рис. 26. Комбинация трех установок типа «Фермус-1» позволяет решать такие задачи практической микробиологии, как изучение микробных сообществ, применяемых, в частности, для биологической очистки сточных вод, а также исследование многостадийных процессов микробиологического синтеза.
|
Норма |
|
Регуляторы |
1 |
Норма |
|
Регуляторы |
1 |
Норма |
|
Регуляторы |
|
лизаторы |
|
рН, р02, Г, N |
1 |
лизаторы |
|
рН, р02, t°, N |
|
лизаторы |
|
рН, р02, t°, N |
I
Исполнительные
механизмы
Исполнительные
механизмы
Исполнительные
механизмы
Датчики
Датчики
Z
Датчики
Насос
1 Скорость протока
Насос
2 Скорость протока
-8-1
m
■
V2
V1
Рис. 26. Блок-схема системы «Каскад»
6.2. Математическое обеспечение
автоматизированных биотехнологических систем
Разработано математическое обеспечение двух уровней:
-
математическое обеспечение моделирования процессов микробиологического синтеза (верхний уровень), позволяющее на основе методов системного анализа строить математические модели, проводить их параметрическую идентификацию, проверку адекватности, а также осуществлять поиск оптимальных режимов управления;
-
математическое обеспечение текущего эксперимента (нижний уровень), позволяющее осуществлять сбор и первичную обработку
информации, передачу управляющих воздействий, ведение текущей и итоговой документации.
Применение средств вычислительной техники в составе систем для культивирования микроорганизмов открывает исследователю новые возможности, например в осуществлении более полного сбора информации о процессе с помощью различных датчиков и анализаторов.
Наличие ЭВМ в автоматизированных биотехнологических системах позволяет на основе экспериментальных данных строить математическое описание микробиологического процесса. Поиск оптимальных режимов управления процессами по математическим моделям существенно сокращает время на разработку интенсивных режимов культивирования и удешевляет их реализацию.
Рис.
27. Структурная схема математического
обеспечения
моделирования
процессов микробиологического синтеза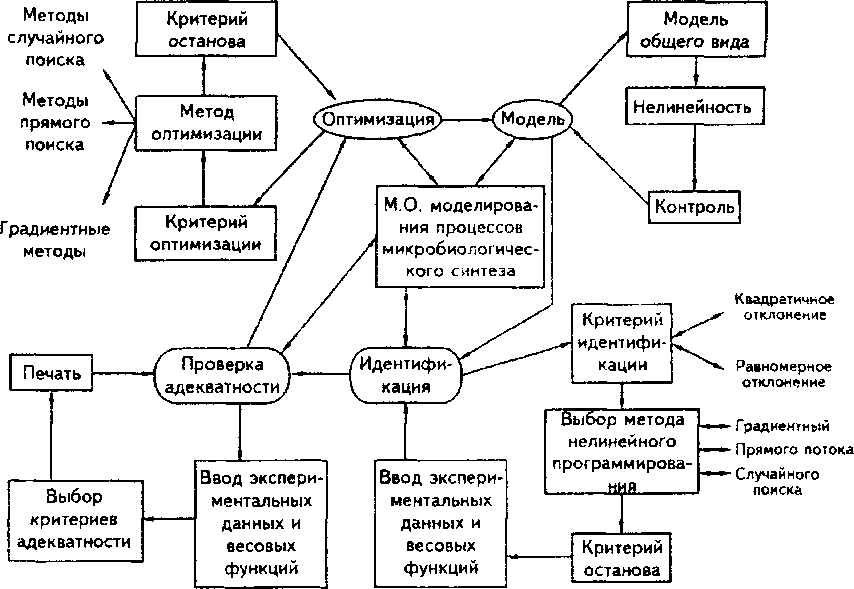
На сегодняшний день в литерат>'ре описаны около 1000 математических моделей процесса культивирования микроорганизмов. Несмотря на такое обилие математических моделей, не существует и, по- видимому, не может существовать универсальной математической модели процессов микробиологического синтеза ввиду необычайной сложности и многообразия жизнедеятельности микроорганизмов. Однако возможно алгоритмизировать процесс построения моделей и соответственно автоматизировать его. Сформулированные выше (п. 5.1.) правила позволяют строить обобщенные математические модели процессов микробиологического синтеза.
После получения структуры математической модели важнейшим этапом построения оптимизационной модели является ее параметрическая идентификация. Определение постоянных значений параметров математической невязки, характеризующей меру отклонения теоретических значений переменных процесса от экспериментальных,
д(А1,А2,...,Ат) = ^—~ , (9)
N-т
где Ah А2, ..., Ат - постоянные коэффициенты модели; Y™c - экспериментапь- ные значения переменных процесса; К, - соответствующие теоретические значения, вычисленные по модели; а, - весовые коэффициенты; N - число экспериментальных точек; т — число постоянных коэффициентов модели.
Сведение задачи идентификации математической модели к задаче математического программирования - минимизации функции невязки - имеет целью ее упрощение и представление в виде известной ранее задачи с хорошо разработанными методами решения. Блок-схема построения модели общего вида показана на рис. 28.
Для микробиологических процессов, целью которых является накопление биомассы микроорганизмов, перечисленные три класса управляющих функций считаются наиболее приемлемыми.
Переход от задач оптимального управления к задачам параметрической оптимизации примечателен еще и тем, что позволяет исследователю воспользоваться методами минимизации функций нескольких переменных, имеющихся в библиотеке методов диалоговой системы идентификации моделей.
Поиск квазиоптимальных управляющих воздействий на процесс ферментации микроорганизмов осуществляет «Диалоговая система оптимизации», блок-схема которой приведена на рис. 29.
Математическое обеспечение созданных к настоящему времени биотехнологических систем в основном ориентировано на весьма узкий клгхс и на конкретный комплекс технических средств (КТС). Это затрудняет применение созданного математического обеспечения для решения новых классов задач и использование других КТС. Поэтому целью разра-
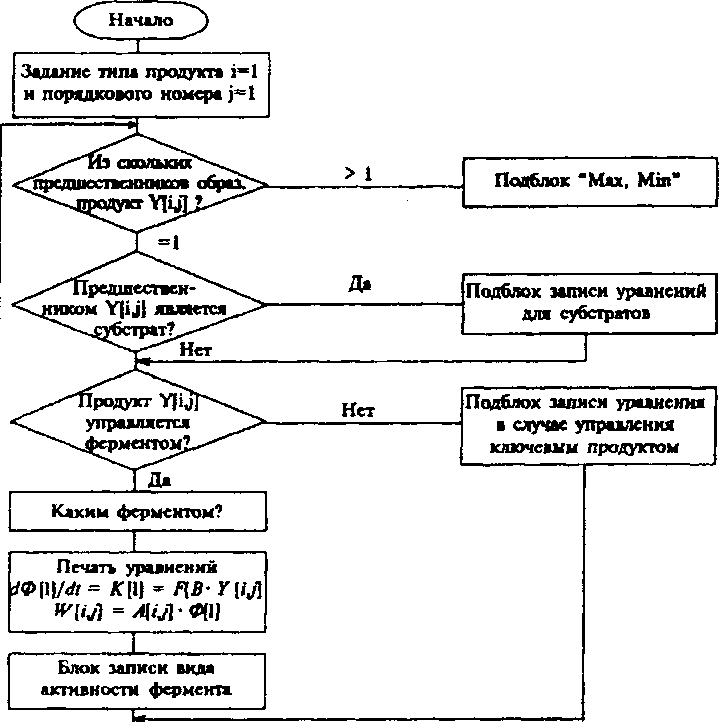
Рис.
28. Блок-схема построения
модели общего вида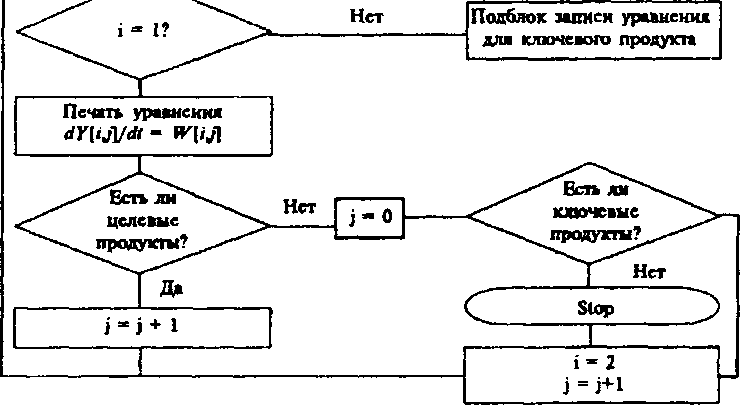
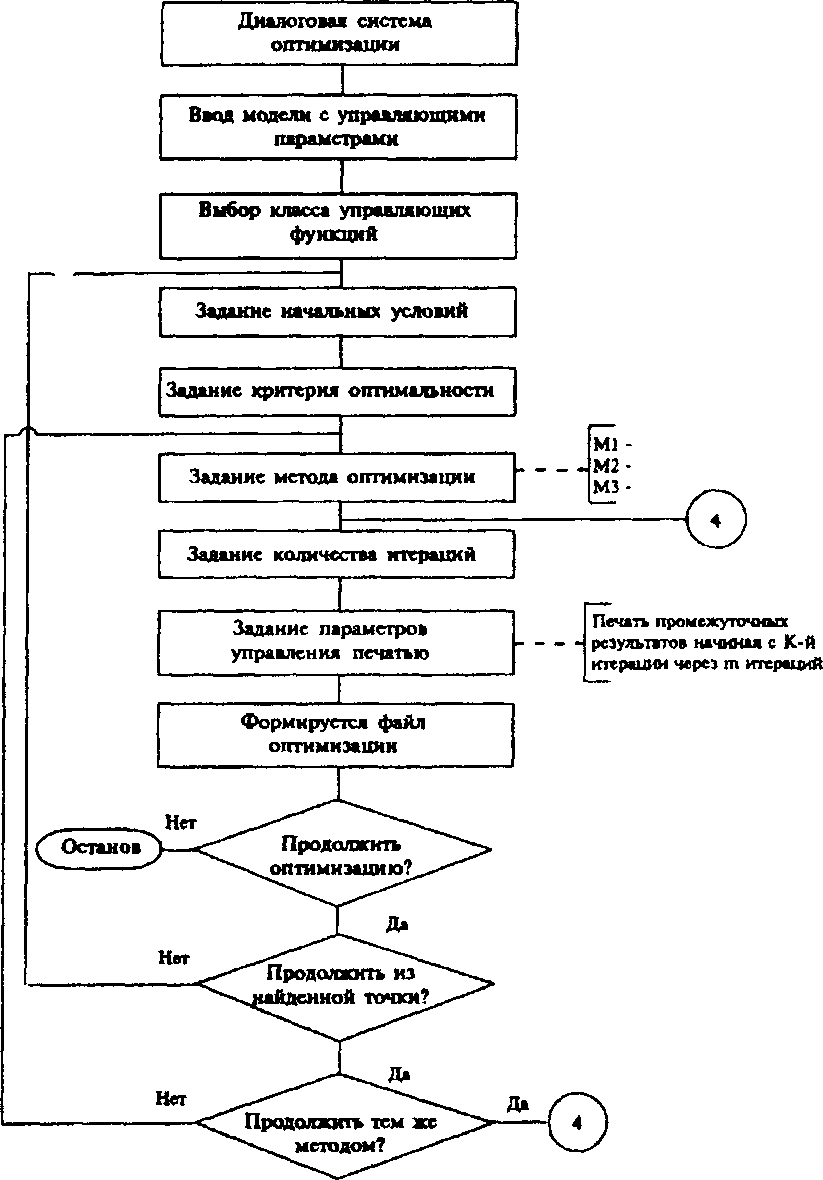
Рис. 28. Блок-схема диалоговой системы оптимизации
ботки математического обеспечения текущего эксперимента было создание типовых алгоритмов и пакетов программ, независимых от КТС, для анализа и управления параметрами культивирования микроорганизмов в автоматическом и диалоговом режимах, обеспечивающих накопление необходимой информации с целью последующего ее использования.
На основании проведенного анализа существующих систем управляемого культивирования микроорганизмов и изучения класса задач, возникающих в лабораторных экспериментах и промышленном культивировании, были выработаны следующие требования, которым должно удовлетворять разрабатываемое математическое обеспечение текущего эксперимента:
-
математическое обеспечение текущего эксперимента должно быть построено по принципу модульно-интерфейсной адаптации, то есть должно представлять собой совокупность функционально независимых комбинаций и построения интерфейсов. В зависимости от решаемых задач или типа КТС формируется необходимое обеспечение текущего эксперимента;
-
математическое обеспечение текущего эксперимента должно реа- лизовывать два режима отображения информации по запросу;
-
математическое обеспечение текущего эксперимента должно осуществлять тестирование и автоматическую диагностику неисправностей КТС и объекта управления, в том числе неисправностей датчиков и контуров регулирования управляемых параметров (нормализаторов, управляющих механизмов, линий передач данных), а также контролировать выход параметров состояния объекта управления их допустимых пределов изменения;
-
время реакции: математическое обеспечение текущего эксперимента на автоматически анализируемую неисправность не должно превышать 2 мин;
-
математическое обеспечение текущего эксперимента должно реа- лизовывать управление не более чем 10 ферментами;
-
анализируемыми параметрами в каждом ферментере в зависимости от поставленной цели культивирования могут быть рН, р02, число оборотов мешалки, оптимальная плотность культуральной жидкости в ферментере, температура окружающей среды, скорость изменения кислотности культуральной жидкости, напряжение на нагревающем элементе, удельная скорость роста микроорганизмов;
-
управляемыми параметрами в каждом ферментере могут быть рН, температура в ферментере, р02, число оборотов мешалки, подача питательной среды или питательного субстрата.
Для реализации вышеперечисленных требований при разработке структуры математического обеспечения текущего эксперимента необходимо выполнить следующие условия:
-
связь модулей между собой должна происходить на информационном уровне;
-
математическое обеспечение текущего эксперимента должно контролироваться собственной операционной системой, осуществляющей информационную связь между модулями математического обеспечения в процессе работы.
Создание типового ряда технических и программных модулей автоматизированных биотехнологических систем позволило существенно сократить сроки разработок проблемно-ориентированных автоматизированных биотехнологических систем различной архитектуры.
Разработка
методов системного анализа применительно
к процессам роста и жизнедеятельности
микробных популяций привела к созданию
единых методик построения системных
схем и математических описаний процессов
управляемого культивирования
микроорганизмов. Благодаря развитию
методов системного анализа стало
возможным блочно-модульное конструирование
не только автоматизированных систем
управления, но и математических моделей
и оптимальных управлений. Иными словами,
создан своеобразный биотехнологический
конструктор (наподобие детского «Сделай
сам»), составными элементами которого
являются модули математического и
технического обеспечения
автоматизированных биотехнологических
систем для управляемого культивирования
микроорганизмов.
Биотехнология (в широком смысле этого термина) уже сегодня имеет большое экономическое и социальное значение. Главная цель этого раздела книги - проанализировать перспективы ее развития, описать механизмы новой биотехнологии.
В настоящее время перспективно использование достижений биотехнологии: в промышленности - пищевой, фармацевтической, химической, нефтегазовой в направлении биосинтеза и биотрансформации новых веществ на основе применения сконструированных методами генной инженерии штаммов бактерий и дрожжей с заданными свойствами по микробиологическому синтезу; в сельском хозяйстве - разработка в области растениеводства трансгенных агрокультур, биологических средств защиты растений, биогумуса, бактериальных удобрений, микробиологических методов рекультивации почв; в области животноводства - создание эффективных кормовых препаратов из растительной, микробной биомассы и отходов сельского хозяйства, репродукция животных на основе эмбриогенетических методов; в энергетике - применение новых источников биоэнергии, полученных на основе микробиологического синтеза и моделированных фотосинтетических процессов, биоконверсии биомассы в биогаз; в медицине - разработка медицинских биопрепаратов моноклональных антител, диагностикумов, вакцин, развитие иммунобио- технологии в направлении повышения чувствительности и специфичности иммуноанализа заболеваний инфекционной и неинфекционной природы; в экологии - разработка экологически безопасных технологий по очистке сточных вод, утилизация отходов агропромышленного комплекса, конструирование экосистем.
Глубокие перемены, происшедшие в биологии за последние десятилетия, открыли принципиально новые перспективы в развитии биотехнологии, расширили границы применения биологических процессов в производстве и привели к появлению новых направлений в биотехнологии, которые объединяют под общим названием «современная биотехнология». Современная биотехнология, по определению Европейской федерации биотехнологии (EFB), связана с применением потенциала биохимии, микробиологии, молекулярной биологии и инженерных дисциплин для утилизации в промышленных масштабах культур микроорганизмов, клеток и тканей растений, животных и человека или частей их. Она создает возможности получения в мягких условиях с помощью легкодоступных и возобновляемых ресурсов промышленно ценных и жизненно важных для человека веществ и соединений при низком энергопотреблении.
Под понятием «современная биотехнология» в настоящее время подразумевают чаще всего два наиболее крупных ее направления - генетическую и клеточную инженерию, которые охватывают основную часть этой сложной междисциплинарной технологии и имеют наиболее широкие потенциальные области применения. Именно на этих направлениях в последние две декады столетия были достигнуты значительные успехи в разработке и производстве биологически активных веществ. Это в первую очередь создание промышленной технологии производства широкого ряда генноинженерных препаратов инсулина, гормона роста человека, интерферонов, интерлейкинов, эритропоэтина, активатора тканевого плазминогена, ряда моноклональных антител и вакцин и многих других.
Разработка лекарственных средств с использованием методов современной биотехнологии наиболее активно ведется в США, Японии и отдельных странах Западной Европы, где на эти цели расходуется в среднем 2/3 средств, выделяемых на НИОКР в области биотехнологии. Практически во всех этих государствах существуют правительственные программы поддержки биотехнологических проектов, проводятся фундаментальные исследования и промышленное внедрение новых биотехнологических продуктов.
В США, являющихся лидером в области современной биотехнологии, для проведения фундаментальных и прикладных исследований было образовано большое число специализированных биотехнологических фирм, которые, привлекая частный и государственный капитал и лучшие научные кадры, в считанные годы разработали и запатентовали способы получения многих белковых продуктов медицинского назначения.
Япония занимает второе место в мире после США по уровню развития биотехнологии. И если в традиционных ее областях, в частности в производстве ферментов, антибиотиков и аминокислот, позиции Японии очень сильны, то в применении методов новейшей биотехнологии наблюдается значительное отставание от США, осуществивших мощный рывок в данном направлении. Для преодоления этого отставания Япония сделала ставку на революционное развитие биотехнологии. Расчет делался как на традиционные для Японии пути развития (практическое использование научно-технической информации и закупка лицензий и патентов на генноинженерную технологию и штаммы микроорганизмов), так и на быструю подготовку японских специалистов путем стажировки за рубежом и расширение собственных исследований по генетической инженерии в университетах и лабораториях промышленных фирм. В отличие от США, специализированных биотехнологических фирм в Японии создано очень мало и, как правило, исследованиями в этой области заняты крупные фирмы.
Наряду с США и Японией, биотехнология быстрыми темпами развивается и в странах Западной Европы. Эти страны могут в будущем оказать значительное влияние на конъюнктуру рынка биотехнологических продуктов. Как и в США, в 80-х годах в Западной Европе резко возросло количество мелких биотехнологических фирм. Возникли они в основном на базе лабораторий, ранее проводивших фундаментальные научные исследования. Многие из них финансируются в настоящее время промышленными корпорациями и финансовыми учреждениями, либо пользуются финансовой поддержкой со стороны правительства.
Наибольшее развитие биотехнологии наблюдается в Великобритании (где по состоянию на ноябрь 1998 г. зарегистрировано 58 фирм, проводящих исследования в этой области), во Франции 51 фирма, и в Германии 48 фирм. Значительные усилия по развитию биотехнологии предпринимаются со стороны правительств Нидерландов, Италии, Дании и Швеции.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
-
Бекер М. Е. Введение в биотехнологию. - М.: Пищевая промышленность, 1978. - 232 с.
-
Бирюков В. В., Кантере В. М. Оптимизация периодических процессов микробиологического синтеза. - М.: Наука, 1985. - 292 с.
-
Виестур У.Э., Шмите И. А., Жилевич А. В. Биотехнология. - Рига: Зинанте, 1987.-263 с.
-
Варфоломеев С. Д., Калюжный С. В. Биотехнология. Кинетические основы микробиологических процессов. - М.: Высшая школа, 1990.-295 с.
-
Бекер М. Е., Лиепиньш Г. К., Райнулис Е. П. Биотехнология. - М.: Агропромиздат, 1990. - 334 с.
-
Экологическая биотехнология. - Л.: Химия, 1990. - 384 с.
-
Кислухина О., Кюдулас И. Биотехнологические основы переработки растительного сырья. - Каунас: Технология, 1997. - 183 с.
-
Golubev. V. Introduction to Bioengineering. - UFLA, Lavras, Brazil, 1995.
-
Harvey W. Blanch, Douglas S. Clark. Biochemical Engineering. - Marcel Dekker, N.-Y., 1997. - 702 p.
