
- •1.Кинематика. Перемещение, скорость, ускорение.
- •2.Законы Ньютона
- •3.Закон сохранения импульса
- •4.Работа, кинетическая энергия
- •5.Потенциальные силы, потенциальная энергия, закон сохранения энергии
- •6.Гравитационное поле, потенциальная энергия гравитационного поля
- •7.Центральный удар, абсолютно упругий и абсолютно неупругий удар
- •8.Вращательное движение, угловая скорость, угловое ускорение
- •9.Момент инерции, момент сил, закон вращательного движения
- •10.Термодинамическое уравнение состояния идеального газа
- •11.Кинетическое уравнение состояния идеального газа, внутренняя энергия
- •12.Барометрическая формула Больцмана
- •13.Распределение Максвелла
- •14.Броуновское движение
- •15.Первое начало термодинамики. Работа, теплота ,внутренняя энергия.
- •16.Изобарический и изохорические процессы, теплоемкость в таких процессах
- •17.Изотермический и адиабатический процессы: реализация, работа и уравнения
- •18.Второе начало термодинамики, формулировки Томпсона и Клаузиуса
- •19.Цикл Карно
- •Описание цикла Карно:
- •20.Энтропия: определение, закон возрастания энтропии
- •21.Процессы переноса, законы Фика и Фурье
- •22.Закон Кулона, напряженность электрического поля, закон суперпозиции
- •23.Опыт Милликена, заряд электрона.
- •24.Поле электрического диполя
- •25.Теорема Гаусса, примеры ее применения
- •26.Потенциал электрического поля
- •27.Проводники и диэлектрики во внешнем поле
- •28.Диэлектрики, диэлектрическая проницаемость, восприимчивость и вектор поляризации
- •29.Электрическое поле на границе диэлектриков
- •30.Электрическая ёмкость проводника, конденсатор
- •31.Энергия электрического поля
16.Изобарический и изохорические процессы, теплоемкость в таких процессах
Изобарный
процесс-термодинамический
процесс, происходящий в системе
при постоянномдавлениии массе идеального газа. Согласнозакону
Гей-Люссака, при изобарном
процессе видеальном
газе![]() .
.
Работа, совершаемая газом при расширении или сжатии газа, равна A=PΔV.
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: δQ= ΔI= ΔU+PΔV.
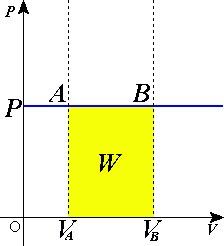 График изобарического
расширения газа от объёма Va
до Vb.
AB
здесь является изобарой.
График изобарического
расширения газа от объёма Va
до Vb.
AB
здесь является изобарой.
Молярная теплоёмкость при постоянном давлении обозначается как Cp. В идеальном газе она связана с теплоёмкостью при постоянном объёмесоотношением МайераCp=Cv+R.
Молекулярно-кинетическая
теория позволяет вычислить приблизительные
значения молярной теплоёмкости для
различных газов через значение
универсальной
газовой постоянной: для
одноатомных газов![]() ,
то есть около 20.8 Дж/(моль·К); для двухатомных
газов
,
то есть около 20.8 Дж/(моль·К); для двухатомных
газов![]() ,
то есть около 29.1 Дж/(моль·К); для
многоатомных газовCp= 4R,
то есть около 33.3 Дж/(моль·К).
,
то есть около 29.1 Дж/(моль·К); для
многоатомных газовCp= 4R,
то есть около 33.3 Дж/(моль·К).
Изохорический или изохорный процесс -это термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.

Теплоемкость
|
|
17.Изотермический и адиабатический процессы: реализация, работа и уравнения
Изотермический процесс—термодинамический процесс, происходящий в физической системе при постояннойтемпературе.
Для осуществления изотермического процесса систему обычно помещают в термостат,теплопроводностькоторого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Графиком изотермического процесса является изотерма.
В идеальном газепри изотермическом процессе произведение давления на объём постоянно (закон Бойля-Мариотта). Изотермы идеального газа в координатахp,V— гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс .
При изотермическом процессе системе, вообще говоря, сообщается определённое количество теплоты (или она отдаёт теплоту) и совершается внешняя работа. Альтернативный процесс, при котором теплообмен с окружающей средой отсутствует (термодинамическая система находится в энергетическом равновесии — система не поглощает и не выделяет тепло), называется адиабатическим процессом.
Работа,
совершенная идеальным газом в
изотермическом процессе, равна![]() ,
где
,
где![]() —
число частиц газа,
—
число частиц газа,![]() —
температура,
—
температура,![]() и
и![]() —
объём газа в начале и конце процесса,
—
объём газа в начале и конце процесса,![]() —постоянная
Больцмана.
—постоянная
Больцмана.
В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход.
Первый
закон термодинамики для изотермического
процесса в идеальном газе записывается
в виде:
![]()
![]()
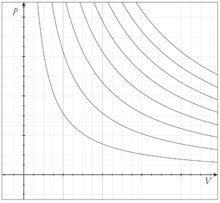
Адиабатический процесс—термодинамический процессв макроскопической системе, при котором система не получает и не отдаёт тепловой энергии. В общем случае адиабатический процесс необратим.
Линия, изображающая адиабатный процесс на какой-либо термодинамической диаграмме, называется адиабатой.

Для
адиабатического процесса первое начало
термодинамики в силу отсутствия
теплообмена (ΔQ= 0) системы со средой
имеет вид![]() ,
где:
,
где:![]() —
изменение внутренней энергии тела,
—
изменение внутренней энергии тела,![]() —
работа, совершаемая системой,
—
работа, совершаемая системой,![]() —
теплота, полученная системой
—
теплота, полученная системой
Основное
уравнение термодинамики применительно
к адиабатическому процессу записывается
в дифференциалах как
![]() ,
,
где
![]() —
дифференциальное выражение для работы,ai— внешние параметры,Ai— соответствующие им внутренние
параметры. В частном случае, когда работа
совершается через изменение объёма,
—
дифференциальное выражение для работы,ai— внешние параметры,Ai— соответствующие им внутренние
параметры. В частном случае, когда работа
совершается через изменение объёма,![]() ,
гдеp— давление.
,
гдеp— давление.
Для
идеальных
газовадиабата имеет простейший
вид и определяется уравнением:![]() ,
где:
,
где:![]() —давлениегаза,
—давлениегаза,![]() —
егообъём,
—
егообъём,![]() —показатель
адиабаты,
—показатель
адиабаты,![]() и
и![]() —теплоёмкостигаза соответственно при постоянном
давлении и постоянном объёме.
—теплоёмкостигаза соответственно при постоянном
давлении и постоянном объёме.
Показатель
адиабаты: Для
нерелятивистского невырожденного
одноатомного идеального газа
![]() ,
для двухатомного
,
для двухатомного![]() ,
для трёхатомного
,
для трёхатомного![]() ,
для газов состоящих из более сложных
молекул, показатель адиабаты,
,
для газов состоящих из более сложных
молекул, показатель адиабаты,![]() определяется
числомстепеней
свободы
конкретной молекулы.
определяется
числомстепеней
свободы
конкретной молекулы.
При
адиабатическом процессе показатель
адиабаты равен
![]() ,
где R —универсальная
газовая постоянная.
,
где R —универсальная
газовая постоянная.
С учётом уравнения состояния идеального газауравнение адиабаты может быть преобразовано к виду:
![]() ,
гдеT—абсолютная
температурагаза.
,
гдеT—абсолютная
температурагаза.
Или к виду:
![]()
Поскольку
![]() всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (т.е. при
уменьшенииV) газ нагревается (Tвозрастает), а при расширении —
охлаждается, что всегда верно и для
реальных газов.
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (т.е. при
уменьшенииV) газ нагревается (Tвозрастает), а при расширении —
охлаждается, что всегда верно и для
реальных газов.
