- •1.Кинематика. Перемещение, скорость, ускорение.
- •2.Законы Ньютона
- •3.Закон сохранения импульса
- •4.Работа, кинетическая энергия
- •5.Потенциальные силы, потенциальная энергия, закон сохранения энергии
- •6.Гравитационное поле, потенциальная энергия гравитационного поля
- •7.Центральный удар, абсолютно упругий и абсолютно неупругий удар
- •8.Вращательное движение, угловая скорость, угловое ускорение
- •9.Момент инерции, момент сил, закон вращательного движения
- •10.Термодинамическое уравнение состояния идеального газа
- •11.Кинетическое уравнение состояния идеального газа, внутренняя энергия
- •12.Барометрическая формула Больцмана
- •13.Распределение Максвелла
- •14.Броуновское движение
- •15.Первое начало термодинамики. Работа, теплота ,внутренняя энергия.
- •16.Изобарический и изохорические процессы, теплоемкость в таких процессах
- •17.Изотермический и адиабатический процессы: реализация, работа и уравнения
- •18.Второе начало термодинамики, формулировки Томпсона и Клаузиуса
- •19.Цикл Карно
- •Описание цикла Карно:
- •20.Энтропия: определение, закон возрастания энтропии
- •21.Процессы переноса, законы Фика и Фурье
- •22.Закон Кулона, напряженность электрического поля, закон суперпозиции
- •23.Опыт Милликена, заряд электрона.
- •24.Поле электрического диполя
- •25.Теорема Гаусса, примеры ее применения
- •26.Потенциал электрического поля
- •27.Проводники и диэлектрики во внешнем поле
- •28.Диэлектрики, диэлектрическая проницаемость, восприимчивость и вектор поляризации
- •29.Электрическое поле на границе диэлектриков
- •30.Электрическая ёмкость проводника, конденсатор
- •31.Энергия электрического поля
Описание цикла Карно:
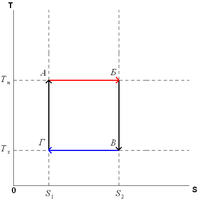
Цикл Карно в координатах P и V Цикл Карно в координатах T и S
Пусть тепловая машинасостоит из нагревателя с температуройTH, холодильника с температуройTXирабочего тела.
Цикл Карно состоит из четырёх стадий:
Изотермическое расширение(на рисунке — процесс A→Б). В начале процесса рабочее тело имеет температуруTH, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт емуколичество теплотыQH. При этом объём рабочего тела увеличивается.
Адиабатическое (изоэнтропическое) расширение(на рисунке — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Изотермическое сжатие(на рисунке — процесс В→Г). Рабочее тело, имеющее к тому времени температуруTX, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплотыQX.
Адиабатическое (изоэнтропическое) сжатие(на рисунке — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При
изотермических процессах температура
остаётся постоянной, при адиабатических
отсутствует теплообмен, а значит,
сохраняется энтропия (поскольку
![]() при
δQ= 0). Поэтому
цикл Карно удобно представить в
координатах T и S (температура
и энтропия).
при
δQ= 0). Поэтому
цикл Карно удобно представить в
координатах T и S (температура
и энтропия).
20.Энтропия: определение, закон возрастания энтропии
Энтропия— это сокращениедоступной энергиивещества в результате передачи энергии.Первый закон термодинамикигласит, что энергию невозможно создать или уничтожить. Следовательно, количество энергии во вселенной всегда такое же, как было и при ее создании.Второй закон термодинамикигласит, чтокоэффициентполезного действия ни одного реального (необратимого) процесса не может быть 100% при преобразовании энергии в работу.
Понятие энтропии впервые было введено Клаузиусомвтермодинамикев1865 годудля определения меры необратимогорассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она являетсяфункцией состоянияи остаётся постоянной приобратимых процессах, тогда как внеобратимых— её изменение всегда положительно.
![]() ,
,
где dS— приращение энтропии; δQ— минимальная теплота подведенная к системе; T — абсолютная температура процесса;
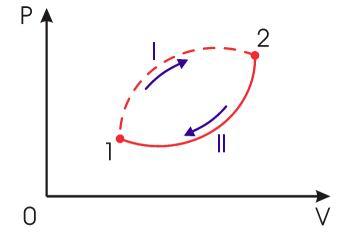
Применим неравенство Клаузиуса для описания необратимого кругового термодинамического процесса, изображенного на рис 3.13.
|
|
|
Рис. 3.13. Необратимый круговой термодинамический процесс |
Пусть
процесс![]() будет
необратимым, а процесс
будет
необратимым, а процесс![]() -
обратимым. Тогда неравенство Клаузиуса
для этого случая примет вид:
-
обратимым. Тогда неравенство Клаузиуса
для этого случая примет вид: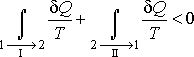
Так
как процесс![]() является
обратимым, для него можно воспользоваться
соотношением(3.53),
которое дает :
является
обратимым, для него можно воспользоваться
соотношением(3.53),
которое дает :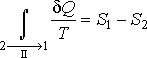
Подстановка
этой формулы в неравенство(3.55)позволяет получить выражение :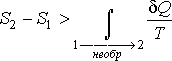
|
|
|
Сравнение
выражений позволяет записать следующее
неравенство :![]() ,
в котором знак равенства имеет место
в случае, если процесс
,
в котором знак равенства имеет место
в случае, если процесс![]() является
обратимым, а знак больше, если процесс
является
обратимым, а знак больше, если процесс![]() -
необратимый.
-
необратимый.
Если рассмотреть
адиабатически изолированную
термодинамическую систему, для которой![]() ,
то выражение примет вид
,
то выражение примет вид![]() или
в интегральной форме
или
в интегральной форме![]()
Полученные неравенства выражают собойзакон возрастания энтропии, который можно сформулировать следующим образом:«В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс»
Записанное утверждение является ещё одной формулировкой второго начала термодинамики.
Таким образом, изолированная термодинамическая система стремится к максимальному значению энтропии, при котором наступает состояние термодинамического равновесия.