
- •Алканы Способы получения
- •Химические свойства
- •Алкены Способы получения
- •Химические свойства
- •Алкины Способы получения
- •Химические свойства
- •Сопряженные диены Способы получения
- •Химические свойства
- •Ароматические углеводороды Способы получения
- •Химические свойства
- •Химические свойства
- •Галогеноуглеводороды Способы получения
- •Химические свойства
- •Спирты Способы получения
- •Химические свойства
- •Многоатомные спирты
- •Методы получения
- •Химические свойства
- •Простые эфиры
- •Методы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Альдегиды и кетоны
- •Способы получения
- •Химические свойства
- •Карбоновые кислоты и их производные Способы получения
- •Химические свойства
- •Одноосновные непредельные кислоты
- •Непредельные двухосновные кислоты
- •Методы получения
- •Амины Способы получения
- •Химические свойства
- •Аминокислоты Способы получения
- •Химические свойства
- •Углеводы. Моносахариды. Олигосахариды. Полисахариды. Способы получения
- •Моносахриды
Способы получения
1. C6H5Cl + NaOH (p, 340°С) C6H5OH + NaCl (щелочной гидролиз галогеноуглеводородов)

Преимущества метода: безотходная технология (выход полезных продуктов >99%) и экономичность. В настоящее время кумольный способ используется как основной в мировом производстве фенола.
3. C6H5SO3Na + NaOH (300-350°С) C6H5OH + Na2SO3 (щелочное плавление солей
ароматических сульфоновых кислот)
Основными недостатками этого способа являются жесткие условия процесса и большое количество отходов, загрязняющих окружающую среду.
Химические свойства
1.2C6H5OH + 2Na 2C6H5ONa + H2 (также как и этанол)
2. C6H5OH + NaOH С6H5ONa + H2O (в отличии от этанола)
C6H5ONa + H2O + CO2 C6H5OH + NaHCO3 (фенол более слабая кислота, чем угольная)
3. Кислотность фенолов зависит от природы (донор, акцептор), положения относительно ОН-группы и количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н, акцепторы уменьшают.


Фенолы не образуют сложные эфиры в реакциях с кислотами. Для этого используются более реакционноспособные производные кислот (ангидриды, хлорангидриды).
5.
C6H5OH
+ CH3CH2OH
 C6H5OCH2CH3
+NaBr
(О-алкилирование)
C6H5OCH2CH3
+NaBr
(О-алкилирование)


8. nC6H5OH +nCH2O nH2O + (-C6H3OH-CH2-)n (поликонденсация, получение
фенолформальдегидных смол)
Альдегиды и кетоны

Способы получения

1. а) С2H5-OH CH3-CHO (дегидрирование, окисление первичных спиртов)
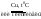
б) CH3-CH(OH)-CH3 CH3-CO-CH3 (дегидрирование, окисление вторичных спиртов)
2.а)
СH3CH2CHCl2
+ 2NaOH![]() CH3CH2CHO
+ 2NaCl
+ H2O
(гидролиз
CH3CH2CHO
+ 2NaCl
+ H2O
(гидролиз
б)
СH3ССl2CH3
+ 2NaOH![]() СH3COCH3
+ 2NaCl
+ H2O
дигалогенопроизводных)
СH3COCH3
+ 2NaCl
+ H2O
дигалогенопроизводных)


4. Пиролиз (декарбоксилирование) солей карбоновых кислот.

5. CH2=CH2 + [O] CH3-CH=O (PdCl2, Cu2Cl2 100о С, 1МПа) (окисление этилена до этаналя)
CH4 + O2 H2C=O + H2O (400-600о С, NO) (окисление метана до формальдегида)
Химические свойства
Для альдегидов и кетонов характерны реакции различных типов: а) нуклеофильное присоединение по карбонильной группе; б) восстановление и окисление; в) конденсация; д) полимеризация.

Дефицит электронной плотности на атоме углерода карбонила (+') в кетонах ниже, чем в альдегидах (+) из-за донорных эффектов двух алкильных групп. Следствием является снижение реакционной способности карбонильной группы в кетонах.

Механизм AdNu –нуклеофильное присоединение, Nu – СN (нитрил-анион)



Схема

3. Присоединение реактивов Гриньяра.
а) из формальдегида получают первичные спирты

б) из других альдегидов получают вторичные спирты

в) из кетонов получают третичные спирты

4. Присоединение ацетиленидов (реакция Фаворского)


Механизм


6. Реакции присоединения-отщепления.
Альдегиды и кетоны взаимодействуют с различными соединениями, содержащими аминогруппу NH2-X, где Х= H, OH, NH2, NH-C6H5, NH-C(O)NH2, при этом нуклеофильное присоединение сопровождается отщеплением воды. Общая схема реакции:







б) Галоформное расщепление (изб. I2 (Cl2 или Br2), КОН (конц.)).
Качественная реакция на наличие ацетильного фрагмента в исходных соединениях.


б) кротоновая (в кислой среде при нагревании)


11.
R-CH=O
+ Ag2O
![]() R-COOH
+ 2Ag
(окисление, реакция "серебряного
зеркала")
R-COOH
+ 2Ag
(окисление, реакция "серебряного
зеркала")
R-CH=O + 2Cu(OH)2 R-COOH + Cu2O + 2H2O (красный осадок, окисление)

13. n СH2=O (-CH2-O-)n параформ n=8-12 (полимеризация)
