
- •Алканы Способы получения
- •Химические свойства
- •Алкены Способы получения
- •Химические свойства
- •Алкины Способы получения
- •Химические свойства
- •Сопряженные диены Способы получения
- •Химические свойства
- •Ароматические углеводороды Способы получения
- •Химические свойства
- •Химические свойства
- •Галогеноуглеводороды Способы получения
- •Химические свойства
- •Спирты Способы получения
- •Химические свойства
- •Многоатомные спирты
- •Методы получения
- •Химические свойства
- •Простые эфиры
- •Методы получения
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Альдегиды и кетоны
- •Способы получения
- •Химические свойства
- •Карбоновые кислоты и их производные Способы получения
- •Химические свойства
- •Одноосновные непредельные кислоты
- •Непредельные двухосновные кислоты
- •Методы получения
- •Амины Способы получения
- •Химические свойства
- •Аминокислоты Способы получения
- •Химические свойства
- •Углеводы. Моносахариды. Олигосахариды. Полисахариды. Способы получения
- •Моносахриды
Химические свойства

Реакции моногалогенопроизводных с металлами
1. Реакция Вюрца – синтез алканов.

2. Реакция Гриньяра – получение реактива Гриньяра.

Метилмагний бромид относится к металлоорганическим соединениям, в которых атом углерода связан с металлом.
Реакции элиминирования

Примеры реакций.

Спирты Способы получения
1. CH2=CH2 + H2O/H+ CH3-CH2OH (гидратация алкенов)
2.
CH3-CHO
+ H2
![]() C2H5OH
(восстановление альдегидов и кетонов)
C2H5OH
(восстановление альдегидов и кетонов)
3. C2H5Br + NaOH (водн.) C2H5OH + NaBr (гидролиз галогенопроизводных)
ClCH2–CH2Cl
+ 2NaOH (водн.)
HOCH2–CH2OH
+ 2NaCl
4.
СO + 2H2
![]() СH3OH
(получение метанола, промышленность)
СH3OH
(получение метанола, промышленность)
5.
C6H12O6
![]() 2C2H5OH
+ 2CO2
(брожение
моноз)
2C2H5OH
+ 2CO2
(брожение
моноз)
Химические свойства
Химические свойства спиртов связаны с наличием в их молекуле группы –ОН. Для спиртов характерны два типа реакций: разрыв связи С-О и связи О-Н.
1.2C2H5OH + 2Na H2 + 2C2H5ONa (образование алкоголятов металлов Na, K, Mg, Al)
2. а) C2H5OH + NaOH (в водном растворе не идет);
3. C2H5OH + CH3MgI C2H5OMgI + CH4 (взаимодействие с магнийгалогеналкилами)

Механизм

б) C2H5OH + H2SO4C2H5-O-SO3H + H2O (на холоду)
4. а) C2H5OH + HBrC2H5Br + H2O; б) C2H5OH + PCl5C2H5Cl + POCl3+ HCl;
в) C2H5OH + SOCl2 C2H5Cl + SO2 + HCl (замещение гидроксильной группы на галоген)
5. C2H5OH
+ HOC2H5
![]() C2H5-O-C2H5
+ H2O
(межмолекулярная дегидратация)
C2H5-O-C2H5
+ H2O
(межмолекулярная дегидратация)
6. C2H5OH
![]() CH2=СН2
+ H2O
(внутримолекулярная дегидратация)
CH2=СН2
+ H2O
(внутримолекулярная дегидратация)

7. а) СH3СН2OH CH3-CHO (дегидрирование, окисление первичных спиртов)

б) CH3-CH(OH)-CH3 CH3-CO-CH3 (дегидрирование, окисление вторичных спиртов)
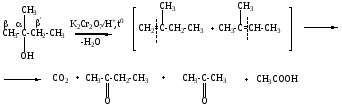
в) Третичные спирты окисляются K2Cr2O7/H2SO4; Na2Cr2O7/H2SO4 при нагревании до смеси
карбоновых кислот (кетонов) через образование алкенов.
Многоатомные спирты

Методы получения
1.3СH2=CH2 + 2KMnO4+ 4H2O 3CH2OH-CH2OH+ 2КОН+ 2MnO2 (окисление в мягких
этиленгиликоль условиях, реакция Вагнера)


Химические свойства
1. Многоатомные спирты более сильные кислоты, чем одноатомные спирты (большее количество гидроксильных групп, кроме того, они оказывают взаимное влияние друг на друга).
Гликоли и глицерины образуют алкоголяты, аналогично одноатомным спиртам. Отличительным свойством является образование соединений типа хелатов с ионами тяжелых металлов. С Cu(ОН)2 образуется раствор ярко-синего цвета (качественная реакция).


Реакция протекает с избытком реагентов.
3. Реакция с HCl, HBr.
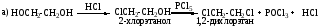

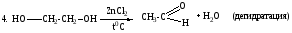


Простые эфиры
Простыми эфирами называются соединения, в которых алкильные группы связаны через атом кислорода R-O-R’.
Примеры соединений

Методы получения
1. C2H5OH
+ HOC2H5
![]() C2H5-O-C2H5
+ H2O
(межмолекулярная дегидратация)
C2H5-O-C2H5
+ H2O
(межмолекулярная дегидратация)
2. Реакция Вильямсона.


Химические свойства
Простые эфиры обладают ограниченной реакционной способностью, поэтому их часто используют в качестве инертных растворителей. Химические свойства простых эфиров обусловлены наличием неподеленной пары электронов у атома кислорода. За счет атома кислорода простые эфиры способны проявлять основные свойства. Связь С-О является довольно прочной и для расщепления требуются жесткие условия.
Простые эфиры растворяются в холодной концентрированной серной и соляной кислотах. Протон кислоты присоединяется к кислороду эфира за счет неподеленной пары электронов.



В случае метилалкилэфиров всегда образуются бромистые и йодистые метилы.

Простые эфиры при стоянии на свету образуют взрывоопасные пероксиды.

Фенолы
Фенолами называются производные аренов, в которых один или несколько атомов водорода ароматического кольца замещены на гидроксильные группы. По числу гидроксильных групп в ароматическом кольце различают одно- и многоатомные (двух- и трехатомные) фенолы. Для большинства фенолов используются тривиальные названия. Структурная изомерия фенолов связана с различным положением гидроксильных групп.

