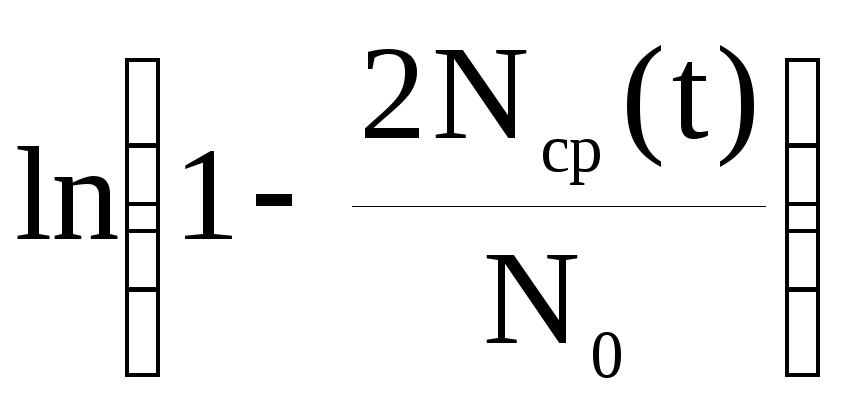- •Федеральное агентство по образованию
- •Раздел 2. Указания по выполнению лабораторных работ и индивидуальных расчетно-графических заданий
- •Раздел 3. Инструкции по выполнению лабораторных работ и индивидуальных расчетно-графических заданий
- •Вопросы и задания для самоконтроля.
- •Вопросы и задания для самоконтроля.
- •Вопросы и задания для самоконтроля
- •Вопросы и задания для самоконтроля
- •Вопросы и задания для самоконтроля
- •Вопросы и задания для самоконтроля
Вопросы и задания для самоконтроля
Перечислите все известные агрегатные состояния вещества.
Что такое физический газ?
Что такое идеальный газ?
При каких условиях физический газ можно описывать моделью идеальный газ?
Что такое уравнение состояния?
Как выглядит уравнение состояния идеального газа? Каково его второе название?
Что такое газ Ван-дер-Ваальса?
Как выглядит уравнение состояния газа Ван-дер-Ваальса? Каково его второе название?
Что такое константы Ван-дер-Ваальса?
Что определяет первая константа Ван-дер-Ваальса?
Что определяет вторая константа Ван-дер-Ваальса?
Что такое изотерма?
Что такое критическая изотерма?
Каковы особенности поведения газа при температуре, выше критической?
Каковы особенности поведения газа при температуре, ниже критической?
На каких участках изотермы ВдВ примерно совпадают с изотермами реального газа?
Самая низкая температура на Земле Т = –89С, а самая высокая – Т = 58С. Если наполнить сосуд воздухом при самой низкой температуре и стандартном давлении, герметически закрыть его и перевезти в область самой высокой температуры, то какое давление будет в сосуде? (Расчет производить по уравнению идеального газа).
Определить, какой объем будет занимать 1 моль идеального газа при комнатной температуре (25 С) и нормальном атмосферном давлении.
Образец газообразного кислорода массой 0,182 г при температуре 25 С создает в сосуде давление 1,5 атм. Какое количество кислорода потребуется, чтобы в этом же сосуде при 100С создать давление 17,2 атм.
Масса 1 л газа при н.у. равна 1,25 г. Вычислить массу одной молекулы газа.
ЛАБОРАТОРНАЯ РАБОТА И ИРГЗ № 4
ДИФФУЗИЯ В ГАЗАХ
ЦЕЛЬ РАБОТЫ:
Знакомство с компьютерной моделью, описывающей диффузию молекул идеального газа
Экспериментальное подтверждение закона диффузии.
Определение средней скорости теплового движения частиц.
Ознакомьтесь с теорией в конспекте и учебнике: Савельев, Физика, т.1, §128, §130.
Запустите программу «Открытая химия». Выберите модель 4.11. «Диффузия газов». Прочитайте краткие теоретические сведения. Необходимое запишите в свой конспект.
КРАТКАЯ ТЕОРИЯ:
1. При нарушении равновесия макросистема стремится вернуться в равновесное состояние. ЯВЛЕНИЯМИ ПЕРЕНОСА называются процессы, связанные с возникновением в веществе НАПРАВЛЕННОГО ПЕРЕНОСА (потока) массы, импульса или внутренней энергии.
ДИФФУЗИЯ есть процесс установления внутри фаз вещества равновесного распределения концентраций, который обеспечивается направленным переносом массы этого вещества. Диффузия обусловлена тепловым движением молекул и проявляется в самопроизвольном выравнивании концентраций в смеси нескольких веществ.
САМОДИФФУЗИЯ имеет место при самопроизвольном выравнивании концентрации однородного вещества, если по некоторым причинам равновесное распределение концентрации было нарушено.
ДЛИНА СВОБОДНОГО ПРОБЕГА есть среднее расстояние, пролетаемое частицей между двумя последовательными столкновениями:
![]() , (1)
, (1)
где n = N/V – число молекул газа в единице объема, σ – Эффективный диаметр частицы, т.е. минимальное расстояние, на которое сближаются центры двух сталкивающихся частиц.
Е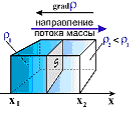 сли
в начальный момент времени имеет место
неоднородное распределение плотности
вещества
вдоль только одной оси (например, ОХ),
тогда возникает одномерная
диффузия,
связанная с переносом массы М вдоль
этой оси ОХ (см. рис. 1).
сли
в начальный момент времени имеет место
неоднородное распределение плотности
вещества
вдоль только одной оси (например, ОХ),
тогда возникает одномерная
диффузия,
связанная с переносом массы М вдоль
этой оси ОХ (см. рис. 1).
Для двухкомпонентной системы (например, смеси двух газов) одномерная диффузия описывается первым законом Фика:
![]() (2)
(2)
Рис. 1. Градиент плотности вещества по оси ОХ.
где
dm
– масса одного компонента (индексы для
характеристик данного компонента
пропущены), которая переносится за время
dt
через элементарную площадку,
перпендикулярную оси ОХ, имеющую площадь
dS,
в направлении убывания плотности этого
компонента,
![]() градиент плотности первого компонента,D
– коэффициент диффузии, который
определяет количество вещества,
проходящего в единицу времени через
участок единичной площади (при градиенте
плотности равном 1), знак "минус"
указывает на направление потока массы
от больших концентраций к меньшим.
градиент плотности первого компонента,D
– коэффициент диффузии, который
определяет количество вещества,
проходящего в единицу времени через
участок единичной площади (при градиенте
плотности равном 1), знак "минус"
указывает на направление потока массы
от больших концентраций к меньшим.
Для
смеси «красных» и «зеленых» частиц,
имеющих одинаковую массу m
каждой частицы, dm
= m·dN,
= m
![]() ,
а
,
а
![]() ,
гдеdN
– количество частиц, проходящих через
dS
за время dt,
которое равно
,
гдеdN
– количество частиц, проходящих через
dS
за время dt,
которое равно
![]() ,
где разность числа частиц в левом и
правом сосудахN
= N2 -
N1,
N2 =
N0 -
N(t), N1 =
N(t), X
= Lотв,
объем сосуда V = 20 cм3,
dS
– площадь отверстия. Решаем уравнение
методом разделения переменных:
,
где разность числа частиц в левом и
правом сосудахN
= N2 -
N1,
N2 =
N0 -
N(t), N1 =
N(t), X
= Lотв,
объем сосуда V = 20 cм3,
dS
– площадь отверстия. Решаем уравнение
методом разделения переменных:
![]() .
.
Интегрируем слева от 0 до N(t), а справа – от 0 до t и получаем зависимость числа частиц от времени диффузии:
![]() или
или
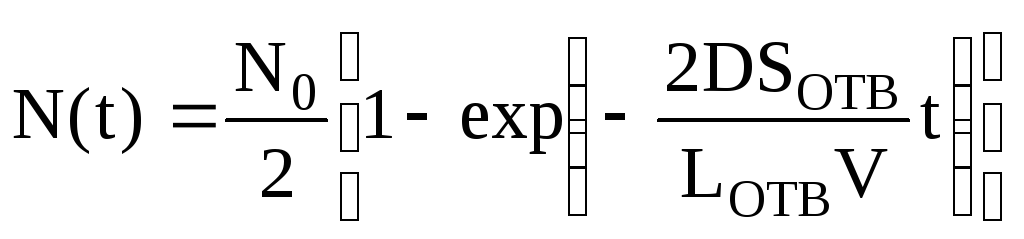 ,
(3).
,
(3).
2.
ЗАКОН ДИФФУЗИИ ГРЭМА: скорость диффузии
газа обратно пропорциональна квадратному
корню из его плотности (молярной массы).
Скорость диффузии газов можно сопоставить,
измеряя время, необходимое чтобы
одинаковый объем газа при одинаковых
условиях продиффундировал через пористую
поверхность. Тогда времена диффузии
двух газов соотносятся между собой как
![]() ,
т.е. легкие газы диффундируют быстрее
тяжелых.
,
т.е. легкие газы диффундируют быстрее
тяжелых.
Процессы переноса приводят к выравниванию концентраций газов, в результате образуется равновесная газовая смесь, в которой потоки массы и энергии отсутствуют. Количественный состав газовой смеси можно охарактеризовать, указав для каждого компонента его массовую i, объемную i, мольную Xi доли или молярную концентрацию Ci. МОЛЯРНАЯ КОНЦЕНТРАЦИЯ – отношение количества молей данного вещества к общему объему смеси. Ci = ni / V. Единица измерения моль/л или М. Образующаяся смесь газов подчиняется тем же газовым законам, что и индивидуальные газы. МОЛЯРНАЯ МАССА СМЕСИ складывается из молярных масс ее компонентов с учетом их процентного содержания: Мсм = i Mi , где Mi – молярная масса компонента, а i – его объемная доля.
Для смеси газов, не вступающих в химическое взаимодействие, справедлив ЗАКОН ДАЛЬТОНА: общее давление смеси газов равно сумме парциальных давлений ее компонентов Р = рi.. ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ рi – давление, которое производил бы газ, если бы он один занимал весь объем смеси.

Рис. 2.
На рис. 2 изображена компьютерная модель смешивающихся газов. В этой модели представлены 2 системы частиц, которые в начальный момент находятся в левом (красные) и в правом (зеленые) объемах. Частицы абсолютно упруго сталкиваются друг с другом и со стенками сосуда. Количество частиц N0 каждого вида равно 100, и данная система является хорошей “механической” моделью идеального газа. Количество частиц подсчитывается автоматически и высвечивается над соответствующими столбиками.
МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ:
1. Нажать кнопку «Сброс» и выставить с помощью регулятора значение диаметра трубки d, соединяющей два сосуда с газами, которое указано в таблице 1 для вашего компьютера.
ТАБЛИЦА 1. (не перерисовывать)
Значения диаметров соединительной трубки, длительности промежутка измерения и вида частиц
|
Номер компьютера/ Номер в списке группы |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
d1, мм |
10 |
12 |
14 |
16 |
10 |
12 |
14 |
16 |
|
d2, мм |
20 |
22 |
24 |
26 |
20 |
22 |
24 |
26 |
|
t, с |
15 |
15 |
15 |
15 |
10 |
10 |
10 |
10 |
|
Сорт |
красн |
зелен |
красн |
зелен |
зелен |
красн |
зелен |
красн |
|
Объем |
справа |
слева |
справа |
слева |
слева |
справа |
слева |
справа |
|
Номер компьютера/ Номер в списке группы |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
d1, мм |
14 |
16 |
18 |
20 |
14 |
16 |
18 |
|
|
d2, мм |
22 |
24 |
26 |
28 |
30 |
32 |
34 |
|
|
t, с |
15 |
15 |
15 |
10 |
10 |
10 |
10 |
|
|
Сорт |
красн |
зелен |
красн |
зелен |
зелен |
красн |
зелен |
|
|
Объем |
справа |
слева |
справа |
слева |
слева |
справа |
слева |
|
2. Нажмите кнопку «СТАРТ» и через t секунд после начала процесса запишите в табл. 2 количество выбранных частиц в той области, за которой проводится наблюдение. Повторите это измерение через 2t секунд, через 3t секунд, и т.д., всего 10 раз. По окончании снова нажмите кнопку «Сброс» и еще 2 раза повторите аналогичные измерения, занося результаты в таблицу.
3. Закончив измерения с данным диаметром трубки, нажмите кнопку «Сброс», установите второе значение диаметра соединительной трубки d2 из таблицы 1 и 3 раза проделайте измерения, записывая результаты в таблицу 3.
ТАБЛИЦЫ 2, 3. Результаты измерений и расчетов.
Изменение числа частиц от времени диффузии (d = мм).
|
t, с |
t |
2t |
3t |
4t |
5t |
6t |
7t |
8t |
9t |
10t |
|
N (t) (1 опыт) |
|
|
|
|
|
|
|
|
|
|
|
N (t) (2 опыт) |
|
|
|
|
|
|
|
|
|
|
|
N (t) (3 опыт) |
|
|
|
|
|
|
|
|
|
|
|
Nср (t) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
ОБРАБОТКА РЕЗУЛЬТАТОВ:
Вычислите и запишите в таблицы все указанные значения.
Постройте на одном рисунке графики экспериментальных зависимостей
-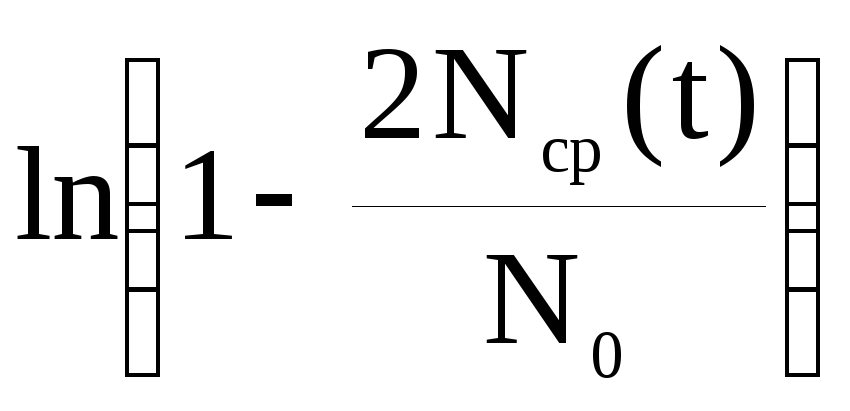 =f(t)
и, из тангенса угла наклона полученных
зависимостей или используя формулу D =
=f(t)
и, из тангенса угла наклона полученных
зависимостей или используя формулу D =
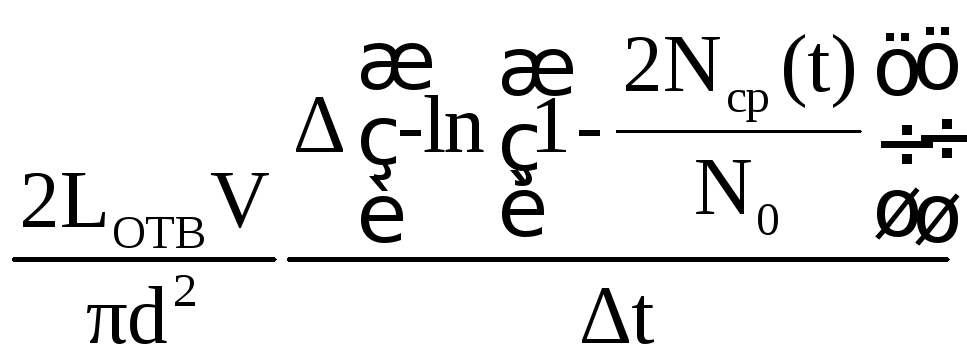 (по данным табл. 2 и 3), определите
коэффициенты диффузии для каждого
отверстия. Длину отверстия Lотв
измерьте линейкой на экране монитора,
объем сосуда считать равным V = 20 см3.
(по данным табл. 2 и 3), определите
коэффициенты диффузии для каждого
отверстия. Длину отверстия Lотв
измерьте линейкой на экране монитора,
объем сосуда считать равным V = 20 см3.
Найдите среднее значение коэффициента диффузии.
Используя соотношение
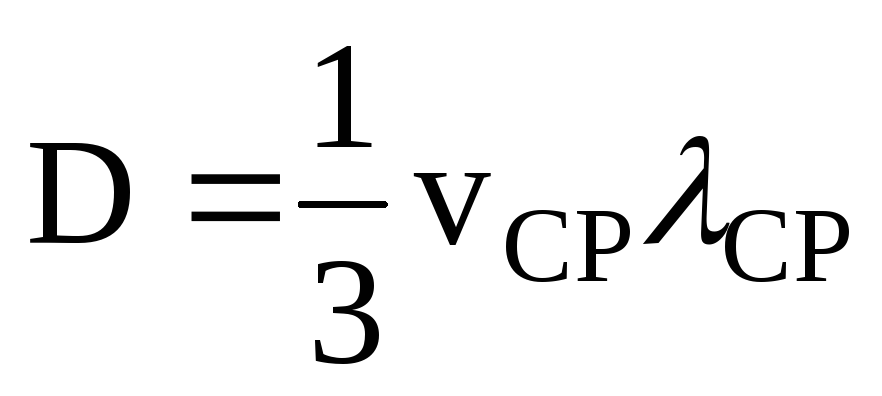 ,
найдите среднюю скорость теплового
движения частиц vср
(приняв, что средняя длина свободного
пробега составляет ср
= 0,2 мкм).
,
найдите среднюю скорость теплового
движения частиц vср
(приняв, что средняя длина свободного
пробега составляет ср
= 0,2 мкм).Исходя из значения vср, по формуле
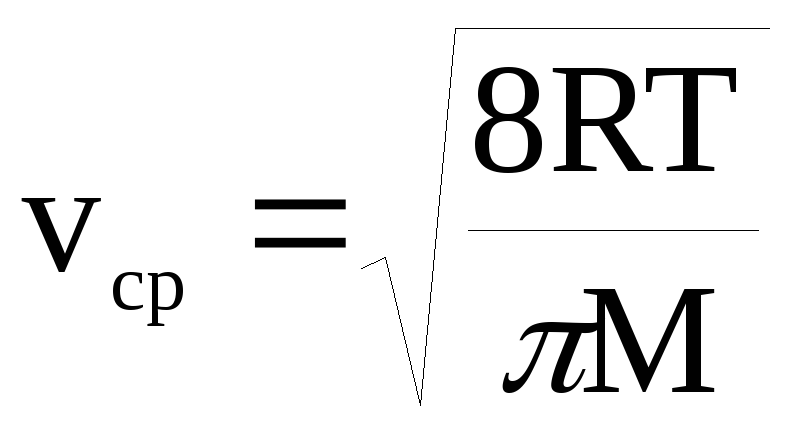 ,
гдеR
– универсальная газовая постоянная,
T
– абсолютная температура, M
– молярная масса газа, рассчитайте
массу одной молекулы газа при н.у.
,
гдеR
– универсальная газовая постоянная,
T
– абсолютная температура, M
– молярная масса газа, рассчитайте
массу одной молекулы газа при н.у.
СПРАВОЧНЫЕ ДАННЫЕ:
Значение коэффициента диффузии D (при атмосферном давлении)
|
Диффундирующее вещество |
Основной компонент |
Температура, °С |
Коэффициент диффузии, м2/сек |
|
Водород (газ) |
Кислород (газ) |
0 |
7·10-5 |
|
Пары воды |
Воздух |
0 |
2,3·10-5 |
|
Соль (NaCI) |
Вода |
20 |
1,1·10-9 |
|
Сахар |
Вода |
20 |
0,3·10-9 |
|
Золото (тв.) |
Свинец (тв.) |
20 |
4·10-14 |