- •Федеральное агентство по образованию
- •Раздел 2. Указания по выполнению лабораторных работ и индивидуальных расчетно-графических заданий
- •Раздел 3. Инструкции по выполнению лабораторных работ и индивидуальных расчетно-графических заданий
- •Вопросы и задания для самоконтроля.
- •Вопросы и задания для самоконтроля.
- •Вопросы и задания для самоконтроля
- •Вопросы и задания для самоконтроля
- •Вопросы и задания для самоконтроля
- •Вопросы и задания для самоконтроля
Вопросы и задания для самоконтроля.
Что такое спектр электромагнитного излучения (ЭМИ)?
Что такое линейчатый спектр ЭМИ?
Что является источником линейчатого спектра ЭМИ?
Что такое полосатый спектр ЭМИ и что является его источником?
При каких условиях излучается сплошной спектр ЭМИ?
Опишите планетарную модель атома.
При каких условиях электроны в атоме излучают или поглощают ЭМИ?
Как связаны друг с другом характеристики фотона и электрона, который излучает данный фотон?
В чем отличия планетарной и квантовой моделей атома?
Какое уравнение используется для анализа квантовой модели атома?
Что является решением этого уравнения?
Как описывается электрон и его движение в квантовой модели атома?
Что определяет квадрат модуля волновой функции?
Дайте определение орбитали электрона в атоме.
Что определяет главное квантовое число?
Что определяет азимутальное квантовое число?
Что определяет магнитное квантовое число?
Что такое спин электрона?
Что определяет спиновое квантовое число?
Что такое вырожденные состояния?
Как определить кратность вырождения состояния?
Расшифруйте краткую запись состояния электрона в атоме (2s2, 2p3).
Может ли электрон иметь состояние 2d и почему?
Сформулируйте правило отбора.
Что такое спектральная серия?
Назовите названия спектральных серий излучения атомарного водорода. Запишите условия для их возникновения.
Почему в спектре атома водорода наблюдается быстрое сближение отдельных спектральных линий при подходе к границе спектральной серии?
В серии Бальмера есть линия с длиной волны λ = 6,562·10-7 м. Рассчитайте, какому переходу в атоме водорода она соответствует.
Какому из следующих переходов в атоме водорода соответствует фотон с меньшей энергией: 12, 23, 24, 14?
При каком значении главного квантового числа радиус орбиты электрона в атоме водорода превысит 0,1 мм?
ЛАБОРАТОРНАЯ РАБОТАИ ИРГЗ № 3
УРАВНЕНИЕ СОСТОЯНИЯ ГАЗА ВАН-ДЕР-ВААЛЬСа
ЦЕЛЬ РАБОТЫ:
Знакомство с компьютерной моделью, описывающей вещество в газообразном состоянии и его переход в жидкое состояние.
Экспериментальное подтверждение закономерностей поведения реального газа.
Ознакомьтесь с теорией в учебнике: Савельев, Физика, т.1, §91, §123, §124.
Запустите программу «Открытая химия». Выберите модель 4.9. «Реальный газ». Прочитайте краткие теоретические сведения. Необходимое запишите в свой конспект.
КРАТКАЯ ТЕОРИЯ:
1. ФИЗИЧЕСКИМ газом называется вещество, находящееся в газообразном состоянии.
«идеальный газ» это название модели, описывающей физический газ, находящийся в разреженном состоянии (при давлениях, не намного больше атмосферного и достаточно высоких температурах). Уравнением, связывающим параметры состояния идеального газа, является уравнение Менделеева-Клапейрона. Поэтому оно имеет второе название: уравнение состояния идеального газа:
pV = nRT, (1)
где
p
– давление газа, V
– объем газа, n
– количество молей, R
– универсальная газовая постоянная, T
– абсолютная температура газа. Для
такого газа отношение pV/RT
при любых условиях – величина постоянная.
Для реальных газов при высоких давлениях
это н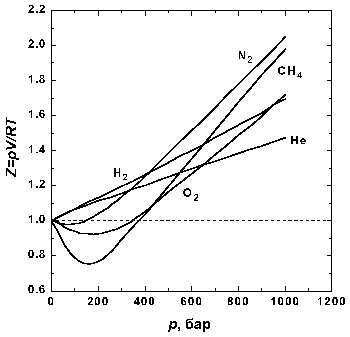 е
выполняется (см. рис. 1).
е
выполняется (см. рис. 1).
Более точная модель физического (реального) газа была предложена голландским физиком Иоханесом Ван-дер-Ваальсом. Она также является приближенной, но лучше описывает процессы, нежели модель «идеального газа». Иногда эту модель называют «реальный газ». Газом Ван-дер-ваальса (ВдВ) называется воображаемый газ (модель), параметры состояния которого точно Рис. 1. Идеальный и реальные газы. подчиняются уравнению:
![]() ,
(2).
,
(2).
Оно называется УРАВНЕНИЕМ ВАН-ДЕР-ВААЛЬСА. Здесь a и b – константы Ван-дер-Ваальса. Добавка к внешнему давлению а обусловлена взаимным притяжением частиц друг к другу. Поправка к объему b характеризует ту часть объема, которая недоступна для движения частиц. Она равна нескольким суммарным объемам молекул, содержащихся в газе.
ИЗОТЕРМОЙ называется зависимость давления от объема данного (фиксированного) количества вещества при постоянной температуре.
|
Рис.2 |
Рис.3 |
Рис.4 |
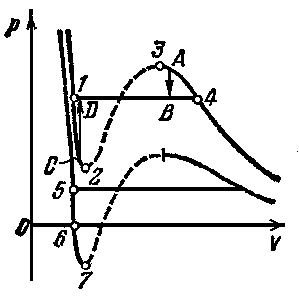
На рис. 2 приведены изотермы некоторого физического (реального) газа, а на рис. 3 и рис. 4 – изотермы ВдВ газа.
Изотерма ВдВ газа, имеющая только точку перегиба и не имеющая экстремумов, называется критической. Температура критической изотермы называется критической температурой. Объем и давление в критической точке (точка К на графиках) также называются КРИТИЧЕСКИМИ.
УРАВНЕНИЯ ДЛЯ КРИТИЧЕСКИХ ПАРАМЕТРОВ:
VКР
= 3b,
pКР
=
![]() ,
TКР
=
,
TКР
=
![]() ,
(3).
,
(3).
Отсюда
А
=
![]() n
= 0.375·n, (4).
n
= 0.375·n, (4).
При температуре выше критической вещество может находиться только в газообразном состоянии. При температуре ниже критической вещество может находиться как в газообразном, так и в жидком состоянии.
Жидкое состояние описывается левыми (по отношению к точке перегиба) частями графиков на рисунках и характеризуется тем, что небольшое уменьшение объема вещества может произойти только при резком увеличении давления (жидкость практически несжимаема).
Изотермы ВдВ примерно совпадают с изотермами реального газа на участках, соответствующих однофазным состояниям вещества.
Рис. 4 разъясняет поведение вещества при разных внешних условиях. В области, где присутствуют 2 фазы (1-2-3-4) S-образный завиток изотермы ВдВ заменяется горизонтальным участком (1-4) реальной изотермы.
НЕРЕАЛИЗУЕМОЕ
СОСТОЯНИЕ соответствует участку 2-3, на
котором сжимаемость
![]() вещества была бы отрицательна, что
невозможно.
вещества была бы отрицательна, что
невозможно.
ПЕРЕОХЛАЖДЕННЫЙ ПАР на участке 3-4 реализуется при определенных условиях (при практическом отсутствии центров конденсации и внешних воздействий).
ПЕРЕГРЕТАЯ ЖИДКОСТЬ на участке 1-2 реализуется при отсутствии примесей, способных быть центрами кипения.
На рис. 5 приведена компьютерная модель газа под поршнем.
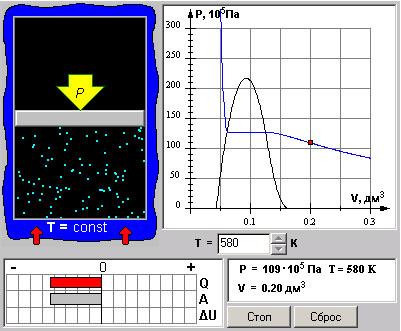
Рис. 5.
МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ
ЭКСПЕРИМЕНТ 1. ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ПАРАМЕТРОВ.
Подведите маркер мыши к регулятору температуры и, удерживая левую кнопку мыши в нажатом состоянии, повышайте температуру до тех пор, пока на правом экране не появится критическая изотерма с точкой перегиба и без экстремумов.
Запишите в свой конспект значения параметров, отвечающих критической точке: ТКР, VКР, pКР, определенные по графику изотермы.
ЭКСПЕРИМЕНТ 2. ИССЛЕДОВАНИЕ ИЗОТЕРМ ГАЗА ВдВ.
1.Установите значение температуры Т1, указанное в таблице 1 для вашего компьютера. Нажмите мышью кнопку «СТАРТ» на экране и наблюдайте перемещение поршня на левой картинке модели и перемещение точки, отражающей состояние газа, по красной кривой теоретической изотермы.
ТАБЛИЦА 1. (не перерисовывать)
Значения температуры (К)
|
Номер компьютера/ Номер в списке группы |
1, 9 |
2, 10 |
3, 11 |
4, 12 |
5, 13 |
6, 14 |
7, 15 |
8 |
|
Т1 |
560 |
565 |
570 |
575 |
580 |
585 |
590 |
595 |
|
Т2 |
600 |
605 |
610 |
615 |
620 |
625 |
630 |
635 |
|
Т3 |
660 |
665 |
670 |
675 |
660 |
665 |
670 |
675 |
|
Т4 |
685 |
690 |
695 |
700 |
685 |
690 |
695 |
700 |
2. Останавливайте процесс, нажимая кнопку «Стоп», когда точка на теоретической изотерме будет находиться вблизи следующих значений объема: 0,1; 0,12; 0,14; 0,16; 0,18; 0,2; 0,22; 0,24; 0,26 и 0,28 дм3 (10 значений). Полученные в момент остановки значения давления и объема последовательно занесите в таблицу 2. Запустить процесс далее после остановки можно, нажав кнопку «Старт».
3. Установив новое значение температуры Т из таблицы 1, повторите измерения, записывая результаты в табл. 3, 4, 5.
ТАБЛИЦЫ 2, 3, 4, 5.
Результаты измерений при Т = ____ К
|
V, м3 |
|
|
|
|
|
|
|
|
|
|
|
p, Па |
|
|
|
|
|
|
|
|
|
|
|
1/V, м-3 |
|
|
|
|
|
|
|
|
|
|
ОБРАБОТКА РЕЗУЛЬТАТОВ:
По измеренным значениям критических параметров вычислите константы a, b и А.
Постройте на одном графике экспериментальные зависимости давления газа от обратного объема для всех изотермических процессов (указав на них температуры).
Для каждой изотермы рассчитайте значение количества вещества в газовой фазе n, определив тангенс угла наклона прямолинейного отрезка полученной зависимости, или рассчитав по формуле
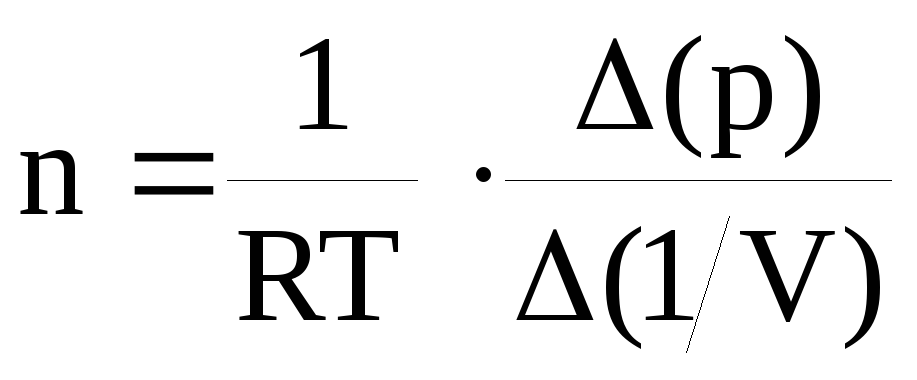 (по данным табл. 2-5).
(по данным табл. 2-5).Вычислите среднее значение n и величину константы А’ по формуле А’ = 0,375·n . Запишите ответ для А’ и проанализируйте ответы и графики. В выводах сравните значение А’, полученное по изотермам, с А, полученным через критические параметры.
СПРАВОЧНЫЕ ДАННЫЕ:
Универсальная газовая постоянная R = 8,31 Дж / мольК.
1 атм =1,01·105 Па; Т(К) = t(°C) +273.
Нормальные условия: р = 1 атм, Т = 273 К.