
- •Федеральное агентство по образованию
- •Раздел 2. Указания по выполнению лабораторных работ
- •2.1 Методика выполнения лабораторной работы
- •2.2 Требования к оформлению отчета по лабораторной работе
- •Раздел 3.
- •3.1 Механика лабораторная работа № 1_1. Движение с постоянным ускорением
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 1_2 движение под действием постоянной силы
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 1_4 упругие и неупругие удары
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 1_5 соударения упругих шаров
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 1.6 проверка закона сохранения механической энергии
- •Вопросы и задания для самоконтроля
- •3.2 Механические колебания и волны лабораторная работа № 1_3 механические колебания
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 1.8 изучение собственных колебаний струны
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 1.9 изучение основных свойств механических волн
- •Вопросы и задания для самоконтроля
- •3.3 Электромагнетизм, оптика и квантовая физика лабораторная работа № 2.13 исследование зависимости мощности и к.П.Д. Источника постоянного тока от внешней нагрузки
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 2.14 теорема остроградского гаусса для электростатического поля в вакууме
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 2.15 закон ома для неодноодного участка цепи
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 2.16 определение удельного заряда частицы методом отклонения в магнитном поле
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 2.17 переходные процессы в цепях постоянного тока с конденсатором
- •Вопросы и задания для самоконтроля
- •Лабораторная работа 2.10 моделирование оптических систем
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 2.11 изучение дифракции фраунгофера от одной щели
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 2.12 определение радиуса кривизны линзы с помощью колец ньютона
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 3.5 определение периода кристаллической решётки методом дифракции электронов
- •Вопросы и задания для самоконтроля
- •3.4 Термодинамика и молекулярная физика лабораторная работа № 4.5 цикл карно
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 4.6 изучение статистических закономерностей в идеальном газе
- •Вопросы и задания для самоконтроля
- •Лабораторная работа № 4.7 политропический процесс
- •Вопросы и задания для самоконтроля
Вопросы и задания для самоконтроля
Перечислите основные положения молекулярно- кинетической теории идеального газа.
Чем обусловлено давление газа с точки зрения молекулярно-кинетической теории?
Зависит ли давление газа: а) от плотности газа; б) от температуры; в) от массы молекул?
Как изменяются при изотермическом расширении идеального газа: а) средняя кинетическая энергия молекул; б) средняя длина свободного пробега молекул?
Как изменяется средняя длина свободного пробега молекул газа: а) при изобарном нагревании; б) при изотермическом увеличении давления?
Что называется эффективным диаметром молекулы?
Выведите уравнение, связывающее давление идеального газа со средней кинетической энергией его молекул.
Сравните изменения числа ударов молекул о стенку сосуда в единицу времени при уменьшении объёма идеального газа в изотермическом и адиабатическом процессах.
Как изменяется эффективный диаметр молекулы при увеличении температуры?
Как сказывается ограниченное число молекул, участвующих в тепловом движении в компьютерной модели опыта, на его результатах?
Лабораторная работа № 4.7 политропический процесс
Ознакомьтесь с теорией в конспекте и в учебниках 1. Трофимова Т.И. Курс физики. Гл.9, §55. 2. Детлаф А.А., Яворский Б.М. Курс физики. Гл.9, §9.6. Выберите «Термодинамика и молекулярная физика» и «Работа газа». Нажмите кнопку с изображением страницы во внутреннем окне. Прочитайте теорию и запишите основные сведения в свой конспект лабораторной работы. Закройте окно теории, нажав кнопку с крестом в правом верхнем углу внутреннего окна.
ЦЕЛЬ РАБОТЫ:
Ознакомление с основами анализа и моделирования термодинамических процессов в идеальных газах.
Определение молярной теплоёмкости в политропических процессах идеального газа.
Определение показателя адиабаты и работы газа в политропическом процессе.
КРАТКАЯ ТЕОРИЯ:
ПОЛИТРОПНЫМ называется процесс, в котором молярная теплоёмкость Состаётся постоянной. Уравнение политропического процесса имеет вид:
рV n = const , (1)
где
n=![]() . (2)
. (2)
МОЛЯРНОЙ ТЕПЛОЁМКОСТЬЮ
называется физическая величина С,
численно равная теплоте
![]() ,
которую нужно сообщить одному молю
вещества для изменения его температуры
на 1К в рассматриваемом термодинамическом
процессе:
,
которую нужно сообщить одному молю
вещества для изменения его температуры
на 1К в рассматриваемом термодинамическом
процессе:
С =
![]() ,
(3)
,
(3)
где M- молярная масса,m- масса газа.
Выражение (3) теперь можно записать в форме
![]() .
(4)
.
(4)
или в интегральной
форме
![]() .
.
Таким образом, если
количество тепла, полученное в некотором
термодинамическом процессе 12
приm=const,
прямо пропорционально разности температур![]() ,
то теплоёмкость газа постоянна и процесс
является политропическим,
,
то теплоёмкость газа постоянна и процесс
является политропическим,
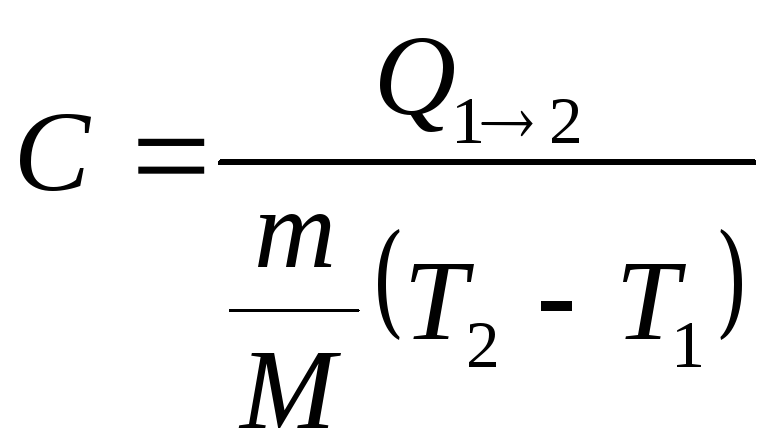 .
.
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ для любогоравновесного процесса изменения состояния идеального газа имеет вид
![]() .
(5)
.
(5)
Тогда из
уравнения (5) имеем: C=Cv+![]() .
(6)
.
(6)
Связь между объёмом газа и его температурой в политропном процессе можно найти из выражения (1) и уравнения Клапейрона – Менделеева
![]() :
:
![]() .
.
Дифференцируя последнее выражение, получим:
![]() ,
,
![]() .
.
Тогда уравнение (6) примет вид:
 .
.
Учитывая, что
![]() ,
где
,
где![]() показатель
адиабаты, получим:
показатель
адиабаты, получим:
![]() .
.
или
![]() .
(7)
.
(7)
Таким образом, если термодинамический процесс идеального газа действительно является политропным, т.е. молярная теплоёмкость в ходе процесса не изменяется, то её величина рассчитывается по формуле (7).
В настоящей работе используется модель одноатомного газа (i=3), поэтому в политропных процессах приn=1 согласно выражению (7) молярная теплоёмкостьСдолжна быть равна 16,6 Дж/мольК, а приn=2,C= 15,2 Дж/мольК.
Частными случаями политропного процесса являются:
изотермический: n=1,C=;
изобарический: n=0,C=Cp;
изохорический: n=,С = Сv;
4) адиабатический: n=, где=
![]() ,
С = 0.
,
С = 0.
МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ:

В прямоугольном окошке «Функция» нажмите маркером мыши кнопку «Прямая».
Подведите маркер мыши к выделенной левой точке графика р = f(V) на экране монитора, нажмите левую кнопку мыши, и, удерживая её в нажатом состоянии, переместите начало графика в точку с координатами (Р1,V1,Т1), взятыми из таблицы 1 для вашей бригады.
Аналогичным образом переместите выделенную крайнюю правую точку графика в точку с координатами (Р20,V20).
На мониторе щёлкните мышью кнопкув верхнем ряду кнопок, а в
нижней части экрана кнопку «СТАРТ».
Н ажмите
два раза кнопкув верхнем ряду кнопок и запишите в первый
столбец таблицы 2 значения
ажмите
два раза кнопкув верхнем ряду кнопок и запишите в первый
столбец таблицы 2 значения![]() Qи Т.
Qи Т.
Последовательно повторяя действия п.5 20 раз, заполните таблицу 2.
В прямоугольном окошке «Функция» нажмите маркером мыши кнопку «Парабола», проделайте измерения п.п. 2-6 и запишите результаты опытов в табл.3.
В прямоугольном окошке «Функция» нажмите маркером мыши кнопку «Экспонента», проделайте измерения п.п. 2-6 и запишите результаты опытов в табл.4.
ТАБЛИЦА 1.Начальные и конечные параметры для трёх термодинамических процессов
|
Бригада |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Р1, кПа |
100 |
90 |
80 |
70 |
60 |
50 |
40 |
30 |
|
Р20, кПа |
300 |
290 |
280 |
270 |
260 |
250 |
240 |
230 |
|
V1, дм3 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
10 |
|
V20, дм3 |
50 |
50 |
50 |
50 |
50 |
50 |
50 |
50 |
|
Т1, К |
124 |
111 |
99 |
86 |
74 |
62 |
49 |
37 |
ТАБЛИЦЫ 2,3,4.Результаты измерений температуры и количества выделения тепла в ходе термодинамического процесса расширения газа
Табл.2, функция «прямая»
Табл.3, функция «парабола»
Табл.4, функция «экспонента»
|
№ опыта (i) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Ti |
|
|
|
|
|
|
|
|
|
|
|
Ti-T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ опыта (i) |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
Ti |
|
|
|
|
|
|
|
|
|
|
|
Ti-T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОБРАБОТКА РЕЗУЛЬТАТОВ И ОФОРМЛЕНИЕ ОТЧЁТА
1.Вычислите и запишите во вторую строку таблиц 2, 3, 4 разности температур TiT1.
3. На миллиметровой
бумаге или на листе в клетку формата А4
постройте по экспериментальным точкам
графики в виде линейной зависимости
![]() от разности температурTiT1для трёх исследуемых процессов. (Каждый
график на отдельном листе!).
от разности температурTiT1для трёх исследуемых процессов. (Каждый
график на отдельном листе!).
4. По тангенсу угла
наклона прямой линии графика к оси
разности температур, используя формулу
 ,
определите молярную теплоёмкость
политропического процесса и сравните
её с теоретическим значением, рассчитанным
по формуле (7).
,
определите молярную теплоёмкость
политропического процесса и сравните
её с теоретическим значением, рассчитанным
по формуле (7).
5. Рссчитайте работу газа в этих процессах по формуле
![]()
![]()
![]()
и сравните эти значения со значениями, указанными в нижнем окне монитора при p20иV20.
Проанализируйте полученные результаты , сделайте оценку погрешности измерений.
