
Тема: Метод молекулярных орбиталей как линейная комбинация атомных комбинаций.
План:
Метод молекулярных орбиталей как линейная комбинация атомных комбинаций.
Метод молекулярных орбиталей (МО) является одним из наиболее распространенных сегодня методов вычислительной квантовой химии и образует основу многих модельных представлений современной химии. Мы остановимся на основных положениях метода МО, начиная со способа представления молекулярных орбиталей для гомоядерных двухатомных молекул, и объясним, за счет каких электронов в них образуется химическая связь. Рассмотрим в рамках простейшего метода МО — метода Хюккеля построение МО в сопряженных непредельных углеводородах, а затем, не касаясь идеологии расчетных схем строгих неэмпирических методов, обсудим результаты расчетов некоторых молекул.
В методе МО предполагают, что в молекуле, как и в атоме, можно построить набор разрешенных дискретных энергетических уровней и соответствующих им волновых функций (молекулярных орбиталей), описывающих поведение электрона в молекуле. На каждом энергетическом уровне может располагаться не более двух электронов. Для построения волновых функций МО часто используют атомные орбитали (АО), описывая каждую МО ψi, как линейную комбинацию АО φk(МО ЛКАО):
Выбор такого представления МО физически достаточно понятен: вблизи каждого ядра в молекуле поведение электрона должно быть похожим на его поведение в атоме и описываться соответствующими данному атому АО. При этом приближенное решение (так как для молекул уравнение Шредингера может быть решено только приближенно!) хотя бы в этих областях будет достаточно корректным. В области между ядрами МО будет описываться суперпозицией АО. Задача нахождения волновых функций МО при этом сводится к нахождению коэффициентов сki. Помимо этого, для каждой МО необходимо определить соответствующую ей энергию.

Мы уже знаем, что состояние электронов в атоме описывается квантовой механикой как совокупность атомных электронных орбиталей (атомных электронных облаков); каждая такая орбиталь характеризуется определенным набором атомных квантовых чисел. Метод МО исходит из предположения, что состояние электронов в молекуле также может быть описано как совокупность молекулярных электронных орбиталей (молекулярных электронных облаков), причем каждой молекулярной орбитали (МО) соответствует определенный набор молекулярных квантовых чисел. Как и в любой другой многоэлектронной системе, в молекуле сохраняет свою справедливость принцип Паули, так что на каждой МО может находиться не более двух электронов, которые должны обладать противоположно направленными спинами.
Молекулярное электронное облако может быть сосредоточено вблизи одного из атомных ядер, входящих в состав молекулы: такой электрон практически принадлежит одному атому и не принимает участия в образовании химических связей. В других случаях преобладающая часть электронного облака расположена в области пространства, близкой к двум атомным ядрам; это соответствует образованию двухнентровой химической связи. Однако в наиболее общем случае электронное облако принадлежит нескольким атомным ядрам и участвует в образовании многоцентровой химической связи. Таким образом, с точки зрения метода МО двух-нентровая связь представляет собой лишь частный случай многоцентровой химической связи.
Основная проблема метода МО — нахождение волновых функций, описывающих состояние электронов на молекулярных орбиталях. В наиболее распространенном варианте этого метода, получившем сокращенное обозначение «метод МО ЛКАО» (молекулярные орбитали, линейная комбинация атомных орбиталей), эта задача решается следующим образом.
Пусть электронные орбитали взаимодействующих атомов характеризуются волновыми . Тогда предполагается, что волновая функция гр, отвечающая молекулярной орбитали, может быть представлена в виде суммы
Для уяснения физического смысла такого подхода вспомним, что волновая функция гр соответствует амплитуде волнового процесса, характеризующего состояние электрона Как известно, при взаимодействии, например, звуковых или электромагнитных волн их амплитуды складываются. Как видно, приведенное уравнение равносильно предположению, что амплитуды молекулярной «электронной волны» (т. е. молекулярная волновая функция) тоже образуются сложением амплитуд взаимодействующих атомных «электронных волн» (т. е. сложением атомных волновых функций). При этом, однако, под влиянием силовых полей ядер и электронов соседних атомов волновая функция каждого атомного электрона изменяется по сравнению с исходной волновой функцией этого электрона в изолированном атоме. В методе МО ЛКАО эти изменения учитываются путем введения коэффициентов С1 С2 и т. д., так что при нахождении молекулярной волновой функции складываются не исходные, а измененные амплитуды .
Выясним, какой вид будет иметь молекулярная волновая функция гр, образованная в результате взаимодействия волновых функций (гр1 и гр2) ls-орбиталей двух одинаковых атомов. Для этого найдем сумму С\гр! + С2гр2. В данном случае оба рассматриваемых атома одинаковы, так что коэффициенты Ci и С2 равны по величине (Ci=C2 = C), и задача сводится к определению суммы С(гр, + Поскольку постоянный коэффициент С не влияет на вид искомой молекулярной волновой функции, а только изменяет ее абсолютные значения, мы ограничимся нахождением суммы
Для этого расположим ядра взаимодействующих атомов на том расстоянии друг от друга (г), на котором они находятся в молекуле, и изобразим волновые функции ls-орбиталей этих атомов , Чтобы найти молекулярную волновую функцию гр, сложим величины гр1 и гр2: в результате получится кривая. Как видно, в пространстве между ядрами значения молекулярной волновой функции гр больше, чем значения исходных атомных волновых функций. Но квадрат волновой функции характеризует вероятность нахождения электрона в соответстующей области пространства, т. е. плотность электронного облака В результате возникают силы притяжения положительно заряженных атомных ядер к этой области'—образуется химическая связь. Поэтому МО рассматриваемого типа называется связывающей.
В данном случае область повышенной электронной плотности находится вблизи оси связи, так что образовавшаяся МО отноится к о-типу. В соответствии с этим, связывающая МО, полученная в результате взаимодействия двух атомных ls-орбиталей, обозначается осв Is.
Электроны, находящиеся на связывающей МО, называются связывающими электронами.

Волновая функция ls-орбитали обладает постоянным знаком. Для отдельного атома выбор этого знака произволен: до сих пор мы считали его положительным. Но при взаимодействии двух атомов знаки волновых функций их ls-орбиталей могут оказаться различными. Значит, кроме случая, а, где знаки обеих волновых функций одинаковы, возможен и случай, когда знаки волновых функций взаимодействующих ls-орбиталей различны. Молекулярная орбиталь, образующаяся при подобном взаимодействии, характеризуется уменьшением абсолютной величины волновой функции в межъядерном пространстве по сравнению с ее значением в исходных атомах: на оси связи появляется даже точка, в которой значение волновой функции, а, следовательно, и ее квадрата, обращается в нуль. Это означает, что в рассматриваемом случае уменьшится и плотность электронного облака в пространстве между атомами. В результате притяжение каждого атомного ядра в направлении к межъядерной области пространства окажется более слабым, чем в противоположном направлении, т. е. возникнут силы, приводящие к взаимному отталкиванию ядер. Здесь, следовательно, химическая связь не возникает; образовавшаяся в этом случае МО называется разрыхляющей, а находящиеся на ней электроны — разрыхляющими электронами.
а
Переход
электронов с атомных ls-орбиталей
на связывающую МО, приводящий к
возникновению химической связи,
сопровождается выделением энергии.
Напротив, переход электронов с атомных
ls-орбиталей
на разрыхляющую МО требует затраты
энергии. Следовательно, энергия электронов
на орбитали асв
Is
ниже, а на орбитали стразр
Is
выше, чем на атомных ls-орбиталях.

Мы знаем, что в наиболее устойчивом (невозбужденном) состоянии атома электроны занимают атомные орбитали, характеризующиеся наименьшей возможной энергией. Точно так же наиболее устойчивое состояние молекулы достигается в том случае, когда электроны занимают МО, отвечающие минимальной энергии. Поэтому при образовании молекулы водорода оба электрона перейдут с атомных ls-орбиталей на связывающую молекулярную орбиталь стсв Is в соответствии с принципом Паули, электроны, находящиеся иа одной МО, должны обладать противоположно направленными спинами. Используя символы, выражающие размещение электронов на атомных и молекулярных орбита лях, образование молекулы водорода можно представить схемой:
Атомныв ор5итала
Молекулярные орбитали
j Атомные орбитали
Кратность связи определяется числом общих электронных пар: простой считается связь, образованная одной общей электронной парой, двойной — связь, образованная двумя общими электронными парами, и т. д. Аналогично этому, в методе МО кратность связи принято определять по числу связывающих электронов, участвующих в ее образовании: два связывающих электрона соответствуют простой связи, четыре связывающих электрона — двойной связи и т. д. При этом разрыхляющие электроны компенсируют действие соответствующего числа связывающих электронов. Так, если в молекуле имеются 6 связывающих и 2 разрыхляющих электрона, то избыток числа связывающих электронов над числом разрыхляющих равен четырем, что соответствует образованию двойной связи. Следовательно, с позиции метода МО химическую связь в молекуле водорода, образованную двумя связывающими электронами, следует рассматривать как простую связь.
Молекула h2
Из двух имеющихся 1s АО водородных атомов, образующих молекулу, φaи φb, можно построить две линейные комбинации вида ψi= cliφa+ c2iφb:
(здесь мы учли симметрию молекулы водорода, положив cli= | c2i| и обозначив их N1и N2. Этим МО соответствуют энергии ε1и ε2, значения которых вместе с коэффициентами линейной комбинации можно найти, решая уравнение Шредингера при помощи методов квантовой химии, рассмотрение которых не входит в задачу нашего обозрения. Важно подчеркнуть особенности решения:
• МО ψ1, для которой характерно увеличение электронной плотности в пространстве между ядрами, соответствует более низкой энергии (рис. 1). Заполнение этой МО электронами приводит к повышению устойчивости системы. Такую МО обычно характеризуют как связывающую: наличие на ней электронов приводит к усилению связывания между атомами. Для образования связывающей МО необходимо, чтобы образующие ее АО в области между ядрами имели одинаковый знак.

Рис. 1. Схема образования МО в молекуле H2.
• Напротив, МО ψ2характеризуется узловой плоскостью в пространстве между ядрами, в которой электронная плотность обращается в нуль. Такая орбиталь носит название разрыхляющей. Образующие ее АО в области между ядрами имеют разные знаки.
• Для связывающей МО уровень энергии лежит ниже суммарной энергии электронов на исходных АО, а для разрыхляющей — выше. При этом понижение энергии при образовании связывающей МО обычно меньше, чем повышение энергии соответствующей разрыхляющей орбитали.
В молекуле H2 оба электрона занимают связывающую МО, и суммарная их энергия ниже электронной энергии двух изолированных атомов водорода. Эта же схема позволяет понять, почему образование, например, молекулы He2 энергетически невыгодно: ее четыре электрона должны заполнить и связывающую, и разрыхляющую МО, при этом их суммарная энергия оказывается выше электронной энергии изолированных атомов.
Другие двухатомные молекулы
Рассмотрим более сложную молекулу — О2(рис. 2).
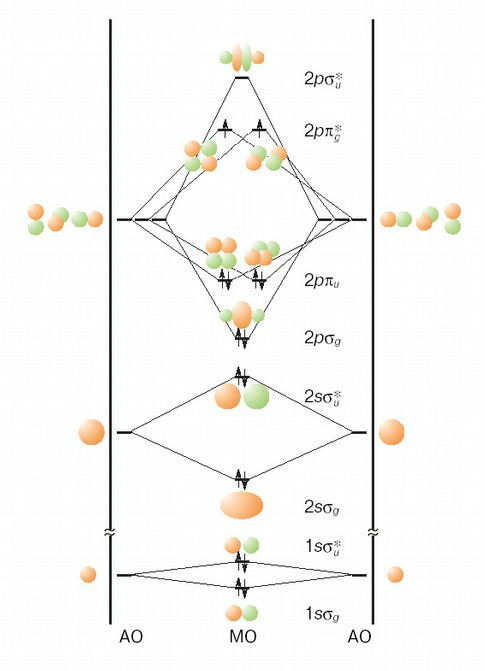
При построении схемы МО мы использовали следующие соображения:
• Каждая пара взаимодействующих АО образует две МО — связывающую и разрыхляющую.
• Расщепление энергий МО тем выше, чем сильнее взаимодействуют образующие их АО.
• Взаимодействие двух АО тем сильнее, чем ближе они по энергии, поэтому взаимодействием внутренних (остовных) 1s АО с валентными орбиталя-ми можно пренебречь.
• Взаимодействие двух АО тем сильнее, чем больше они перекрываются друг с другом.
• Если результирующее перекрывание равно нулю (например, для pxи pyАО), то взаимодействие отсутствует.
Полученные МО заполняются электронами по правилам:
-
МО заполняются электронами в порядке возрастания их энергии.
-
На каждой МО может находиться не более двух электронов с антипараллельными спинами (принцип Паули).
-
МО с одинаковыми энергиями вначале последовательно заполняются электронами с параллельными спинами, оставшиеся электроны располагают на этих же МО с противоположным спином (правило Гунда).
Внутренние (остовные) 1s АО образуют связывающую 1sσgи разрыхляющую 1sσ*2МО. Обозначение а для этих орбиталей связано с их симметрией. МО σ-типа полностью симметричны относительно оси, соединяющей атомы. Индексы g и u обозначают симметричное и антисимметричное поведение МО относительно центра инверсии, совпадающего с серединой связи. Префикс 1s описывает происхождение МО, а звездочка обозначает разрыхляющий характер орбитали. Взаимодействие 2s АО более сильное, но сводится к той же схеме с образованием 2sσgи 2sσ*2МО.
Более запутана картина МО, образованных 2p АО. Взаимодействиер pАО, направленных вдоль связи, велико, и его результат — образование 2pσgи 2рσ*2МО. Перекрывание p АО, перпендикулярных связи, существенно меньше. При их взаимодействии образуются две связывающие 2рπuМО с одинаковой энергией (напомним, что такие орбитали называют вырожденными) и две вырожденные 2р2π*gразрыхляющие МО.
На построенных МО теперь следует разместить 16 электронов (по 8 от каждого атома кислорода). Четыре из них заполняют lsσgи 1sσ*uМО. Связывание, обусловленное заполнением σg, компенсируется разрыхлением σ *u. Оба эти взаимодействия слабы, поскольку на расстояниях порядка длины связи в молекуле кислорода перекрывание плотно прижатых к ядру 1s АО мало. Следующие четыре электрона занимают 2sσgи 2sσ*uМО, в которых связывание и разрыхление также взаимно компенсируются.
Шесть электронов располагаются на связывающих 2pσgи 2рπuорбиталях. Оставшиеся два электрона должны разместиться на низших по энергии из еще не заполненных МО. Такими орбиталями оказываются вырожденные 2рп*gи, в соответствии с правилом Гунда, каждая из них должна быть занята одним электроном, причем спины этих электронов должны быть параллельны. Суммарный спин молекулы при таком заполнении равен 1.
Вообще говоря, этот результат не является тривиальным. Трудно было заранее ожидать, чтобы молекула с четным числом электронов обладала спином, отличным от нуля. Тем не менее экспериментально установлено, что молекула кислорода парамагнитна и, следовательно, имеет неспаренные электроны. Этот факт удалось объяснить в рамках рассмотренной нами достаточно простой модели. Объяснение триплетного состояния молекулы кислорода было одним из первых успехов теории МО.
Достаточно сложен вопрос об изображении структурной формулы молекулы кислорода. В классической химии принято связывать с атомом кислорода два валентных штриха, означающих участие в связывании двух пар электронов. Построенная схема позволяет однозначно указать только одну такую пару, занимающую 2pσgМО. Соответствующая ей разрыхляющая 2рσ*uМО вакантна. Из двух же связывающих π-орбиталей каждой соответствует частично заполненная разрыхляющая π*МО. Возможно, при изображении структурной формулы молекулы O=O следовало бы заменить один из валентных штрихов двумя "половинными". В то же время, суммируя число электронов, находящихся на связывающих и разрыхляющих МО, легко видеть, что на связывающих орбиталях находится на 4 электрона больше. Это позволяет характеризовать связь в молекуле кислорода как двойную.
На построенных МО можно аналогичным образом разместить 14 электронов, получив качественное описание молекулы N2. Согласно схеме (см. рис. 2), 10 электронов находятся на связывающих МО, а 4 электрона — на разрыхляющих МО. Таким образом, 2 электрона на 2pσgи 4 электрона на 2рπuобразуют тройную связь в молекуле N2.
Из 18 электронов молекулы F210 электронов находятся на связывающих МО, а 8 электронов — на разрыхляющих МО. Пара электронов, находящихся на 2pσgМО, образует одинарную связь в молекуле F2. Теория МО позволяет получить подобное качественное объяснение образования химической связи для любой гомоядерной двухатомной молекулы. Такие качественные схемы весьма полезны, они позволили Малликену еще в 1932 году успешно систематизировать широкий круг сведений об электронной структуре двухатомных молекул. Однако необходимо понимать, что качественная картина не всегда верно предсказывает взаимное расположение энергетических уровней, воспроизведение которых возможно лишь с помощью расчетных методов квантовой химии.
Наличие в молекуле СО шести связывающих электронов при отсутствии разрыхляющих электронов отвечает, как и в молекуле г.зота (рис. 51), образованию тройной связи. Это объясняет значительное сходство в свойствах свободного азота и оксида углерода, например, близость энергии диссоциации молекул (N2 —945, СО — 1076 кДж/моль), межъядерных расстояний в молекулах (соответственно 0,110 и 0,113 им), температур плавления (63 и 68 К) и кипения (77 и 82 К).
Рассмотренные примеры показывают, что метод МО успешно объясняет строение и свойства таких молекул, описание которых с помощью метода ВС встречает существенные затруднения.
