
- •26.1.1. Принцип метода кондуктометрии
- •26.1.2. Удельная электрическая проводимость
- •26.1.3. Эквивалентная электрическая проводимость
- •26.1.4. Зависимость электрической проводимости раствора от его концентрации
- •26.2.1. Кондуктометрические ячейки.
- •26.2.2. Современные модели кондуктометров
- •3 Для зарядки аккумулятора рекомендуется использовать источник питания бпс6-1
- •4 При использовании источника питания бпс6-1
- •Кондуктометры hanna. Серия карманных и портативных кондуктометров, фирмы hanna.
- •26.3.1. Классификация кондуктометрических методов анализа.
- •26.3.2. Применение кондуктометрических методов анализа.
26.1.3. Эквивалентная электрическая проводимость
Электрическая проводимость растворов электролитов зависит от их концентрации, поэтому в электрохимии используют такие величины как мольная и эквивалентная электрическая проводимость.
Эквивалентная электрическая проводимость - проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Ее единицей измерения является См • см2/моль. СЛАЙД 5
Эквивалентную и удельную электрические проводимости связывает следующее уравнение:
= 110-3с
где с – молярная концентрация эквивалента, моль/л. (Коэффициент 110-3 появляется в этом уравнении потому, что в 1 см3 раствора содержится 0,001 моль эквивалента электролита).
Характеристикой движения ионов в электрическом поле является подвижность u:
u
=
![]()
где ze e – заряд иона; r – радиус частицы (см); - коэффициент вязкости среды (кг/(мс)).
Эквивалентная электрическая проводимость связана с подвижностями ионов следующим уравнением:
= F(u+ + u-) = Fu+ + Fu-
где F – постоянная Фарадея; u+ - подвижность катиона; u- - подвижность аниона.
Произведения Fu+ и Fu- называют эквивалентными электропроводностями соответствующих ионов:
+ = Fu+
- = Fu-
Сумма эквивалентных электропроводностей ионов равна эквивалентной электропроводности электролита:
= + + -
26.1.4. Зависимость электрической проводимости раствора от его концентрации
Электрическая проводимость раствора зависит от степени диссоциации электролита. Поэтому следует ожидать, что для сильных и слабых электролитов зависимость электрической проводимости от концентрации будет различной.
Сильные электролиты диссоциированы нацело даже в достаточно концентрированных растворах. В этом случае электрическая проводимость должна быть прямо пропорциональна концентрации:
= 110-3сF(u+ + u-)
Однако ввиду межионных взаимодействий с ростом концентрации электропроводность растет медленнее, чем этого следовало бы ожидать из этого уравнения, а при очень высоких концентрациях (1-15 моль/л) начинает падать.Это явление связано с образованием незаряженных ионных пар ионных ассоциатов, неспособных проводить ток.
Описанное явление приводит к тому, что эквивалентная электропроводность сильных электролитов уменьшается с ростом концентрации (рис. 16.4).
При бесконечном разбавлении межионные взаимодействия отсутствуют, и подвижности ионов достигают максимальных значений. На рис. 16.4 показано значение эквивалентной электропроводности раствора КСl при бесконечном разбавлении.
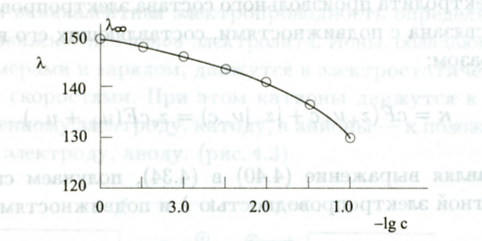
Рис. 16.4. Зависимость эквивалентной электрической проводимости раствора сильного электролита (KCl) от концентрации.
Для любого иона величина эквивалентной электрической проводимости при бесконечном разбавлении (табл. 26.1) не зависит от условий эксперимента и может быть использована для приближенной оценки электрической проводимости раствора электролита.
Таблица 26.1 Эквивалентные электрические проводимости некоторых ионов при бесконечном разбавлении (18С)

Как видно из этой таблицы, ионы Н+ и ОН- характеризуются электрической проводимостью, во много раз превышающей электрическую проводимость других ионов. Это объясняется особым, так называемым эстафетным, механизмом переноса заряда этими ионами в водных растворах, заключающемся в серии последовательных актов разрыва и образования водородных связей.
Зависимость эквивалентной электрической проводимости сильных электролитов от концентрации (рис. 26.4) в области до 0,01М хорошо описывается законом Кольрауша («законом квадратного корня»):
=
∞
-
k![]()
Величина константы k для каждого электролита имеет свое значение.
Для слабых электролитов с изменением концентрации изменяется степень диссоциации. С увеличением концентрации степень диссоциации уменьшается. К слабым электролитам относятся, в частности, органические кислоты и основания, а также некоторые соли — FeF3, HgCl2.
Для разбавленных растворов слабых электролитов межионные взаимодействия пренебрежимо малы. Отличие электрической проводимости от предельной (при бесконечном разбавлении) связано в этом случае лишь с неполнотой диссоциации. Поэтому степень диссоциации равна
=
![]()
Она представляет собой отношение концентрации катиона или аниона электролита к его общей концентрации:
=
![]() =
=![]()
Для слабых электролитов в очень разбавленных растворах между эквивалентной электрической проводимостью и концентрацией наблюдается приближенно линейная зависимость:
= ∞ - kc
При более высоких концентрациях степень диссоциации слабых электролитов значительно меньше единицы.
Оборудование для кондуктометрического анализа.
