
Негізгі термодинамикалық күй параметрлері: қысым, көлем, температура. Жүйенің қасиетін және күйін сипаттайтын шамаларды параметрлер дейміз. Мысалы, газ күйін анықтайтын параметрлер қысым (Р), көлем (V) және температура (T). Жүйе тепе-теңдік қалыпқа келгенде оның күй параметрлері белгілі бір мәнге ие болады. Тепе-теңдік күйді сипаттайтындар термодинамикалық күй параметрлері болып табылады. Бұлар жүйенің макроскопиялық қасиеттері. Күй параметрлері арқылы термонинамикалық тепе-теңдікті анықтауға болады. Тепе-теңдік қандай параметрлер арқылы сипатталатыны кейінгі тақырыптарда беріледі. Макрожүйені молекулалық кинетикалық теория тұрғысынан да қарастыруға болады. Алайда бұл жағдайда жүйедегі барлық молекулалардың кеңістіктегі координаталары мен қозғалыс жылдамдықтарын білу қажет. Осы әдіспен жүйе күйін статистикалық термодинамика зерттейді. Ал жалпы феноменологиялық термодинамика болса, ол қысым, температура, т.б. макропараметрлерді қолданады. Макропараметрлер арқылы күрделі жүйенің орташа күйі сипатталады. Күй параметрлері жүйенің күйі мен қатар ондағы өтетін процестерді де сипаттайды. Процесс деп күй параметрлерінің өзгеруін айтамыз. Әрбір күйге параметрлердің белгілі бір мәндері сәйкес болатындықтан, кез келген емес, тек жүйеде орнаған термодинамикалық тепе-теңдікті бұзбай өтетін процесті қарастырамыз. Барлық процестердің ішінде тек тепе-теңдікке жақын өтетіндері алынады. Демек, процесс өткенде жүйе бір күйден екінші күйге өте баяу ауысып, тепе-теңдік күйден ауытқымайды. Осындай тепе-тңдікте өте баяу өтетін процестерді статистикалық немесе квазистатистикалық деп атайды.
Термодинамикада зерттелетін объектіні жүйе деп атайды. Жүйе дегеніміз кеңістіктің бөліп алынған бір бөлігі. Бұл бөлік бір немесе бірнеше денеден тұрады. Жүйе айналадағы ортадан ойша немесе шын мәнінде алынған шектермен шектеліп бөлінеді.Жүйені құратын денелер өзара бір-бірімен және басқа денелермен энергия не зат алмасу арқылы әрекеттесуі мүмкін. Осындай жағдайда бұлар термонинамикалық жүйе болып саналады. Термодинамикалық жүйе айналадағы ортамен әрекеттескенде, олардың арасында жылу алмасуы байқалып, жұмыс өндіріледі.
Изобаралық процесс – сыртқы тұрақты қысымда физикалық жүйеде өтетін процесс. Ол термодинамикалық диаграммада изобарамен кескінделеді. Изобаралық процесстің қарапайым мысалына ашық ыдыстағы суды қыздыру, еркін қозғалатын поршені бар цилиндрдегі газдың ұлғаюы жатады. Бұл екі жағдайда да қысым атмосфералық қысымға тең. Изобаралық процесс кезінде идеал газдың көлемі температураға пропорционал болады (қ. Гей – Люссак заңы). Изобаралық процессте, жүйенің жылу сыйымдылығы изохоралық процеске (тұрақты көлемде) қарағанда көбірек болады. Мысалы, идеал газ үшін:
 ,
мұндағы
,
мұндағы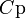 және
және –
изобаралық және изохоралық процестердегі
бір бөлшекке келетін жылу сыйымдылықтары.
Изобаралық процесстеидеал
газдың жасайтын
жұмысы
–
изобаралық және изохоралық процестердегі
бір бөлшекке келетін жылу сыйымдылықтары.
Изобаралық процесстеидеал
газдың жасайтын
жұмысы  -ге
тең, мұндағы
-ге
тең, мұндағы –
қысым,
–
қысым, –
газ көлемінің өзгерісі.
–
газ көлемінің өзгерісі.
Изотермалық
процесс, изотермиялық
процесс –
физикалық жүйеде тұрақты температурада
жүретін процесс; термодинамикалық күй
диаграммасында изотермамен кескінделеді.
Изотермалық процессті жүзеге асыру
үшін жүйе, әдетте, термостатқа
орналастырылады. Бұл жағдайда термостаттың
жылу өткізгіштігі өте үлкен болып келеді
де, жүйе температурасының іс жүзінде
термостат темп-расынан айырмашылығы
болмайды. Изотермалық процесстің
мысалына тұрақты температурадағы
сұйықтықтың қайнауы не қатты дененің
балқуы жатады. Изотермалық процесс
кезіндегі идеал
газда қысым менкөлемнің көбейтіндісі
тұрақты болады. Изотермалық процесс
кезінде жүйеге белгілі бір жылу мөлшері
беріледі (не одан белгілі бір жылу
мөлшері алынады) және оның есебінен
сыртқы жұмыс жасалады. Идеал газ үшін
ол жұмыстың шамасы мынаған тең:
![]() ,
мұндағы
,
мұндағы![]() –газдағы
бөлшектер саны,
–газдағы
бөлшектер саны,![]() –абсолют
температура,
–абсолют
температура, ![]() –Больцман
тұрақтысы,
–Больцман
тұрақтысы, ![]() және
және![]() –
газдың бастапқы және соңғы көлемдері.
Егер фазалық ауысу болмаса, онда
изотермалық процесс кезінде қатты
дененің және көптеген сұйықтықтардың
көлемі өте аз өзгереді.
–
газдың бастапқы және соңғы көлемдері.
Егер фазалық ауысу болмаса, онда
изотермалық процесс кезінде қатты
дененің және көптеген сұйықтықтардың
көлемі өте аз өзгереді.
Изохоралық процесс – физикалық жүйеде тұрақты көлемде жүретін процесс. Ол термодинамикалық күй диаграммасында изохорамен кескінделеді.
Изохоралық процессті көлемі өзгермейтін герметикалық (тұмшаланған) ыдыстағы газдар мен сұйықтықтарда жүзеге асыруға болады. Дене көлемінің өзгеруіне ішкі энергиясының өзгеруі жылудың жұтылуы не шығуы есебінен атқарылады. Температураның өзгеруіне байланысты газдың (сұйықтықтың) қысымы да өзгереді. Изохоралық процесс кезінде идеал газдың қысымы температураға пропорционал (Шарль заңы) болады. Нақты (идеал емес) газда Шарль заңы орындалмайды. Өйткені газға берілген жылудың белгілі бір бөлігі бөлшектердің өзара әсерлесу энергиясын арттыруға жұмсалады. Ал қатты денедегі изохоралық процессті атқару техникалық жағынан едәуір күрделі болып келеді. Сығылғыштығы өте аз қатты денедегі кез келген изотермалық процесті, бірнеше ондаған килобар қысымға дейін, изохоралық процесс деп есептеуге болады.
Адиабаталық процесс — қоршаған ортамен жылу алмаспайтын физикалық жүйеде өтетін термодинамикалық процесс. Адиабаталық процесс жылу өткізбейтін (адиабаталық) қабықшалармен қоршалған жүйелерде өтеді деп есептелінеді. Сыртқы орта мен жүйе арасында жылу алмасып үлгере алмайтындай уақытта тез өтетін процестер (жылу оқшаулағыш қабықшалары болмайтын) адиабаталық процесс ретінде қарастырылады. Оған мысалы, дыбыстың ауада таралуы, жылу қозғалтқыштарының цилиндрі ішіндегі газдың сығылуы (немесе ұлғаюы) т.б. жатады. Газ сығылғанда температура көтеріледі, ұлғайғанда — төмендейді. Адиабаталық процесс қайтымды және қайтымсыз процесс түрінде өтуі мүмкін.
Қайтымсыз процестерге тән ерекшелік – термодинамиканың екінші бастамасы. Сипаттаған Р.Клаузиус. Клаузиус сыртқы ортамен энергия немесе немесе масса алмаспайтын оқшауланған жүйелерді қарастырады. Бұл S энтропия функциясы болып табылады. Энтропия максимал мәнге жеткенше термодинамикалық тепе-теңдік күйде монотонды (бірсарынды) өсіп отырады dS/dt≥0.
Қайтымды процесс, термодинамикада – термодинамикалық жүйенің тура процесінің барлық аралық күйлерін кері бағытта ретімен қайталай отырып, бастапқы қалпына қайта оралуы мүмкін болатын бір күйден екінші күйге ауысуы. Табиғатта өтіп жататын процестердің ешқайсысы да бұл шартты қанағаттандырмайды, олар қайтымсыз процесс болып табылады, тек олардың кейбіреулерін ғана идеалдандырған жағдайларда Қайтымды процесс деп қарастыруға болады. Қайтымды процесс уақыттың таңбасын өзгерткен кезде өзінің түрін өзгертпейтін теңдеулермен сипатталады[1]. Механика мен электрдинамиканың (егер үйкеліс күштері түріндегі күштерді ескермесе) көптеген есептері, т.б. Қайтымды процесстерге негізделіп зерттеледі. Қайтымды процесс түсінігі уақытқа айқын тәуелді болмайтын термодинамиканың бірінші және екінші бастамаларына сүйенетін макроскопиялық термодинамика тепе-теңдігінің негізгі түсініктерінің бірі. Термодинамикада Қайтымды процесс бір-бірінен айырмашылығы шексіз аз болатын тепе-теңдік күйлердің үздіксіз қатары ретінде қарастырылатын өте баяу процесс, демек Қайтымды процесс тепе-теңдік жүйені анықтайтын термодинамикалық параметрлердің баяу өзгерісімен сипатталады. Мұндай процестер квазистатикалық немесе квази тепе-тең процестер деп аталады. Квазистатикалық процестің қайтымды болатыны оның әрбір аралық күйінің термодинамикалық тепе-теңдік күйде болатындығында, сондықтан процестің тура не кері бағытта өтіп жатқандығы ескерілмейді. Қайтымды процесстің микроскопиялық теориясы статистикалық физикада қарастырылады.
Клапейрон – Менделеев теңдеуі – идеал газдың күйін анықтайтын және оның негізгі параметрлерінің (p қысымның, V көлемнің және T абсолют темп-раның) арасындағы байланысты тағайындайтын теңдеу: pV=BT, мұндағы B пропорционалдық коэффициенті – газдың массасы (M) мен молекулалық массасына тәуелді шама. Бұл теңдеуді француз оқымыстысы Б.П.Э. Клапейрон (1799 – 1864) ашқан (1834). Ал 1874 ж. Д.И. Менделеев идеал газдың бір моліне арналған мынадай күй теңдеуін қорытып шығарды: pV=RT болса, онда: pV= = немесе pV= NkT, мұндағы N – газ бөлшектерінің саны, k –, мұндағы R – универсал газ тұрақтысы. Егер газдың молекулалық массасы Больцман тұрақтысы. Клапейрон теңдеуі Бойль-Мариотт заңын, Гей-Люссак заңын және Авогадро заңын біріктіретін идеал газ күйінің теңдеуі болып табылады. Бұл теңдеудің көмегімен идеал газ қасиетіне жақын келетін реал газдың кейбір қасиеттері зерттеледі.
P=
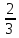
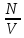
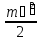 , N –меншікті көлемдегі малекула саны,
V – меншіктіі көлем
, N –меншікті көлемдегі малекула саны,
V – меншіктіі көлем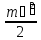 -=BT
. B – пропорционалдық коэффициент
-=BT
. B – пропорционалдық коэффициент
PV=
 NBT
NBT
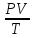 =
=
 NB ;
NB ; =const=R,
R-меншікті газ тұрақтысы,универсал
газ тұрақтысы.
=const=R,
R-меншікті газ тұрақтысы,универсал
газ тұрақтысы.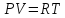 (Менделеев-Клайперон теңдеуі)
(Менделеев-Клайперон теңдеуі)
PV=mRT кез келген масса үшін Менделеев-Клайперон теңдеуі.
Егер газ химиялық араласпай, механикалық араласса, осыны газ қоспаса деп аталады.
Дальтон заңы – газ қоспасының қысымы газды құрайтын компоненттерінің парциал қысымдарының қосындысына тең.
Pқос=
 i
=
P1
+P2
+P3
+ … +Pn
i
=
P1
+P2
+P3
+ … +Pn
Газ қоспасының берілу тәсілдері:
Массалық үлес: gi =
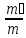
Көлемдік үлес: ri =
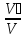 (парциал көлем)
(парциал көлем)Мольдік үлес:
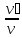 =
rᵢ =
=
rᵢ =
𝜈ᵢ
= ,𝜈
=
,𝜈
=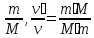
Газ қоспасының газ тұрақтылары PᵢV=mᵢRᵢT (компонента үшін Менделеев-Клайперон теңдеуі)
PV=mRT (қоспа үшін Менделеев-Клайперон теңдеуі).
Rᵢ -компонента үшін меншікті газ тұрақтысы.
Rᵢ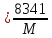 ,
R
,
R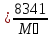
Mқос
=
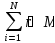
Массалық үлес пен көлемдік үлестің арақатынасы
gᵢ
= =
=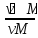 = [
= [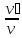 = rᵢ =
= rᵢ =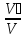 ] =
] =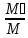 * rᵢ
* rᵢ
gᵢ
=
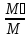 * rᵢ → gᵢ =
* rᵢ → gᵢ =
Термодинамиканың I заңы – термодинамикалық термодинамикалық жүйелерде жүретін процестерге қатысты энергияның сақталу заңы. Жалпылама энергияның сақталу заңы – тұйық жүйеде қосындысы тұрақты. Энергия жоқтан пайда болмайды, жоғалып кетпейді, тек 1 түрден 2-түрге ауысады.
Майер теңдігі: Q = AL
L- жұмыс (жылутехникада)
Q- жылу мөлшері
Жылулық эквивалент
А =1 (бірліктері бірдей болғанда)
Q=L
 (орта
кинет-қ энергия н/е ішкі энергия),
(орта
кинет-қ энергия н/е ішкі энергия),
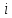 -
еркіндік дәрежесі
-
еркіндік дәрежесі
U= (берілген көлемдегі ішкі энергия)
(берілген көлемдегі ішкі энергия)
1 моль зат үшін ішкі энергия:
U= =
=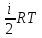
кез келген зат мөлшері үшін ішкі энергия:
U=
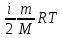
1)Ішкі энергия молекуланың жылулық қозғалысы кезіндң пайда болатын кинетикалық энергия;
2)молекуланың һзара байланысының потенциалдық энегиясы;
3)атомның өзара байланысының потенциалдық, қозғалысының кинетикалық энергиясы.
dU= dUк + dUп
Сыртқы ортадан жылу берілсе, өзгеріп кетеді
dU=
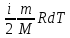
ΔU=
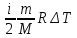 -бастапқы мен соңғы нүктесінің айырымы
алынса, о күй функциясы деп аталады.
Ішкі энергия да күй функциясы.
-бастапқы мен соңғы нүктесінің айырымы
алынса, о күй функциясы деп аталады.
Ішкі энергия да күй функциясы.
Ұлғаю жұмысы – оң жұмыс.
dQ – жылу беріледі.
P=
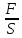 , dL = F*dl = PSdl =P*dV
, dL = F*dl = PSdl =P*dV
dL= P dV
dl=pdv (бірлік массаға шағылған түрі)
Барлық жұмысты интеграл арқылы алады
l=
Сырттан жылу бергенде поршень итеріледі е жұмыс жасалады.
Термодинамиканың бірінші заңының есептік түрі.
dQ= dU + dL (1)
Жүйеге dQ берілген жылу жүйенің dU ішкі энергиясын өзгертеді, жұмыс атқарады dА.
Теңдеудің бірлік шамаға шағылған формуласы:
dq = du + dl - термодинамиканың бірінші заңының есептік түрі.
Энтальпия – күй функциясы.
H = U +pV (1)
Есептік түрі: h = u+ pv (2)
dh = du + pdv +vdp (3) (дифференциалдық формасы)
du+pdv = dq (4)
dq = du + dl = du + pdv (5)
(3), (5)→ dh = dq + vdp (6)
Энтальпия – жылуұстағыш, кез келген материалдың жылуұстағыш қасиеті бар.
Жылусыйымдылық - заттың бір грамының не бір молінің температурасын бір градусқа көтеру үшін жұмсалатын жылу мөлшерін жылу сыйымдылық деп атайды. Заттардың жылу сыйымдылығы температураға тәуелді, сондықтан жылу сыйымдылықтың мәні нақтылы және орташа болып бөлінеді. Нақтылы жылу сыйымдылық деп берілген температурадағы жүйенің жылу сыйымдылығын айтады: C=δQ/dT.
жылу сыйымдылық деп берілген екі температура аралығындағы оның мәнін айтады:
C=Q/(T2 – T1)=Q/ΔT
Q – жүйені T1 – ден T2 қыздыру үшін қажетті жылу мөлшері. Заттың бір грамына (1 кг) тиісті жылу сыйымдылық – меншікті жылу сыйымдылық деп, ал 1 моліне тиісті мольдік жылу сыйымдылық деп аталады. Термодинамикалық жүйелер үшін жылу сыйымдылықтың шамасы жүйеде өтетін процестің түріне байланысты. Изохоралық процестің (V=соnst) жылу сыйымдылығын CV, изобаралық (P=соnst) жылу сыйымдылығын CP деп белгілейді.
C
=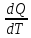 → dQ=C*dT, → CdT= dU + dL = dU + pdV → V=const →
→ dQ=C*dT, → CdT= dU + dL = dU + pdV → V=const →
pdV=0
→ CvdT
= dU → ΔU
= CvΔT
→ ΔU=
 RΔT → Cv
=
RΔT → Cv
=
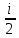 R
R
CdT = dU + PdV → p=const → CpdT = dU + pdV = dU + RM dT →
CpΔT = CvΔT + RMΔT → Cp – Cv = RM → Cp = Cv + RM -Майер теңдеуі
Cp
= Cv
+R → Cv
=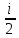 R → Cp
=
R → Cp
= R + R = (
R + R = ( + 1) R =
+ 1) R =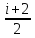 R
R
12.Орташа
жылусыйымдылықтар.Жылу мөлшерін орташа
жылусыйымдылығын пайдаланып графиктен
табу.Кез-келген дененің жылусыйымдылығы
С осы дененің температурасын 1 Кельвинге
өзгерту үшін қажет жылуға тең.;
 ;Орташ=а
жылусыйымдылықтар- температура t1-
ден t2
аралығында өзгерг+ен процесс кезінде
берілген немесе алынған орташа
жылусыйымдылығын жүйеге берілген жылу
мөлшерін температураға бөлгенге тең.
.
;Орташ=а
жылусыйымдылықтар- температура t1-
ден t2
аралығында өзгерг+ен процесс кезінде
берілген немесе алынған орташа
жылусыйымдылығын жүйеге берілген жылу
мөлшерін температураға бөлгенге тең.
.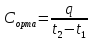 ;
;
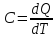 ;
; ;
; ;
;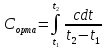 ;
; ;
;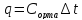
Заттың меншікті жылу сыйымдылығы деп, бір кг заттың температурасын бір К қыздыру үшін қажетті жылу мөлшерін айтамыз.
13.Энтропия.Энтропия (грек.
еntropіa – бұрылыс, айналу) – тұйық
термодинамикалық жүйедегі өздігінен
жүретін процестің өту бағытын сипаттайтын
күй функциясы. Энтропияның күй функциясы
екендігі термодинамиканың екінші
бастамасында тұжырымдалады. Энтропия
ұғымын термодинамикаға 1865
ж. Р.Клаузиус енгізген.
Кез келген А және В күйлеріндегі жүйе
Энтропиясы мәндерінің айырымы мына
формула арқылы анықталады: , мұндағы Q
– жүйеге күйі шексіз аз квазистатик.
болып өзгергенде берілетін жылу мөлшері,
Т – жүйенің абс. темп-расы; интрегал екі
күйді өзара жалғастыратын кез келген
қайтымды жолмен алынады. Изотерм. процесс
жағдайында: S=Q/Т.
Ал кез келген қайтымды жолмен алынатын
тұйық процесс үшін: . Соңғы теңдік
Энтропияның dS=Q/Т
түріндегі толық дифференциал болатындығының
қажетті және жеткілікті шарты, ал
Энтропия – күй функциясы. Термодинамиканың
1 заңының есептік түрі: dq=du+dl (1)
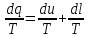 ;
;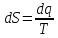 –
энтропияның есептік түрі.
–
энтропияның есептік түрі. (2)
(2)
Энтропияның
мағынасы абсолют температурадағы
жылудың өзгерісі.
 (3)
(3)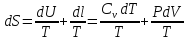 (4)
(4) (5) PV=RT (6)
(5) PV=RT (6)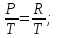
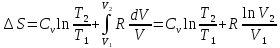 (7);
(7);
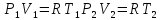 ;
;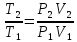 ;
;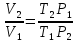 (8)
(8)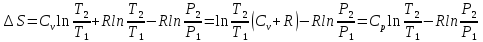 (9);
(9);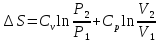 ;
;
TSдиаграммасы: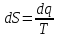 ;
;
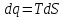 ;
;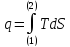
14.Термодинамиканың екінші заңының жалпы тұжырымдамалары. Термодинамиканың екінші бастамасы) — статистикалық нысандардың (мысалы, атомбеидардың, молекулалардың) үлкен санынан тұратын жүйелердің өз бетінше ықтималдығы аздау күйден ықтималдығы молырақ күйге ауысу процесін сипаттайтын табиғаттың түбегейлі заңы.
Ыстық жылу көзі(қыздырғыш)--->Жұмыс денесі--->Суық жылу көзі(суытқыш) Термод-ң 2 заңының тұжырымдамасы: Қыздырғыштан жұмыс денесіне бөлінген жылу мөлщері толығымен пайдалы жұмысқа кетпейді, бір бөлігі суытқышқа кетеді.Жұмыстық дене деп, суыту немесе қыздыру әрекетімен өз күйін өзгертіп, жылу энргиясын механикалық энергияға түрлендіретін газ тәріздес заттарды айтамыз.Кез-келген жылу машинасының схемасы: қыздырғыш--->жұмыс денесі б/ша айналма процесс цикл--->суытқыш. Қыздырғыш- химиялық жану процестері.Жұмыстық дене- кез-келген газ немесе бу. Суытқыш- қоршаған орта (ауа).Қозғағыштың жұмыс істеу принципі: Жұмыстық дене 1Б2 қисық сызықпен ұлғайып, 1Б22’1’ ауданға тең жұмыс жасайды. Осы жұмыс бір актілі циклде алынады. Сырттан механикалық жұмыс жасап, 2Б1-ге қайтадан сол жолмен қайтады. Пайдалы жұмыс алу үшін: Жұмыстық денені 2А1 қисықсызығымен сығылыды, 2А11’2’ ауданға тең жұмыс жасайды.(сығылу жұмысы). Ұлғаюға қатысты ауданнан сығылуға қатысты ауданды алсақ (1)1Б22’1’- 2A11’2’(2) 1Б2А1-ɭц.
Термодинамика-ң
1 заңын циклдық түрде жазсақ:
 -
пайдалы жұмыс.
-
пайдалы жұмыс. ;
;
15.Циклдардың
термиялық пайдалы әсер коэф-ті.
Пайдалы әсер коэффициенті (ПӘК)
– жүйенің (механизмнің) энергияны
түрлендіру немесе басқа денеге беру
тиімділігін сипаттайтын шама. Ол көбінесе
грек әрпі η -мен
(этта)
белгіленіп, мына өрнек арқылы анықталады: η
=Wпайд./Wтол,
мұндағы Wпайд.,
Wтол. жүйенің
жұмыс істеуі кезінде жұмсаған пайдалы
және толық энергиялары. Орнықты режимде
жұмыс істейтін механизмдерде сырттан
келтірілген энергияның (Wтол.)
бір бөлігі (Wпайд.)
пайдалы кедергілерді (металл кесу, жүк
көтеру, затты бөлшектеу, т.б.) жеңуге, ал
қалған бөлігі (Wшығ.)
зиянды кедергілерді (үйкеліс, денені
қыздыру, гистерезис тұзағы, құйынды
токтар) жеңуге жұмсалады. Бұл жағдайда η
=Wпайд./Wтол.
Немесе η
=1–Wшығ./Wтол.арқылы
анықталады. Кез келген механизмнің
жұмыс істеуі кезінде міндетті түрде
энергия шығындары болатындықтан барлық
уақытта η<1 болады.қыздырғыш--->жұмыс
денесі(пайдалы жұмыс атқарады) --->
суытқыш. Айтылғандар жылу машинасы,
жылу қозғалтқышы. Осы процесс қалай
бағаланады: жылу машинасы-ң жетілдіру
дәрежесі.(степень совершенства тепловой
машины)
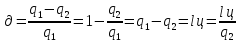 термиялық
пайдалы әсер коэф-ті. Пайд.әсер коэф-ті
0-ден 1-ге дейін өзгер-еді. 1-ге тең емес.
Берілген жылу толығымен пайдалы жұмысқа
кетсе, осындай жұмысты мәңгілік
қозғалтқыштың 2 түрін жасау мүмкін емес.
Термод-ң 2 заңынан шығатын тұжырым:
мәңгілік қозғалтқыштың 2 түрін жасау
мүмкін емес.
термиялық
пайдалы әсер коэф-ті. Пайд.әсер коэф-ті
0-ден 1-ге дейін өзгер-еді. 1-ге тең емес.
Берілген жылу толығымен пайдалы жұмысқа
кетсе, осындай жұмысты мәңгілік
қозғалтқыштың 2 түрін жасау мүмкін емес.
Термод-ң 2 заңынан шығатын тұжырым:
мәңгілік қозғалтқыштың 2 түрін жасау
мүмкін емес.
16.Циклдардың
суыту коэффициенті.Кері циклды
қарастырамыз. Тура циклда пайдалы жұмыс.
Кері циклды суыту жұмысы ұлғаюдан артық
болады. Кері циклда q2жылу
суытқыштан жұмыстық денеге беріледі.
 жұмыс сыртқы жұмыстың таралуынан
жасалынады,q1
жылу қыздырғышқа беріледі.Сұйық
машинасының жетілдіру дәрежесінің
бағасы суыту коэффициенті.
жұмыс сыртқы жұмыстың таралуынан
жасалынады,q1
жылу қыздырғышқа беріледі.Сұйық
машинасының жетілдіру дәрежесінің
бағасы суыту коэффициенті.
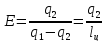
17.Тура Карно циклі. Жылу қыздырғыштан жұмыс денесіне беріледі. Осы процесс 2 түрде болады. 1) бір актілі 2)циклды; Жылу берілу процесі онымен атқарылатын жұмыс периодты түрде қайталану керек. Циклдық процестер өте көп. Идеалды түрі бар, ол- Карно циклі. Қыздырғыштан жұмыс денесіне идеалды түрде беріледі, контактісі де идеалды.ab-изотермиялық кеңею;bc-адиабаталық кеңею; cd-изотермиялық сығылу; da-адиабаталық сығылу. Cd,da-теріс жұмыстар; ab,bc- оң жұмыстар.
Lц- пайдалы жұмыс (4 жұмысты қосқанда)
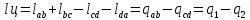 (1);
Карно циклінің термиялық пайдалы әсер
коэфи-ті:
(1);
Карно циклінің термиялық пайдалы әсер
коэфи-ті:
 (2); Карно циклінTS диаграммасы арқ:
(2); Карно циклінTS диаграммасы арқ:
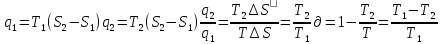
18.Кері Карно циклі.Кері Карно цикл- суытқыш машина.
 Термодина-ң
2 заңының айтылу формасы: темп-сы төмен
денеден, темп-сы жоғары денеге жылу беру
мүмкін емес. Ол үшін сырттан жұмыс атқару
керек. Кері Карно циклді TS диаграмма
арқ:
Термодина-ң
2 заңының айтылу формасы: темп-сы төмен
денеден, темп-сы жоғары денеге жылу беру
мүмкін емес. Ол үшін сырттан жұмыс атқару
керек. Кері Карно циклді TS диаграмма
арқ:
19.Энтропияның
қайтымды циклдарда өзгеруі.Қайтымды
процесс деп, кері бағытта өткізуге
болатын процесті тура бағытта өткізгенде
жүйе қандай күйлерден өтсе, кері бағытта
сондай күйлер тізбегінен өтетін процесті
айтады.Қайтымды
Каро циклі: Қайтымды Карно цикл үшін
термиялық пайд.әсер коэф-ті:
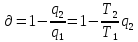 -
теріс.
-
теріс.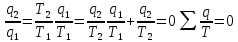 Берілген
немесе алынған жылудың абсолют
температураға қатынасын келтірілген
жылу д.а Қайтымды Карно цикл үшін
келтірілген жылудың алгебралық қосындысы
0-ге тең. Осы айтылғанды кез- келген еркін
қайтымды циклдар үшін келтірілген
жылудан тұйық контур б/ша интеграл 0-ге
тең:
Берілген
немесе алынған жылудың абсолют
температураға қатынасын келтірілген
жылу д.а Қайтымды Карно цикл үшін
келтірілген жылудың алгебралық қосындысы
0-ге тең. Осы айтылғанды кез- келген еркін
қайтымды циклдар үшін келтірілген
жылудан тұйық контур б/ша интеграл 0-ге
тең:
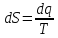
 Еркін
қайтымды циклдар үшін энтропияның
өзгерісі 0-ге тең.
Еркін
қайтымды циклдар үшін энтропияның
өзгерісі 0-ге тең.
20.Энтропияның қайтымсыз циклдарда өзгеруі.Тепе-тең емес процестер әрқашанда қайтымсыз процесс, дәлдеп айтқанда нақты процестер қайтымсыз процестер болады.Қайтымсыз Карно цикл үшін термиялық райд.әсер коэф-ті қайтымды Карно цикл үшін терм-қ пайд.әсер коэф-н кіші.
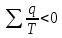 Қайтымсыз
Карно цикл үшін келтірілген жылулардың
қосындысы нөлден кіші. Кез-келген еркін
қайтымсыз цикл үшін келтірілген жылудан
тұйық контур б/ша интеграл нөлден кіші:
Қайтымсыз
Карно цикл үшін келтірілген жылулардың
қосындысы нөлден кіші. Кез-келген еркін
қайтымсыз цикл үшін келтірілген жылудан
тұйық контур б/ша интеграл нөлден кіші:
 немесе
немесе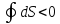 .
.
21.Эксергия.T1температурасы бар q1 жылу беретін қыздырғыш және жұмыс денесінен q2 жылу қабатынан T2 температурадан тұратын суытқыш терм-қ жүйе.
Қыздырғыштан
бөлінетін q1
жылудың жұмыстық қабілеті (Эксергия)
деп осы жылудың осы жылу беретін
максималды пайд.жұмысты айтады. Осыларды
тек Карно цикл үшін жазамыз:
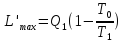 T0-суытқыштың
темп-сы. T1-
қыздырғыш-ң темп-сы.
T0-суытқыштың
темп-сы. T1-
қыздырғыш-ң темп-сы.
Осы
формуланы энтропия өзгерісінен:
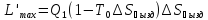 -
қыздырғыштағы энтропия өзгерісінің
кемуі.
-
қыздырғыштағы энтропия өзгерісінің
кемуі.
22) Қорытылған регенеративті Карно циклы.
Формасы
өзгеше пайдалы әсер коэффициенті бірдей
циклдар – регенеративті циркуляциялар
д.а.
T
 1
2
1
2




 4
3
4
3

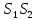 S
S
1-2-3-4-1
1-2 изотермиялық кеңеюq(+)
3-4 изотермиялық сығылу q(-)
2-3 q(2,3) (+) ұлғаю
4-1 сығылу q(-)
2-3 ; 4-1 эквидистантты қатар сызықты қисықтар
Пайдалы
жұмыс
 !
!
23)Изохорлы процесс. Изохоралық процесс – физикалық жүйеде тұрақты көлемде жүретін процесс. Ол термодинамикалық күй диаграммасында изохорамен кескінделеді.
Изохоралық процессті көлемі өзгермейтін герметикалық (тұмшаланған) ыдыстағы газдар мен сұйықтықтарда жүзеге асыруға болады. Дене көлемінің өзгеруіне ішкі энергиясыныңөзгеруі жылудың жұтылуы не шығуы есебінен атқарылады. Температураның өзгеруіне байланысты газдың (сұйықтықтың) қысымы да өзгереді. Изохоралық процесс кезінде идеал газдың қысымы температураға пропорционал (Шарль заңы) болады. Нақты (идеал емес) газда Шарль заңы орындалмайды. Өйткені газға берілген жылудың белгілі бір бөлігі бөлшектердің өзара әсерлесу энергиясын арттыруға жұмсалады. Ал қатты денедегі изохоралық процессті атқару техникалық жағынан едәуір күрделі болып келеді. Сығылғыштығы өте аз қатты денедегі кез келгенизотермалық процесті, бірнеше ондаған килобар қысымға дейін, изохоралық процесс деп есептеуге болады.
dV=0 V=const
P/T=R/V=const
 (l=0)
(l=0)
Жұмыстың денеге 1-2 процесіндегі берілген жылу мөлшері
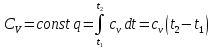
Егер жылусыйымдылық айнымалы болса , онда

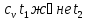 температура
аралығындағы массалық изохорлы орташа
жылу сыйымдылық.
температура
аралығындағы массалық изохорлы орташа
жылу сыйымдылық.
l=0
u=0 u=
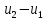 ===
===
Энтропияның изохорлы процесте өзгеруі

24)Изобарлы процесс. Изобарлы процесскезінде,қысымтұрақты болады: Р = const, басқа көрсеткіштері өзгереді, яғни V = var және Т = var.Характеристикалықтеңдеуденpv=RT кезіндегі P=constтабамыз: V/T= constнемесе V2/V1 = Т2/Т1. Сонымен, изобарлы процесс кезіндежылудинамикалық газ көлеміне тура пропорционалдыболыпөзгереді. Қайтымдыпроцесстіжүргізуүшін, изохорлыдағыдай, әртүрлі температурадағыкөпжылулықкөзінқажететеді. Мұндайпроцесстіңграфигісуретте, көлденеңі 1-2 және 1-2 P=constкезіндегісібейнеленген. 1-2 изобар- лыкеңею {dv>0) жылулықты (dq>0) жеткізуінесәйкес, оныңтемпературысыныңұлғаюыменбайланысты.
1-2 изобарлысығылу (dv<0). Мұнда температура жетпейді, жылуалыпкетіледі (dq<0). Меншіктіжұмысгазыныңкеңеюінемесесығылуы:
алоның массасы m:
Меншіктіішкіэнергияныңөзгеруі![]() Алішкі
энергия
Алішкі
энергия![]() Процесстегіжылудыңменшікті
саны:
Процесстегіжылудыңменшікті
саны:
 ;
;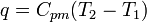 ;
; ;
;
Жылудинамикасыныңбіріншізаңыныңталдауформуласыментабамыз:
dq = CνdT + pdν = CνdT +RdT = (Cν + R)dT.
Себебі, pν = RT жәнеdp = 0 кезіндеpdν = RdT. Майердіңтеңдеуіненкеліпшығады: Cν + R немесеCp - Cν = R. БарлықгаздарүшінМср - MCν = MR = 8315 қатынастыңөзгешелігімынада:
K = Cp/Cν.
Қосатомдыгаздарүшін К= 1,4. Атомныңартуынақарай, оның Кмәнібіргежақындайды.
25) Изотермді процесс. Изотермалық процесс, изотермиялық процесс – физикалық жүйеде тұрақты температурада жүретін процесс; термодинамикалық күй диаграммасында изотермаменкескінделеді.
Изотермалық процессті жүзеге асыру үшін жүйе, әдетте, термостатқа орналастырылады. Бұл жағдайда термостаттың жылу өткізгіштігі өте үлкен болып келеді де, жүйе температурасының іс жүзінде термостат темп-расынан айырмашылығы болмайды. Изотермалық процесстің мысалына тұрақты температурадағы сұйықтықтың қайнауы не қатты дененің балқуы жатады. Изотермалық процесс кезіндегі идеал газдақысымменкөлемніңкөбейтіндісі тұрақты болады. Изотермалық процесс кезінде жүйеге белгілі бір жылу мөлшері беріледі (не одан белгілі бір жылу мөлшері алынады) және оның есебінен сыртқы жұмыс жасалады. Идеал газ үшін ол жұмыстың шамасы мынаған тең:
![]() ,
мұндағы
,
мұндағы ![]() –газдағы
бөлшектер саны,
–газдағы
бөлшектер саны,![]() –абсолют
температура,
–абсолют
температура,![]() –Больцман
тұрақтысы,
–Больцман
тұрақтысы,![]() және
және![]() –
газдың бастапқы және соңғы көлемдері.
–
газдың бастапқы және соңғы көлемдері.
Егер фазалық ауысу болмаса, онда изотермалық процесс кезінде қатты дененің және көптеген сұйықтықтардың көлемі өте аз өзгереді

Изотермді процестегі атқарылатын жұмыс
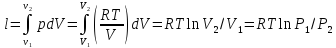
U=0 q=l

26) Адиабатты процесс. Адиабаттықайтымдыпроцессдегеніміз - қайтымдыөзгеріс куйіндежылулықалмасужүрмейді (dqа=0) жәнеүйкелісболмайды (dqүйк=0). Бұлпроцессті, изоэнтропийліпроцесс депатайды. Изоэнтропийліпроцесске арналғанжылудинамикасыныңбіріншізаңыныңталдауформуласымынатүрдежазылады:
du + dl = 0.
du = CνdTкезіндегісінтабамыз:
dl = - du = - CνdT.
 U=-A
dq=du+d A du+d A =0 dq=0
U=-A
dq=du+d A du+d A =0 dq=0

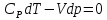
 =
=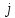
 INTEGRAL
INTEGRAL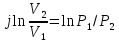
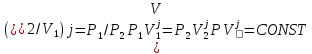
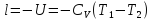 =
=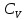 (
(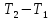 )
)
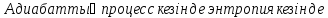
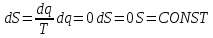
27) Политроптық процесс. Политропты процесс дегеніміз, жылуды қалай болса солай жеткізу немесе алып кету (dqа≠0) процессін айтады, ол үшін көрсеткіштерінің өзара байланыстылығының теңдеу түрі:
Pνn" = const,
мұндағы n - политроптыңкөрсеткіші. Дәл осы, қайтымдыполитроптыөзгертукүйініңкөрсеткіші n, процесстіңбарлықнүктелеріүшінбелгілі, тұрақтышамадаболады
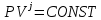
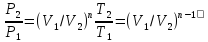 n
: -
n
: -
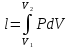 l=
l=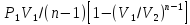

 C
C
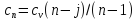
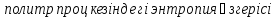
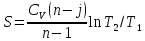
28) Ван-дер – Ваальс теңдеуі. ВАН-ДЕР-ВААЛЬС ТЕҢДЕУІ — нақты (реал) газдардың күйін сипаттайтын алғашқы теңдеулердің бірі. 1873 ж. голланд физигі Я.Д. Ван-дер-Ваальс ұсынған. Темп-расы және қысымы p болатын көлемі V газдың молі үшін В.-д.-В. т. мына түрде жазылады: (p + a/V2)(V—b)= =RT, мұндағы R — әмбебапгаз тұрақтысы, а және b — нақты газ қасиеттерінің идеал газ қасиеттерінен ауытқуын көрсететін тәжірибелік тұрақтылар.
Тартылыс күші нақты газдың қысымы қабырғаға түсетін қысым. Нақты газдың соқтығысу күші аз.
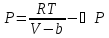
n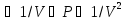 a-тартылыс
күштерін ескеретін түзету
a-тартылыс
күштерін ескеретін түзету

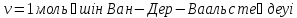


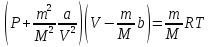
29)Ван-дер
Ваальс изотермалары. 
P
K 


A’’’
B’’’
A’’ B’’
C’’’
ABC’’
C’
V
C’ =>b’ қарай V азайып,P артады,T=const
B’ нүктесінде қысымға қатысты газда бу пайда болады. B’ –тан ары берілген көлемде конденсация пайда болады. Қысым азайған сайын сұйықтың тамшылары көрінеді. Судың үстіндегі буды қаныққан бу д.а. B’ пен A’ арасында 2 фазалық қоспа – су ж/е бу п.б. Температураны жоғарылатсақ Ван-дер-Ваальс изотермасын саламыз. А мен В арақашықтығы азая береді. Температура артқан сайын белгілі темп-да К нүктесіне келеміз. Бұл нүктені критикалық нүкте д.а. Изотерманы критикалық изотерма д.а.
МЫС
--- Су үшін

Осы процесс тағы бір құбылыспен жүреді.
P
K
1
3 
2
A’’
B’’
V
 .
.
Қаныққан будың мольдік көлемі судың мольдік көлеміне қатысты.
Газ бен судың шекарасы жойылып, тек жоғары тығыздықтағы газ тәрізді нәрсе қалады. 1,2,3 – облыстар. 1- сұйық фаза, 2-қос фазалы қоспа сұйық пен бу, 3-тек бу
30)
Су
буы. Бу түзілу процесі. Бу —
заттың газдық
фазасыөзінің [сұйық фазасы|сұйық(қатты)
фазасымен тепе-теңдікте болатын газ
тәрізді күйі. Бу менгазұғымы,
көп жағдайда, бір-бірінен шартты түрде
ғана ажыратылады.Термодинамикатұрғысынан
“Бу” және “газ” терминдерібір-біріне
пара-пар. Химиялық таза
заттарБуыныңмынадайтүрлерібар:қаныққанбу(қанығутемпературасы
мен қанығуқысымыкезіндегіБу,
басқашаайтқанда,
заттыңБуыөзініңсұйықнемесеқаттыкүйіменжылжымалы
тепе-теңдіктеболатынкүйіжәнеоныңқасиеттері
тек температураменғанаанықталады);қанықпаған
(қызған) бу(берілгенқысымдатемп-расықанығу
темп-расынанжоғарыболатынБу,
яғнитығыздығықаныққанБудан кем
болатынБу);аса
қаныққанБу (берілген
темп-радағықысымықанығуқысымынанүлкенболатынБу).
Cудың сұйықнемесеқаттыкүйден
газға (буға)
айналу процесі, сұйықтықтан қоршаған
кеңістікке өткен молекулалар саны мен
беттің қайтадан жұтқан молекулалар
саны арасындағы айырма. Кері жағдай,
яғни бетте қайта жұтылған
сұйықтық молекулаларыныңсаны
одан бөлінгенмолекулаларсанынан
көп болса, онда оны конденсация дейді.
Қар мен мүз бетінен булануды немесе
қатты фазадан сұйық фазаны айналып газ
күйіне өтуді төте булану десе, ал қар
бетіндегі сұйық фазаны айналып өтетін
конденсацияны —сублимациядейді.
Су беті немесе топырақтан булануды
физикалық булану, ал өсімдікгер
транспирациясын биологиялық булану
деп бөледі.
K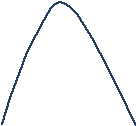
P 1 СУ 2 3
ҚОС БУ
A’
A’’ V
Сырттан жылу беріледі. A’-су булана бастайды, a’’-бу процесі басталған кездегі меншікті көлем. Цилиндрге қосымша жылу берген сайын а-а\ арасында құрғақ қаныққан бу пайда болады. Қос фазалы қоспаны- ылғалды қаныққан бу обл д.а. Ылғ қан бу- қайнаған су мен + құрғақ қаныққан бу.
Қатты дененің Булануы сублимациядепаталады.Буланупроцесікезкелгентемпературадажүруімүмкін, бірақолтемпературажоғарылағансайынтезірекөтеді. ЖабықыдыстағыБуланупроцесісұйықтықтың не қаттыдененіңүстіндегікеңістікқаныққанбуғатолғаншатұрақтытемпературадажүреді. Қаныққанбудыңқысымы тек температурағағанатәуелдіжәнеол температура жоғарылағансайынартыпотырады. Егерқаныққанбудыңқысымысыртқықысымғатең не артықболса, ондаБулануқайнаупроцесінеайналады. Қайнаудыңеңжоғарытемпературасыберілгензаттыңалмағайыптемпературасыболыпесептеледі.[2] Оданжоғарытемпературадасұйықтық пен будыңарасындағы тепе-теңдіккүйсақталмайды. Сұйықтықбуғаайналуыүшіноныңқұрамындағымолекулаларілініскүшінжеңуікерек. Осы күштіжеңуге (шығужұмысы) жәнетүзілгенсыртқыбудыңқысымынжеңугежұмсалатынжұмысмолекулалардыңжылулыққозғалысыныңкинетикалықэнергиясыесебіненатқарылады. Буланусалдарынансұйықтықтыңтемпературасытөмендеп, салқындайды, сондықтанБуланупроцесітұрақтытемпературадажүруіүшіноғанүнеміжылуберіпотырукерек. Заттыңбірлікмассасынтұрақтытемпературадабуғаайналдыруғақажеттіжылумөлшерібуланужылуыдепаталады. Буланупроцесітехникада (іштенжанатынқозғалтқышта, салқындатқышқондырғыларда, т.б.) кеңіненқолданылады. Буланутабиғаттағыылғалалмасудыңнегізіболыптабылад
31) Су ж/е су буының параметрлерін анықтау. Қайнаған су, құрғақ қаныққан будың параметрлерін кестеден алуға болады. Олар эксперименттен табылған. Кестедегі 1’- қайнаған суға қатысты , 2’ – құрғақ қаныққан буға қатысты
Құрғақ қаныққан бу
1) V’ж/е V’’ меншікті көлем
2)S’ж/е S’’ энтропия
3)h’ ж/е h’’ энтальпия
Ылғалды
қаныққан бу

r-бу түзілу жылуы
1 кг ылғ.қаныққан бу , құрғақ қанныққан бу Х кг-массалық бөлігі қайнаған су 1-Х кг
Құрғақ қаныққан будың массалық бөлігін құрғақтық дәрежесі д.а. ж/е оны Х пен белгілейді.
Ал қайнаған судың массалық бөлігін ылғалдық дәрежесі д.а. Оны 1-Х деп белгіліейді. 1 кг ылғ буға
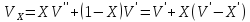
 )=
)=
32.Су буының Ts диаграммасы

A’-
судың үштік нүктесі (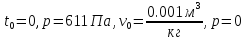 )
)
A’k- қайнаған су;
КВ’- кез келген нүктесі құрғақ қаныққан бу
 –
– -
қос фаза(қайнаған су+бу)
-
қос фаза(қайнаған су+бу)
Температура, қысым артқан сайын аудан артады. Керісінше құрғақ кемиді.
K оң жағында қыздырылған бу, энтропия
күрт жоғары кетеді.
оң жағында қыздырылған бу, энтропия
күрт жоғары кетеді.
A’kB’’- астындағы аудан жұмыс денесіне берілген жылуға тең
33.Су буының һs диаграммасы


A'-
үштік нүкте (T=0, )
)
A’KB”- қисығының асты екі фазалы орта
KB”- сызығының үсті жағы –қыздырылған бу, қыздырылған буға келген кезде изобара тіктігі артады. Қос фазалы ортада изобаралардың да тіктігі арта береді.
A’KB”- қос фазалы ортадағы температураны табу үшін бұрыштық тангенс формуласы пайданылады.

hS диаграммасында к критикалық нүкте вертикаль бойында орналасады.
34.Су буының негізгі термодинамикалық процестері
A’-
судың үштік нүктесі(t=0, p=611Па,
 )
)
 -647К
-647К
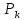 -221000Па
-221000Па
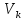 -0,00336м3/кг
-0,00336м3/кг
Процесс-изотермалы, изобаралы. Қайнаған судың меншікті көлемі өседі, құрғақ қаныққан будың меншікті көлемі кемиді, к нүктесінде теңеседі. Су фазасы жоғалып, газ фазасы қалады.
Қайнаған су мен құрғақ қаныққан бу нүктелері температура артқан сайын бір-біріне жақындайды, к нүктесінде бір-біріне теңеседі.
35. Ылғалды ауа
Ылғалды ауа - құрғақ ауаменен су буының қоспасы. Қаныққан ылғалды ауа- қаныққан су буыменен құрғақ ауаның қосындысы. Концентрация, Температура мен қысымға байланысты өзгереді.
Ылғалды
ауа- идеал газ теңдеуіне бағынады.
Мысалы: Дальтон заңы:
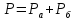
Төменгі қысым мен температурада орындалады.
Ауаның
абсолют ылғалдылығы:
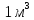 ылғал ауа алайық, онда тығыздығы
ылғал ауа алайық, онда тығыздығы ға
тең су буының массасын айтамыз.
ға
тең су буының массасын айтамыз.
Салыстырмалы ылғалдылық – ауаның абсолют ылғалдылығының берілген температурада максимал мүмкін болатын, максимал ылғалдылыққа қатынасын айтады.
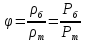
Ауаның ылғал қоры-

Идеал газ теңдеулерін пайдаланып мынадай формула алуға болады:
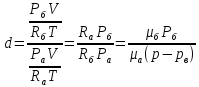
Егер

 ;
;
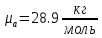
𝑑=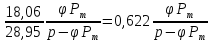 ;
;
𝜑=
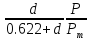
36.Ағып шығудың негізгі теңдеулері
Газдар мен булардың ағып шығуы жылутехникада өте маңызды.
Газ қозғалыс күйңің өту процессі термодинамикаға бағынады. Жүйеге жылу беріледі, ішкі энергия артады, жұмыс атқарылады, сыртқы кинетикалық энергия өзгерісі
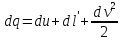
Ұзындықтары, кірер қима, шығар қима реттеліп отырады, пайдалануына байланысты. 3 бірігіп арна дейді. Газдың арнамен қозғалыс кезінде қысым келіп, жылдамдықтың үлкеюі тарапынан газ ұлғайса – сопло деп атаймыз.
Газдың арнамен қозғалыс кезінде қысым артып, жылдамдықтың кемуі тарапынан газ сығылса – диффузор.
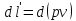
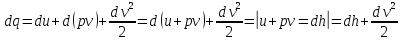
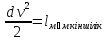
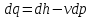

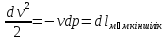
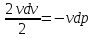
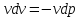
Газ қозғалысы кезінде қысымның өзгерісі 0-дан үлкен болса, газ сығылады, жылдамдықтың өзгерісі 0-ден кіші dP>0, dv<0
Газ қозғалысы кезінде қысымның өзгерісі 0-ден кіші болса газ ұлғаяды. Жылдамдық өзгерісі 0-ден үлкен. Dp<0, dv>0
37. Ағып шығу кезіндегі политропты және адиабатты процестер бойынша мүмкіншілік жұмыстары. Адиабатты процесс кезңндегі ағып шығу жылдамдығы.

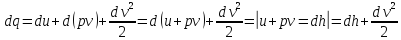

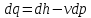

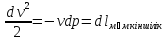
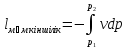
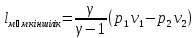
Арнадан ағып шығу жылдамдығы:
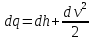
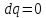


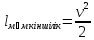
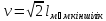
38. Тарылған соплодан ағып шығу. Ағып шығу жылдамдығы.

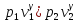
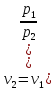
Ағып шығу жылдамдығы:
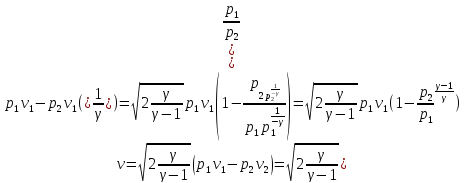
39. Тарылған соплодан ағып шығу. Ағып шығудағы газдың массалық мөлшері

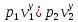
Ағып шығудағы газдың массалық мөлшері:

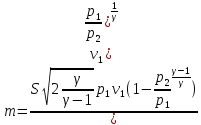
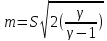 (
( )
)
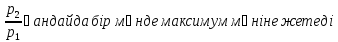
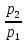 қатынасы
әрі қарай азайса, масса 0-ге тең болады
қатынасы
әрі қарай азайса, масса 0-ге тең болады
40. Критикалық кысымның соплоға кірер қимадағы қысымға қатынасын есептеу
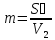

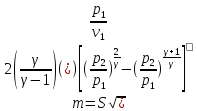


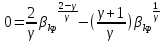
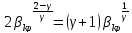


41. Критикалық жылдамдықты есептеу
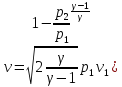
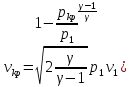


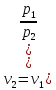

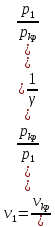
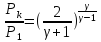

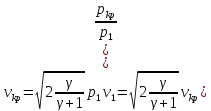 =
=
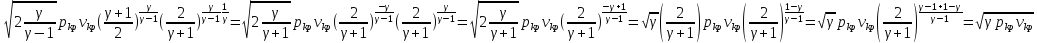


42.Критикалық жылдамдық пен дыбыс жылдамдығының байланысы.
Термодинамикалық процесс, адиабаталық процесс
a=
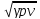 , а
– дыбыс жылдамдығы
, а
– дыбыс жылдамдығы
PV=RT
акр
=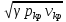
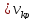
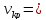 акр
тарылған
соплодағы газ жылдамдығы дыбыс
жылдамдығына тең.
акр
тарылған
соплодағы газ жылдамдығы дыбыс
жылдамдығына тең.
43.Қимасы айнымалы соплодан ағып шығу шарттары.
m=
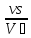 үзіліссіздік теңдеуінен алынған.
үзіліссіздік теңдеуінен алынған.
vs=mv
m=const
d(vs) = d(mv)
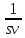 (sdv
+ vds)
= mdv
(sdv
+ vds)
= mdv
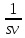
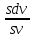 +
+
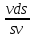 =
=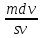 =
=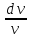
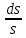 =
=
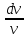 -
-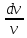
pvᵞ = const
d(pv)ᵞ =0
p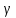 vᵞ-1
dv +vᵞ dp = 0
vᵞ-1
dv +vᵞ dp = 0
p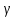 vᵞ-1
dv = - vᵞ dp
vᵞ-1
dv = - vᵞ dp
vᵞ-1
v-ᵞdv
= -
vᵞ-1-ᵞ
dv = -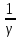

 =
-
=
-
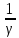
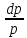
44.Арналар үшін жылдамдықтың өзгерісін қысымның өзгерісімен байланыстыру.
vdv = - vdp
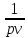 v
dv=
- vdp
v
dv=
- vdp
 =
-
=
-
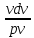 =
-
=
-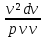
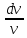 =
=
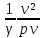
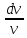
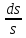 =
=
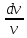 -
- =
=
 -
- = (
= ( - 1)
- 1)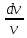 = (
= (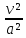 - 1)
- 1)
a=
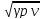
 pv
= a²
pv
= a²
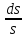 =
(
=
(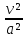 - 1)
- 1) соплоның
шығар қимасының ауданының өзгерісі.
соплоның
шығар қимасының ауданының өзгерісі.
v˂ a егер сопло ішіндегі газ жылдамдығы дыбыс жылдамдығынан аз болса, онда қимасының өзгерісі ds˂0.
v˃ a егер сопло ішіндегі газ жылдамдығы ds˃0 дыбыс жылдамдығынан көп болса, онда сопло қимасының өзгерісі артады.
45.Газдар мен буларды дроссельдеу. Дроссельдеу – құбыр ішіндегі газ немесе бу қозғалысы кезінде көлденең қима табиғи және жасанды түде азаюы мүмкін. Табиғи түрде – газ бенбу аққан кезде қабат пайда болуы мүмкін, соыған байланысты көлденең қима азаяды. Сыртқы жұмыс атқарылмай көлденең қимада қысым азайып кетуі – дроссельдеу. Құбыр ішіде саңылау пайда болады, ол табиғи н/е әдейі болуы да мүмкін.
P1→ P2 бұрыңғы қысымның орны толмайды
P1˃
P2
, v1
=
v2
,
h1
-
h2
=
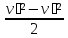
h1 - h2 = 0, h1 = h2 =const
46.Бір поршенді сығымдағыш. Сығымдағыш деп газды сығатын құрылғыны айтады. Басында поршень сол жақ шетінде болады, ішінде газ жоқ. Поршень оңға қарай қозғалғанда поршень астында вакуум пайда болады. Қысымдар айырымынан клапан ашылады, поршень астына газ кіреді (газ тұрақты).
График
1-нүктеге келгенше қысым өзгермейді
1→2 процесс адиабатты, политропты ж/е изотермді болуы мүмкін
V2 жеткесін поршень газды сыға алмайды.
V2 жеткенде клапан автоматты түрде ашылып, газ резервуарға кетеді.
Клапан ашылғасын поршенмен итеріп түгелін шығарып жібереді, ол кезде қысым P2.
Газ сығатын жұмыс – сыртқы техникалық жұмыс, оны атқаратын электр двигателі (ол теріс).
1-ші клапан сору клапаны, 2-ші клапан шығару клапаны.
Lc=
- Lтех=
-
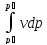 =
=

Жұмыстың геометриялық мағынасы pv диаграммасындағы ауданы.
График
1-2’’ – адиабата
1-2’- политропты
1-2 –изотерма
01230 – изотерма кезінде алынатын жұмыс
Поршенді (цилиндрді) суытып отырып изотерма кезінде, ол процесс өте күрделі. Изотерм тиімді.
Сондықтан көбіне политропты қолданады.
Процесс қайтымды, сығымдағыш идеалды.
Идеалды сығымдағыштың жұмсайтын жұмысын политропты процесте қарастырайық:
V=
( )1/n
V1
; Lc
=
)1/n
V1
; Lc
=
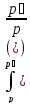 1/n
v1dp
=
1/n
v1dp
=
 p1
v1
[
(
p1
v1
[
( )(n-1)/n
-1]
)(n-1)/n
-1]
Lc –идеалды сығымдағышпен жұмсалатын теориялық жұмыс.
47.Көп сатылы сығымдағыш. 1-поршеньді сығымдағыштан алынатын (жылудың мәні) қысымның деңгейі үлкен емес. Сондықтан үлкен қысым алу үшін көп сатылы қолданылады, бірнеше поршень тізбектей жалғанады, компрессерлер арасында жылуалмастырғыш. Сығылу политропы, 1-поршенде жұмыс біп поршендегідей, политропия б/ша 2-нүктеге келеміз 1-ші цилиндр астында газ толды, газ толғасын 2-ші поршенге кетеміз, 2-3 кезінде 1-поршеннен 2-шіге беріледі. График
Жылуалмасқыш циркуляциясы суытқыш. 2-ші цилиндрге келген газы политроппен сығамыз қысым артады, содан 3-шіге береміз, 3-поршенде қысым артып резервуарға беріледі. Изотермалық процесте сыртқы жұмыс минималды 1,3,5,7.
Оларға реалды түрде жақындау үшін цилиндр санын көбейтеді, бірақ оның шығыны көп.
48.Сығымдағышқа
кері принципте жұмыс істейтін механизмді
вакуумдық насос деп атайды. Вакуумдық
насос берілсін. Насостың көмегімен
берілген көлемдегі газды сыртқа шығару
керек. Әр цикл сайын насостың ΔV газ
шығарылады. Қанша циклдан кейін қысым
 есе азаяды.Процесс изотермалы,газ
идеалды.
есе азаяды.Процесс изотермалы,газ
идеалды.
1-цикл
PV=RT
P0V
= const =
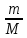 RT
RT
P1(V+ΔV)
=
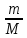 RT
RT
P0V = P1 (V+ΔV)
P0
= P1
2-цикл
P1V
=
 RT
RT
P2(V+ΔV)
=
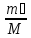 RT
RT
P1V = P2 (V+ΔV)
P1
= P2
P0
= P2
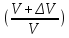 2
2
3-цикл
P2V
=
 RT
RT
P3(V+ΔV)
=
 RT
RT
P2V
= P3
(V+ΔV) P0
= P3
 3
3
P2
= P3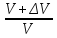 P0
=
Pn
(
P0
=
Pn
(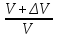 )n
)n
49. Реактивті қозғағыштың циклы. Реактивті қозғағыш газ турбиналы қондырғыға ұқсас. Бірақ кішкене айыриашылығы бар. Қандай да бір нысандарға іргелімелі қозғалыс беру – РАКЕТА. Мұнда массасы айнымалылардың механикасын қолданамыз- Мещерский теңдеуі
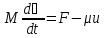
Мұндағы
М-ракетаның бүкіл массасы+отын массасы,
F-сыртқы
күш, -жанған
отынның өнімінің секундтық шығыны
,
-жанған
отынның өнімінің секундтық шығыны
, -жанып
шыққан отынның ракетамен салыстырғандағы
жылдамдығы,d
-жанып
шыққан отынның ракетамен салыстырғандағы
жылдамдығы,d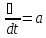 -үдеуі,-
-үдеуі,- реакция
күші.
реакция
күші.
Реактивті қозғағыштың схемасы
1-диффузор,, 2-жану камерасы,, 3-форсункалар
3
2
ауа
1 2
Отын



КР

3
50.Бу турбиналық қондырғының циклдары. Карно циклі.
1-бу қазаны, 2-бу қыздырғыш (жылуалмасқыш), 3-бу турбинасы, 4-электр двигателі, 5-конденсатор (кейде суытқыш), 6-насос, 7-резервуар, 8-насос қосымша, 9-қыздырғыш қосымша.
Карно циклі – идеалды цикл, қаныққан бу циклі
Х=0 құрғақтық дәрежесі
I – нөлдік изотерма
II – қисықтың бойы қайнаған су,сол жағы қайнамаған су; III – сызық құрғақ қаныққанбу, оң жағы қыздырылған бу. II мен III арасы ылғалды бу, екі фазалы орта ( су+бу).
1 мен 0 – бу түзілу процесі;
0 – қайнаған су басталуы;
1 – бу басталады, құрғақ қаныққан бу;
– көлем ұлғаяды, темп-а азаяды, сондықтан жылу беріп отырады q1 = r1
1-2 – адиабаталық ұлғаю, қысым төмендейді, темп-а төмендейді, конденсациялану ұлғаяды (бірақ қосымша конденсатор қолданылады);
Х=1 – құрғақтық дәрежесі 1-ге тең;
2-3 – изобаралық сығылу, сығымдағышпен жылу алынады, Ван-дер-Ваальс изотермасы;
3 – бу толығымен сұйыққа айналмайды;
3-0 – адиабаталық сығылу, бу толығымен суға айналады.
ɳ
=
 =
=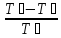 =
=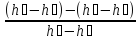
Иермиялық ПӘК-і
q = r = h’’- h’ берілетін жылу бу түзілуіне тең.
Карно циклінің кемшілігі 2-3 изобарамен келген кезінде будың толығымен сұйыққа айналмауы. Осы кемшілігін жоятын Ренкин циклі.
51.Ренкин циклі (нақты цикл). Тиімділігі: буды толығынмен суға айналырады; қаныққын будан кейін газды қыздырады, сөйтіп барып адиабаталық сығылады. График
4-5 – бу түзілу;
5-6 – буды кептіру,буды қаныққан құрғақ буға жетпей жатып кептіре бастайды;
6-1 – құрғақ қаныққан буды қыздыру;
1-2 – адиабаталық ұлғаю, конденсациялану;
2’’ – сығымдағыш арқылы бірден келеді, бу толығымен суға айналады;
3 – сығымдағышпен келеді, суды сығып бастапқы қысымға келдік;
3-4 – бу қазанының көмегімен суды қайнау темп-на келік.
График
4-5 – бу түзілу;
5-6 – буды кептіру;
6-1 – буды қыздыру құрғақ;
1-2 – адиабаталық ұлғаю;
2’’ – бу толығымен суға айналады;
2’’-3 – насос көмегімен сығады;
3-4 – төменгі темп-лы сұйықты қыдырған суға әкелдік.
032’’7 – насостың жұмысы (PV)
22’’87910 – қосымша жұмыс (TS)
TS диаграммасында қыздырылған будың энтальпиясы h1= 9222’’34617109 –ауданы.
Будың конденсаторға кіре берісіндегі энтальпия h2=92’’27109 – ауданы.
Конденсатордан шыққан судың энтальпиясы
h2’= 92’’8109 -ауданы.
Ренкин циклындағы будың пайдалыжұмысы
L=2’’346122’’
Ренкин циклының термиялық ПӘК-і
ɳ
=
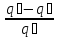 =
=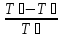 =
=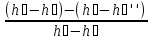 =
=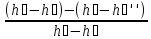
q1= h1 - h3 берілген меншікті жылу бастапқы және соңғы нүктедегі энтальпия айырмасына тең.
q1 →82’’346178 – ауданы.
q2 = h2 – h2’’ конденсатордан әкетілген жылу мөлшері.
q2 → 2’’2782’’ – ауданы.
52.Негізгі параметрлердің Ренкин циклына әсері.
1.Бастапқы қысымның әсері .Егер будың қысымы артса,тұрақты соңғы қысымда бутурбиналы қондырғының ПЭКі артады,ал будың меншікті мөлшері азаяды.Бастапқы қысымның p1–ден p1- ге дейін өсуі қаныққан будың температурасының өсуіне, демек жылу берудің орта температурасының артуына әкеліп соғады да, циклдің ПӘКі үлкейеді. Ал hs -диаграммасынан көрініп тұрғандай , будың бастапқы қысымының өсуімен бірге адиабатты жылуқұламасы h1 артады, бірақ будың соңғы ылғалдылығы көбейіп турбинаның ақырғы сатыларының қалақтарын талқандауды тездетеді.Будың соңғы ылғалдылығы 13-14% тен аспауы керек.Қазіргі кезде 30,0Мпа-ға дейінгі қысымдар игерілуде.2 График
2.Бастапқы темпертураның әсері.Будың бастапқы температурасы артуымен бірге жылу берудің ортаинтегралды температурасы артады және адиабатты жылуқұлама h өседі. Температура мен бастапқы қысым да артса, онда циклдың ПӘКінің өсу қарқындары еді.Мысалы, бастапқы қысым 2,0 МПа болғанда, температураның 400-ден 500oC- қа дейін өсуі циклдың ПӘКін 0,032 ден 0,355- ке дейін арттырады.Ал егер сол уақытта қысымды да 20,0 МПа ға дейін арттырса,онда цикл ПӘКі 0,405- тен 0,434-ке дейін артады. Бастапқы температураның өсуі сонымен бірге будың меншікті мөлшерін кемітеді.Қазіргі кезде температурасы 600oC және одан да жоғары бу игерілуде.Будың температурасын көтеру металдың төзімділігіне байланысты,сондықтан ыстыққа төзімді төмен бағалы металдардың көптен өндірілуі қажет.
График
3.Конденсатордағы соңғы қысымның әсері.Конденсатордағы соңғы қысымның кемуі циклдың термиялық ПӘКін арттырудағы өте тиімді құрал болып табылады. hs диаграммасынан көрінгенлеі кондесатордағы қысымның кемуі жылу бұрып алудың ортаинтегралды температурасын кемітеді және адиабатты жылуқұламасын h арттырып, соған сәйкес циклдың ПӘКі де артады.Мысалы бастапқы қысым 10 МПа және температура 600oC , ал соңғы қысым 0,1 МПа болғанда цикл ПӘКі 0,308- ге тең болады да, соңғы қысымды 0,03 МПАға кемітсек ,онда цикл ПӘКі 0.356- ға дейін артады.Егер соңғы қысымды ары қарай 0,005 Мпа кемітсек , онда цикл ПӘКі 0.417 ге дейін өседі.Бірақ конденсатордағы соңғы қысым мәні буды суытатын судың температурасына байланысты болады, себебі қарқынды жылу алмасу үшін оның температурасы будың температурасынан 10-15oC қа кем болу керк.Ал төменгі қысымда будың қанығу температурасы 33oC қа дейін төмендейді.
График
53.Регенеративті цикл.Циклдың термиялық ПӘКін жылуды регенерациялау арқылы едәуір көтеруге болады.1- суретте бутурбиналы қондырғының шартты регенеративті циклы көрсетілген.Мұнда қорек суын қыздыру 2-3 процесіндегі бұрып алынған жылу арқылы жүзеге асырылады.Сонымен бірге 2-3 процесіндегі бұрып алынған жылу мөлшері (27832 ауд.)4-5 процесіндегі берілген жылуға тең болады(04590 ауд.). Бұл аудандар , егер 4-5 және 2-3 қисық сызықтары эквидистантты болғанда ғана бірөбіріне тең болады.Мұнда сыртқы жылу көзінен жұмыстық денеге әкелінген жылудың ортаинтегралды температурасы кәдімгі ренкин циклындағыдан артық болғандықтан регенеративті циклдың ПӘКі де үлкен болады.Бірақ бұл циклдағы қорек суын қыдыруға жұмсалған жылу мөлшері (27832 ауд.) будың меншікті жұмысын азайтады, демек регенеративті циклда будың меншікті мөлшері көбейеді. Пратикада қорек суын регенеративті қыздыру бір біріне тізбекті жалғанған қыздырғыштарда іске асады.Оларға бу турбинаның әр сатысынан бұрып алынады.
2-суретте қорек суын регенеративті қыздыратын үш алымды бутурбиналы қондырғының нобайы көрсетілген.Мұнда: 1-бу қазаны , 2-буқыздырғыш, 3-бу турбинасы, 4-конденсатор,5-қорек суының насосы , 6-беттік қыздырғыш,7-дренажды насос,8-қыздыру буының конденсаты ,9-қорек суы , 10-турбинадан алынған қыздыру буы. Бу қазанынан келетін будың қысымыp1 , ал конденсатордағы қысымы- p2 .Турбина арқылы будың бәрі өтпейді. Будың әр килограмынан бірінші қыздырғышқа мөлшері g1 (кг) қысымыp’ , екінші қыздырғышқа g2(кг)қысымы p” үшінші қыздырғышқа, g3(кг) қысымы p’’’ бу алынады.Конденсаторға g(кг) бу бұрып алынады. Сонда ,
g1+g2+g3+g=1кг
Турбинадан кейінгі конденстордан алынғын конденсат насоспен (5) тізбекті жалғанған қыздырғыштар (6) арқылы қыздырылып бу қазанына келіп түседі. Қорек суын қыздырудағы регенерацияны қолдану бутурбиналы қондырғы циклының ПӘКін 10-14%-ке дейін көтереді,сонымен бірге будың алғашы параметрлері жоғары болған сайын үнемділік те өседі.
54.Жылуфикация негіздері.Бутурбиналық қондырғыға қатысты қарасытрайық.Бу турбиналарында бу өндіріледі.Соны алыс қашықтықта береді.Ренкин циклы идеалды деп қарастырайық 50%қа төмендейді,идеал циклда көптеген заттар қарастырылмайды.Бу турбинасында су бар,конденсаторда шығын бар ренкин циклы 30-35% төмендейді.ПӘК нақты жағдайда көтеру керек.Электр энергиясымен қосылып есептейді.Алынған буды алыс қашықтықта беру үшін P2 көтереміз.График
15761 ауд.- конденсатордың жылу шығыны
Бу бір бөлігін басқа жаққа беруге болады.Коммуналды шаруашылыққа қолдану керек.Мысалы, монша немесе тамақтандыру комбинаттарында т.б.кішігірім нысандарда. P2 -қысымды
1)0,1-0,15 МПа
2)0,2-0,5МПа ал буды ірі кәсіпорындарға беруге болады.
1 және 2 жағдайларда электрэнергиясымен қоса жылу энергиясы да алыс қашықтықта беріледі. Ондай қондырғыларды жылуфикация қондырғылары дейді. Жылуфикациянф ресми түрде жылуэлектр орталықтар деп атайды.ТЭЦ. ЖЭО да конденсатор жоқ.
График
1-бу қазаны,2-буқыздырғыш,3-бу турбинасы,4-электр двигателі,5-жылуды тұтынушы , 6-насос
55.Суытқыш қондырғыларды циклдары.Суытқыш деп дененің температурасының сыртқы қоршаған ортаның температурасынан төмен жағдайда ұзақ уақыт ұстап тұратын қондырғы.Суытқыш қондырғы екі топқа бөлінеді: 1-топ газды немесе ауалы суытқыш қондырғылар тиімділігі көп емес.Электр энергиясын көп тұтынады.
2-топ.Сығындағыш бумен жұмыс істейтін қондырғылардың жұмыс денесінің орнын басатын әр түрлі денелерлің булары.Аммиак буы,көмірқышқылгазы буы,фреон буы,күкірт ангередериді.Суытқыш қондырғының циклдары кері цикл.Идеалды Карноның кері циклы.
График
2-3 процесс кезінде суытылатын денеден жылу алынады.Суытқыш агентке беріледі.( Фреон)
4-1 процесс кезінде енді суытқыш агенттен жылу қоршаған орта жылытқыш q2=23652 ауд; q1=14651 ауд; l=q1-q2=14321
суытқыш коэф:ε=q2/l
Жылу: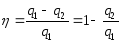
56.Ауалы суытқыш қондырғы циклдары.Ең қолайлы , зиянсыз және арзан жұмыстық денен ретінде ауа қолданылатын ауалы суытқыш қондырғының нобайының қарастырайық. Оның жұмыс істеу реті былайша : бөлмені 1 суытқан ауа сығымдағышта 2 қысылады да, температурасы көтеріледі.Қысылған ауа тұрақты қысымда жылуалмасқышқа 3 жіберіліп қоршаған ортаның температурасына дейін суытылады.Одан соң суытылған және қысылған ауа ұлғаю цилиндіне немесе детандерге 4 жіберіліп , онда алғашқы қысымға дейін ұлғаяды.Ұлғаю кезінде оның температурасы -60 немесе -70oC- қа дейін төмендеп, бөлмені суытуға жіберіледі.Ауалы суытқыш қондырғысының идеалды циклын pv және Ts диаграммаларында қарасытрайық.
Ауа 1-2 процесінде p1 қысымнан p2- ге дейін адиабатты сығылады.Изобарлы 2-3 процесінде ауадан q1 мөлшерде жылу сыртқы жылу көзіне беріліп, оның температурасы T2ден T3 ке дейін төмендейді. 3-4 процесіндегі адиабатты ұлғаюда ауа T3 тен T4ке дейін қосымша суытылады.Ары қарай 4-1 изобарлы процесінде суытылатын бөлмеден q2 мөлшерінде жылу алынып, ауаның температурасы T4 тен T1- ге дейін қыздырылады. Жұмсалынған жұмыс мөлшері меншікті жұмыс мөлшерінің айырмасына тең.
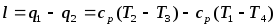
Циклдың суытқыш коэф.
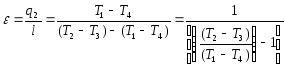
мұнда
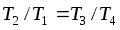 болғандықтан
, пропорция қасиеттеріне сәйкес
болғандықтан
, пропорция қасиеттеріне сәйкес
сонымен
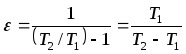
мұнде T1 суытылатын бөлменің немесе сығымдағышқа түсетін ауаның температурасы , T2 -сығылған ауаның температурасы.Егер суытқыш қондырғының нақты циклын Карно циклымен ауыстырса , онда ол бойымен өтер еді. Сондықтан кері Карно циклының суытқыш коэф.
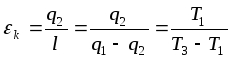
T3>T2болғандықтанεk> ε. Ауалы суытқыш қондырғы циклдары термодинамикалық тұрғыдан қарағанда жетілмеген,ал қондырғылардың тиімділігі аз және олар қолапайсыз ауыр болады.
