
metodichka_molekulyarka_i_mekhanika
.pdfИз формулы (5) видно, что для определения α необходимо знать поток тепла от проволоки к стенке, геометрические размеры трубки, проволоки и температуру стенки и проволоки.
В том случае, когда количество теплоты, передаваемое стенке конвекцией и излучением, а также тепловые потери через электровходы и торцы прибора малы по сравнению с количеством теплоты, передаваемым вследствие теплопроводности воздуха, можно считать, что подводимая электрическая мощность Р равна тепловому потоку, обусловленному теплопроводностью. Количество теплоты, выделившееся в единицу времени, можно определить по показаниям вольтметра и амперметра по закону Джоуля – Ленца:
Q = P = IU , |
(6) |
где I – ток; U – напряжение на концах проволоки.
Температуру проволоки Т1 при различных силах тока можно определить, измеряя сопротивление проволоки и считая, что оно
связано с температурой линейно: |
|
Ri = R0 (1+ σti ), |
(7) |
где Ri – сопротивление проволоки при температуре ti; R0 – сопротивление проволоки при температуре 0 °С; σ – температурный коэффициент сопротивления.
Сопротивление проволоки измеряется с помощью амперметра и вольтметра.
По закону Ома для участка цепи
R = UI . (8)
При малых токах (~ 0,4 А и меньше) нить практически не нагревается и ее температура равна температуре окружающей среды t2. Этой температуре соответствует сопротивление проволоки R2. Нагревая проволоку, увеличиваем ток в цепи при помощи реостата 6. Для каждой определенной температуры ti будем получать значения Ri. Зная R2, R1, σ, t2, из уравнения (7) можно найти температуру нагретой проволоки t1:
121
t |
= |
R1 (1+ σt2 ) − R2 |
. |
(9) |
|
||||
1 |
σR2 |
|
||
|
|
|
||
Подставляя значения Q, r1, r2, l, t1 и t2 в формулу (5), получим α.
Порядок выполнения работы
1.Ознакомьтесь с электроизмерительными приборами. Определите и запишите цену наименьшего деления шкалы каждого прибора.
2.Соберите измерительную схему (см. рис. 1).
3.КлючК должен бытьразомкнут, авыпрямитель 5 выключен.
4.Убедившись в правильности собранной схемы, включите выпрямитель, замкните ключ К и при помощи реостата установите значение тока I = (0,3 … 0,4) А. Запишите значение напряжения при этом токе.
Вычислите сопротивление проволоки при температуре охлаждающей воды и при отсутствии охлаждения, т.е. при температуре окружающей среды.
5.Снять зависимость U = f (I) при следующих значениях
тока: I = 1,4; 1,6; 2,0; 2,2; 2,4; 2,6; 2,8 А с интервалом в 4 мин.
6. Вычислите сопротивления R1, R2, подводимую мощность P, температуру проволоки t1, значения коэффициента теплопро-
водности α, температуру газа определите как tcp = t1 + t2 .
2
7. Постройте график зависимости коэффициента теплопроводности от температуры.
Контрольные вопросы
1.В чем заключается механизм теплопроводности?
2.От чего зависит коэффициент теплопроводности идеального газа?
3.Как зависит α от температуры и почему?
122
4.Как с точки зрения молекулярно-кинетической теории объяснить независимость α идеальных газов от давления? (При не слишком малых давлениях.)
5.Как скажется на значении α пренебрежение потерями количества теплоты через торцы и потерями на излучение? Как скажется пренебрежение явлением конвекции?
Список рекомендуемой литературы
1.Савельев, И. В. Курс общей физики. В 3 т. Т. 1 / И. В. Са-
вельев. – M. : Наука, 1982. – 432 с.
2.Лабораторные занятия по физике / под ред. Л. Л. Гольди-
на. – М. : Наука, 1983. – 340 с.
Лабораторная работа № 2-9
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ВОЗДУХА ИГАЗОВОЙПОСТОЯННОЙМЕТОДОМОТКАЧКИВОЗДУХА
Цель работы: изучение уравнения состояния идеального газа (изохорический процесс).
Оборудование: баллон для воздуха, установка для взвешивания или технические весы, манометр, термометр, разновесы.
Введение
Для характеристики масс атомов и молекул применяются величины, получившие название относительной атомной массы элемента (сокращенно – атомной массы) и относительной молекулярной массы вещества (сокращенно – молекулярной массы).
Атомной массой химического элемента называется отношение массы атома этого элемента к 1/12 массы атома С12 (изотоп углерода с массовым числом 12). Молекулярной массой вещества называется отношение массы молекулы этого вещества к 1/12 массы атома С12. Как следует из этих определений, атомная и молекулярная массы являются безразмерными величинами.
123
Единица массы, равная 1/12 массы атома С12, называется
атомной единицей массы (а.е.м.).
Количество вещества, в котором содержится число частиц (атомов, молекул, ионов, электронов и т.д.), равное числу атомов в 0,012 кг изотопа углерода С12, называется молем. Употребляются также кратные и дольные единицы: киломоль, миллимоль, микромоль и т.д.
Число частиц, содержащихся в моле вещества, называется числом Авогадро. Опытным путем найдено, что число Авогадро равно
NA = 6,022 1023моль−1.
Массу моля, выраженную в граммах или килограммах, на-
зывают молярной массой.
Определение молярной массы воздуха основано на уравнении состояния идеального газа. Состояние заданной массы газа определяется значениями трех параметров: давления Р, объема V и температуры Т. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение других. Указанная связь определяется уравнением состояния идеального газа
PV = |
m |
RT. |
(1) |
|
|||
|
μ |
|
|
Уравнение (1) справедливо лишь для идеального газа. Идеальным называется газ, взаимодействие между молекулами которого пренебрежимо мало. Всякий реальный газ при достаточном разрежении близок по своим свойствам к идеальному. Некоторые газы, такие как воздух, азот, кислород, даже при обычных условиях, т.е. при комнатной температуре и атмосферном давлении, мало отличаются от идеального газа.
Пусть воздух в открытом баллоне занимает объем V0 , масса его m1, давление атмосферное P1. Накачаем баллон воздухом до давления Р2. Теперь масса воздуха в баллоне будет m2.
124
Запишем уравнение (1) для этих двух состояний:
PV = m RT μ; |
(2) |
||
1 |
0 |
1 |
|
P2V0 = m2 RT μ. |
(3) |
||
Вычитая из (3) (2), выразим молярную массу μ воздуха:
μ = |
m2 |
− m1 RT |
= |
m |
|
|
RT |
|
|||
|
|
|
|
|
|
|
. |
(4) |
|||
P |
− P |
|
V |
P − P |
V |
||||||
|
2 |
1 |
0 |
|
2 |
1 |
0 |
|
|
||
Таким образом, зная объем баллона при разных давлениях, можно найти молярную массу воздуха.
Описание установки
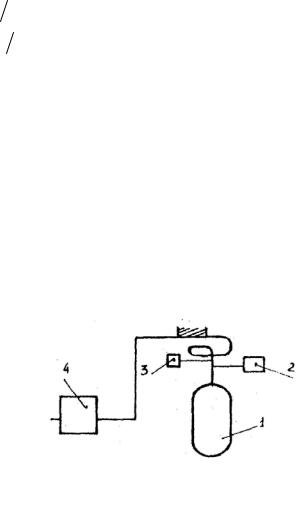
Экспериментальная установка, представленная на рисунке, содержит баллон 1 с манометром 2 и вентилем 3, воздушный компрессор 4 и устройство для взвешивания (на рисунке не показано).
Взвешивать необходимо с достаточно высокой точностью и на эту операцию обратить особое внимание.
Уравнение (1) позволяет определить и газовую постоянную R.
Порядок выполнения работы
1.Баллон с открытым краном взвесить на весах и опреде-
лить суммарную массу (m0+m1) колбы m0 и содержащегося в ней воздуха m1.
2.Накачать баллон до некоторого давления Р2. При этом манометр покажет разность между атмосферным давлением и давлением в баллоне (колбе).
3.Закрыть кран и на аналитических весах вновь определить
суммарную массу (m0+m2) колбы-баллона m0 и содержащегося в нем воздуха m2.
4.Определить массу откачанного воздуха как разность
(m0 + m2 ) − (m0 + m1 ) = m2 − m1 .
125
5.Измерить температуру воздуха в лаборатории.
6.Подсчитать по формуле (4) молярную массу воздуха.
7.Подсчитать газовую постоянную по формуле
|
μ (P2 − P1 ) V |
|
||||
R = |
|
|
|
0 |
. |
(5) |
(m |
− m ) |
|
||||
|
|
T |
|
|||
|
2 |
1 |
|
|
|
|
8.Опыт произвести не менее трех раз.
9.Определить средние значения универсальной газовой постоянной и молярной массы воздуха, вычислить погрешность измерения μ и R .
Контрольные вопросы
1.Сформулируйте закон Авогадро и определите согласно этому закону значение универсальной газовой постоянной.
2.Запишите уравнение состояния идеального газа в трех известных формах.
3.Что такое молярная масса воздуха?
4.От чего зависит молярная масса газа?
5.Какие измерения необходимо произвести, чтобы рассчитать газовую постоянную и молярную массу воздуха?
6.Каким другим способом экспериментально можно измерить универсальную газовую постоянную?
Дополнительное задание
Определить плотность воздуха и построить график зависимости ее от давления.
Список рекомендуемой литературы
1.Савельев, И. В. Курс общей физики. В 3 т. Т. 1 / И. В. Са-
вельев. – M. : Наука, 1982. – 432 с.
2.Лабораторный практикум по физике / под ред.
А. С. Ахматова. – М. : Высш. шк., 1980. – 360 с.
126
ОГЛАВЛЕНИЕ |
|
Предисловие........................................................................................................ |
3 |
ОБЩИЕ ПОЛОЖЕНИЯ................................................................................. |
4 |
Элементарная обработка результатов физического эксперимента............... |
4 |
Представление экспериментальных результатов ......................................... |
12 |
Приближенные вычисления............................................................................ |
13 |
Оформление отчета.......................................................................................... |
14 |
Раздел 1. МЕХАНИКА.................................................................................... |
16 |
Лабораторная работа № 1-1. Исследование распределения |
|
результатов физических измерений........................................................... |
16 |
Лабораторная работа № 1-2. Определение плотности твердых |
|
тел пикнометром............................................................................................ |
20 |
Лабораторная работа № 1-3. Изучение динамики поступательно- |
|
го движения..................................................................................................... |
23 |
Лабораторная работа № 1-4. Определение скорости полета тела........... |
27 |
Лабораторная работа № 1-5. Изучение динамики вращательного |
|
движения твердого тела................................................................................ |
42 |
Лабораторная работа № 1-6. Определение приведенной длины |
|
физического маятника.................................................................................. |
48 |
Лабораторная работа № 1-7. Определение главных моментов |
|
инерции методом крутильных колебаний................................................ |
54 |
Лабораторная работа № 1-8. Определение коэффициента трения |
|
качения поверхностей металл-металл методом наклонного ма- |
|
ятника............................................................................................................... |
63 |
Лабораторная работа № 1-9. Определение модуля сдвига метал- |
|
лов методом крутильных колебаний......................................................... |
68 |
Лабораторная работа № 1-10. Определение модуля Юнга метал- |
|
лов методом растяжения проволочных образцов ................................... |
73 |
Лабораторная работа № 1-11. Изучение зависимости линейной |
|
деформации от напряжения в пластмассах и эластомерах................... |
77 |
Лабораторная работа № 1-12. Изучение вращательного |
|
движения диска............................................................................................... |
81 |
127 |
|
Раздел 2. МОЛЕКУЛЯРНАЯ ФИЗИКА..................................................... |
85 |
Лабораторная работа № 2-1. Определение вязкости воздуха |
|
и средней длины свободного пробега молекул воздуха.......................... |
85 |
Лабораторная работа № 2-2. Определение коэффициента вязко- |
|
сти жидкости и числа Рейнольдса методом падающего |
|
в жидкости шарика........................................................................................ |
90 |
Лабораторная работа № 2-3. Определение скорости звука в воздухе |
|
и показателя адиабаты воздуха методом стоячей волны ...................... |
94 |
Лабораторная работа № 2-4. Изучение на механической модели |
|
распределения молекул газа по скоростям............................................... |
97 |
Лабораторная работа № 2-5. Определение коэффициента |
|
поверхностного натяжения воды.............................................................. |
102 |
Лабораторная работа № 2-6. Изучение температурной зависимо- |
|
сти коэффициента поверхностного натяжения жидкостей................. |
110 |
Лабораторная работа № 2-7. Определение показателя адиабаты |
|
воздуха методом Клемана – Дезорма........................................................ |
113 |
Лабораторная работа № 2-8. Исследование температурной зависимо- |
|
сти коэффициента теплопроводности воздуха....................................... |
118 |
Лабораторная работа № 2-9. Определение молярной массы воз- |
|
духа и газовой постоянной методом откачки воздуха......................... |
123 |
ФИЗИКА Методические указания к лабораторным работам по механике
и молекулярной физике
Составители БУТКОВСКИЙ Олег Ярославович ГРУНСКАЯ Любовь Валентиновна ДМИТРИЕВА Елена Валерьевна
и др.
Ответственный за выпуск – зав. кафедрой профессор В.Н. Кунин
Подписано в печать 10.05.07.
Формат 60х84/ 16. Усл. печ. л. 7,44. Тираж 1000 экз. Заказ
Издательство Владимирского государственного университета.
600000, Владимир, ул. Горького, 87.
128
