
зан.6_розпечат.студ
..docПерелік основних термінів, параметрів, характеристик, які повинен засвоїти студент при підготовці до заняття 6.
|
Термін |
Визначення |
|
Буферні розчини
|
Буферними називають розчини, які мають властивість досить стійко зберігати сталість концентрації іонів Н+ при додаванні помірних кількостей сильної кислоти або лугу, а також при розведенні. |
|
Кислотні буферні розчини |
Кислотні буферні розчини - це розчини, які складаються із слабкої кислоти та солі цієї слабкої кислоти і сильної основи, наприклад, ацетатний буферний розчин (CH3COOH + CH3COONa) |
|
Основні буферні розчини |
Основні буферні розчини - це розчини, які складаються із слабкої основи та солі цієї слабкої основи і сильної кислоти, наприклад, аміачний буферний розчин (NH3·H2O + NH4Cl); |
|
Рівняння Гендерсона-Гассельбаха для кислотних буферних розчинів |
|
|
Рівняння Гендерсона-Гассельбаха для основних буферних розчинів |
|
|
Буферна ємність
|
Буферною ємністю (В) називають кількість молей еквіваленту сильної кислоти або сильної основи, яку потрібно додати до одного літра буферного розчину, щоб змінити його рН на одиницю. |
|
Вк – буферна ємність за кислотою |
|
|
Вл – буферна ємність за лугом
|
|
|
Область буферування |
Область буферування це діапазон рН, який визначає межі дії буферного розчину: рН = рК ± 1 |
|
Буферні системи організму |
Буферні системи організму це буферні системи рідких середовищ організму, а саме крові та інших біологічних рідин, що безпосередньо забезпечують швидку компенсацію зміщень рН крові |
|
Гідрокарбонатна (бікарбонатна) буферна система крові |
Гідрокарбонатна (бікарбонатна) буферна система крові визначається наявністю вільної розчиненої в крові вугільної кислоти H2CO3 і гідрокарбонату натрію (NaHCO3) |
|
Фосфатна буферна система |
Фосфатна буферна система крові визначається гідрофосфат (HPO42-) та дигідрофосфат (H2PO4-) іонів у біологічних рідинах |
|
Білкові буферні системи |
Це – гемоглобінова буферна система (гемоглобіновий буфер), оксигемоглобіновий буфер. У меншій мірі буферну ємність крові забезпечують білки плазми. |
|
Гемоглобіновий буфер |
Гемоглобіновий буфер складається з двох форм гемоглобіну – відновленого (HHb-гемоглобіну) і окисленого (HHbО2 - оксигемоглобіну). |
4.2. Теоретичні питання до заняття:
-
Буферні розчини, їх класифікація за хімічним складом
-
Рівняння Гендерсона-Гассельбаха
-
Механізм буферної дії кислотних та основних буферів
-
Буферна ємність і чинники, від яких вона залежить.
-
Буферні системи крові
-
Поняття про кислотно-основний стан крові
Приклади розвязування:
1).
Обчислити рН буферного розчину,
приготовленого змішуванням 400мл розчину
NH4Cl
з со(NH4Cl)
= 0,1моль/л та 250 мл розчину NH3
∙ H2О
з со(NH3∙H2О)
= 0,2моль/л.
![]() =
1,80 ∙ 10–5
моль/л.
=
1,80 ∙ 10–5
моль/л.
а). Коротко записати умову задачі.
Дано: co(NH4Cl)=0,1 моль/л;
co(NH3·Н2О)=0,2 моль/л;
V(NH4Cl)=400мл= 0,4 л;
V(NH3·Н2О)=250 мл= 0,25 л;
Кg(NH3·Н2О)=1,80·10-5моль/л.
Знайти: рН -?
б). Записати формулу для розрахунку значення рН даного основного буфера, використовуючи об’єми та молярні концентрації компонентів розчинів, з яких приготовлено буфер:
рН=14-рКg(NH3·Н2О)+lg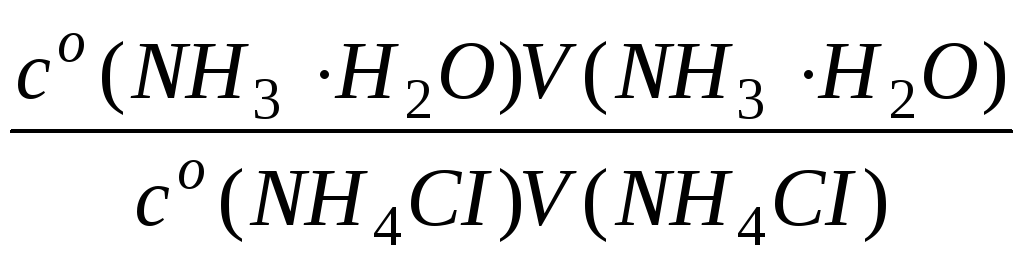
![]()
в). Записати формулу для обчислення рКд(NH3·Н2О) і вирахувати його рКд(NH3·Н2О) =-lg рКд(NH3·Н2О)=-lg 1, 80• 10-5= -(lg 1, 80+lg 10-5)=-(0, 26-5,0)= 4, 74
г). Обчислити рН даного аміачного буфера:
рН=14-4, 74+![]() =14-4,
74+lg1,
525=14-4,74+0,10=9,36.
=14-4,
74+lg1,
525=14-4,74+0,10=9,36.
Відповідь: рН=9,36.
2).
Обчислити об’єми розчинів оцтової
кислоти з со(СН3СООН)
= 0,1моль/л і ацетату натрію со(СН3СООNa)
= 0,1моль/л, які необхідно змішати, щоб
приготувати 200мл буферного розчину з
с(буфера) = 0,05моль/л і рН = 5,24.
![]() =
1,75 ∙ 10–5
моль/л.
=
1,75 ∙ 10–5
моль/л.
а). Коротко записати умову задачі.
Дано: со(СН3СООН)=0,1 моль/л;
со(СН3СООNa )=0,1 моль/л;
V(буфера)=200 мл= 0,2 л;
с(буфера)=с(солі)+с(кислоти)=0,05 моль/л;
рН=5,24.
Знайти: V(солі)-? V(кислоти)-?
а). Записати формулу для обчислення рН даного ацетатного буфера, використовуючи об’єми та молярні концентрації компонентів вихідних розчинів, що входять до складу буфера:
РН=рКg(СН3СООН)+lg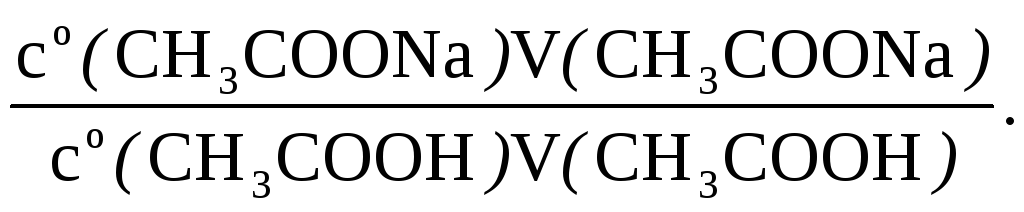
б). Записати формулу для обчислення рКд(СН3СООН) та обчислити його.
рКд(СН3СООН)=-lg рКд(СН3СООН)=-lg1,75• 10-5=-(lg1,75+lg 10-5)=-(0,24-5,00)=4,76.
в). Спростити вираз для розрахунку рН даного кислотного буфера, підставивши в нього відомі з умови задачі молярні концентрації компонентів вихідних розчинів, рН, обчислене значення рКд(СН3СООН):
5,24=4,76+lg![]()
Шляхом потенціювання обчислити значення співвідношення об’ємів вихідних розчинів, з яких готується даний буфер:
![]()
Порівняти молярні концентрації компонентів у буферному розчині з їх молярними концентраціями у вихідних розчинах та вирішити, чи треба готувати буфер тільки змішуванням вихідних розчинів кислоти чи солі, чи необхідно додавати воду. У даному випадку: с(буфера)=0,05 моль/л, а со(СН3СООН)=со(СН3СООNa)=0,1 моль/л, тобто молярна концентрація буфера в 2 рази менша, ніж молярні концентрації вихідних розчинів. Таким чином, для приготування даного буферного розчину необхідно додавати воду.
Обчислити об’єми вихідних розчинів солі та кислоти, а також об’єми води, які необхідно взяти, щоб приготувати 200 мл буфера. Необхідно додавати воду, об’єм якої дорівнює половині об’єму буферного розчину, тобто 200 мл: 2=100 мл. Решта об’єму – 100 мл буфера – містить 3 частини вихідного розчину солі та 1 частину вихідного розчину кислоти. Тому для приготування даного буфера необхідно взяти такий об’єм розчину солі:
![]()
об’єм розчину кислоти:
![]()
Відповідь: V(СН3СООNa)=0,075л; V(СН3СООН)=0,025л.
3). Який з буферних розчинів складу:
а) по 100 ммоль оцтової кислоти й натрій ацетату;
б) по 10ммоль оцтової кислоти й натрій ацетату буде мати більшу буферну ємність при додаванні до 1 л буферного розчину 5 ммоль НСl.
РКд CH3COOН = 4,76.
Відповідь:
а) Сильна кислота, що додається, вступає у реакцію з натрій ацетатом:
CH3COONa + HCl = CH3COOH + NaCl.
З утворенням еквівалентної кількості слабкої кількості кислоти, тому для буферного розчину складу по 100 ммоль оцтової кислоти й натрій ацетату кількість CH3COONa зменшиться на 5 ммоль і становитиме:
100 ммоль – 5 ммоль = 95 ммоль.
Відповідно кількість CH3COOН збільшиться на 5ммоль і становитиме 105ммоль. Враховуючи, що рКд (CH3COOH)= 4,76, обчислимо рН1:
![]() .
.
Вихідний
буферний розчин мав
![]()
Тому, Δ pН1 дорівнює 4,76-4,72=0,04
б). склад розчину по 10 ммоль оцтової кислоти й ацетату натрію.
Кількість CH3COONa зменшиться на 5 ммоль і становитиме:
10 ммоль - 5ммоль = 5ммоль,
Кількість CH3COOН збільшиться на 5 ммоль і становитиме 15 ммоль. Розрахуємо рН:
![]() .
.
ΔрН2=4,76-4,28=0,48.
Висновок: Δ pН1 < ΔрН2, тобто, більшу буферну ємність має перший буферний розчин для якого співвідношення концентрацій компонентів однакове і велике, а Δ pН незначне.
4).
Розрахуйте співвідношення концентрацій
![]() в умовах плазми крові (рН=7,4 при 37ºC)
pKд1(
в умовах плазми крові (рН=7,4 при 37ºC)
pKд1(![]() )
= 6,1.
)
= 6,1.
Відповідь: Запишемо рівняння Гендерсона-Гассельбаха для гідрокарбонатного буфера в умовах плазми крові і розрахуємо співвідношення концентрацій іонів HCO3‾ і вугільної кислоти в крові.
7,4 = 6,1 +
![]() ;
;
![]() = 7,4 - 6,1
= 1,3
= 7,4 - 6,1
= 1,3
![]() =
101,3
=
19,95 =
=
101,3
=
19,95 =![]()
