
Сборник задач и упражнений по химии
.pdf
III. Задачи на приготовление растворов методом разведения.
1. Рассчитайте объем раствора гидроксида натрия (W NaOH % 20%,
1,22г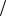 мл), который надо разбавить водой для получения 200 мл раствора с молярной концентрацией эквивалента 0,1 мол/л.
мл), который надо разбавить водой для получения 200 мл раствора с молярной концентрацией эквивалента 0,1 мол/л.
Дано:
W NaOH % 20%
1,22г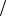 мл
мл
С1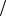 zNaOH 0,1моль
zNaOH 0,1моль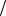 л
л
Vразб.р ра 200мл
Найти: Vконц.р ра
Решение:
В концентрированном и разбавленном растворе содержится одинаковое количество вещества NaOH,
следовательно одинакова m NaOH .
Вычислим m NaOH , содержащуюся в растворе:
m NaOH C 1 zNaOH M 1
zNaOH M 1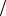 zNaOH Vразб.р-ра
zNaOH Vразб.р-ра
1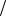 z NaOH 1 М NaOH М 1
z NaOH 1 М NaOH М 1 zNaOH 40г
zNaOH 40г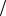 моль
моль
m NaOH 0,1моль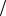 л 40г
л 40г моль 0,2л 0,8г
моль 0,2л 0,8г
Рассчитаем массу раствора с W NaOH % 20%, который содержит 0,8 г NaOH:
mконц.р-ра |
|
m NaOH 100% |
|
0,8г 100% |
4г |
||||
|
|
|
20% |
||||||
|
|
|
W NaOH % |
|
|||||
Вычислим объем: V |
|
mконц.р-ра |
|
4г |
|
3,28мл |
|||
|
|
|
|
||||||
конц.р-ра |
|
|
|
|
1,22г мл |
||||
|
|
|
|
||||||
Ответ: Для приготовления 200 мл раствора с С1 zNaOH 0,1моль
zNaOH 0,1моль л требуется
л требуется
3,28 мл 20% раствора NaOH.
2. Рассчитайте объем 35%-ного раствора серной кислоты ( 1,2г мл),
мл),
необходимый для приготовления 250 мл раствора с молярной концентрацией эквивалента 0,2 моль/л.
Дано: |
Решение: |
|
|
|
|
|
|
|||||
W H2SO4 % 35% |
m H2SO4 конц.р ра |
m H2SO4 разб.р ра |
||||||||||
1,2г мл |
m H2SO4 C1 zH2SO4 M 1 zH2SO4 Vразб.р-ра |
|||||||||||
С1 zH2SO4 0,2моль л |
|
1 |
H SO |
|
1 |
|
М 1 zH |
SO |
|
1 |
98г моль 49г моль |
|
|
|
|
||||||||||
|
|
|
|
|
||||||||
Vразб.р ра 250мл |
|
z |
2 4 |
2 |
|
2 |
|
4 |
2 |
|
||
|
m H2SO4 0,2моль л 49г |
моль 0,25л 2,45г |
||||||||||
Найти: Vконц.р ра |
||||||||||||
21

mконц.р-ра |
|
|
m H2SO4 |
|
|
4,9г |
7г |
|||
|
W H SO |
|
0,35 |
|
||||||
|
|
2 |
4 |
|
|
|
|
|
|
|
V |
|
mконц.р-ра |
|
|
|
|
7г |
5,8мл |
||
|
|
|
|
|
|
|
||||
конц.р-ра |
|
|
|
|
|
1,2г мл |
|
|||
|
|
|
|
|
|
|||||
Ответ: Vконц.р-ра 5,8мл.
IV. Задачи на приготовление растворов из фиксанала.
Фиксанал, стандарт-титр, точно известное количество вещества (сухого или в растворе) в запаянной ампуле, служащее для приготовления стандартного раствора в титриметрическом анализе.
1. Ампула фиксанала содержит 0,1 моль-эквивалентов перманганата калия.
Из ампулы приготовили 2 л раствора. Какова молярная концентрация эквивалента и титр раствора перманганата калия? (Фактор эквивалентности KMnO4 равен 1/5)
Дано: |
|
|
|
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
n 1 zKMnO4 0,1моль |
C1 zKMnO4 |
|
n 1 zKMnO4 |
|
0,1моль |
0,05моль л |
||||||||||||||
|
|
|
|
|
||||||||||||||||
Vр ра |
2 л |
|
|
|
|
|
|
|
|
Vр ра |
|
|
|
|
2л |
|||||
|
|
|
М KMnO4 158г моль |
|
|
|
|
|
|
|
|
|||||||||
|
1 |
KMnO |
|
1 |
|
М 1 zKMnO |
|
|
1 |
М KMnO |
|
1 |
158г моль 31,6г моль |
|||||||
|
|
|
|
|
|
5 |
||||||||||||||
|
z |
4 |
5 |
|
|
4 |
5 |
|
4 |
|
|
|
|
|
||||||
|
|
C1 zKMnO4 M 1 zKMnO4 |
|
|||||||||||||||||
Найти: C1 zKMnO4 , |
t KMnO4 |
|
||||||||||||||||||
t KMnO4 |
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t KMnO4 0,05моль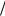 л 31,6г
л 31,6г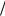 моль 0,0016г мл 1000
моль 0,0016г мл 1000
Ответ: C1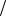 zKMnO4 0,005моль
zKMnO4 0,005моль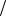 л, t KMnO4 0,0016г
л, t KMnO4 0,0016г мл .
мл .
V. Задачи на закон эквивалентов.
1. Вычислите молярную концентрацию эквивалента и титр раствора соляной кислоты, если на титрование исследуемого раствора объемом 5 мл затрачено 4 мл раствора NaOH с молярной концентрацией эквивалента
0,05 моль/л.
22

Дано:
V HCl 5мл
V NaOH 4мл
С1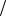 zNaOH 0,05моль
zNaOH 0,05моль л
л
Найти: С 1 z HCl ,
z HCl ,
t HCl
Решение:
Приведем уравнение химической реакции:
HCl + NaOH → NaCl + H2O
По следствию из закона эквивалентов
С1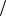 zHCl V HCl С 1
zHCl V HCl С 1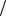 z NaOH V NaOH
z NaOH V NaOH
С 1 zHCl |
С 1 z NaOH V NaOH |
|
|
0,05моль л 4мл |
0,04 |
моль |
|
|
|
л |
|||||
|
|
V HCl |
|
5мл |
|||
1 z HCl 1 |
М HCl М 1 zHCl 36,5г моль |
|
|||||
t HCl C 1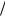 zHCl M 1
zHCl M 1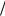 zHCl 0,04моль
zHCl 0,04моль л 36,5г
л 36,5г моль 0,00146г мл 1000 1000
моль 0,00146г мл 1000 1000
Ответ: С1 z HCl 0,04моль
z HCl 0,04моль л, t HCl 0,0146г
л, t HCl 0,0146г мл .
мл .
2. На нейтрализацию 10 мл раствора K2CO3 потребовалось 16 мл раствора
HNO3 с молярной концентрацией эквивалента 0,1 моль/л. Вычислите молярную концентрацию эквивалента, молярную концентрацию, титр и массу K2CO3 в 200 мл этого раствора.
Дано: |
|
|
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
V K2CO3 10мл |
|
|
Приведем уравнение химической реакции: |
|
|
|||||||||||||||||||||||||||||||||||||
V HNO3 16мл |
|
|
K2CO3 |
+ 2 HNO3 → 2 KNO3 |
+ H2CO3 |
|
|
|||||||||||||||||||||||||||||||||||
С1 zHNO3 0,1моль л |
|
|
С1 z K2CO3 V K2CO3 С1 z HNO3 V HNO3 |
|
|
|||||||||||||||||||||||||||||||||||||
Vр ра 200мл |
|
|
следовательно |
|
|
|
С1 zK2CO3 |
|
С1 z HNO3 V HNO3 |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
V K2CO3 |
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Найти: С 1 z K2CO3 , |
|
|
С1 z K |
2CO3 |
0,1моль л 16мл |
0,16моль л |
|
|
||||||||||||||||||||||||||||||||||
C K2CO3 , t K2CO3 , |
|
|
|
|
|
10мл |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
1 |
K |
|
|
|
|
1 |
|
|
|
М 1 zK |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
||||||||||||
m K2CO3 |
|
|
|
CO |
|
|
CО |
|
|
138г моль 69г моль |
||||||||||||||||||||||||||||||||
|
|
|
z |
2 |
|
3 |
2 |
|
|
|
|
|
|
|
|
|
2 |
3 |
|
2 |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
C K |
|
CO |
|
1 |
|
C 1 zK |
CO |
|
1 |
0,16моль л 0,08моль л |
|||||||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
2 |
|
3 |
|
z |
2 |
3 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
t K2CO3 |
C K2CO3 M K2CO3 |
|
|
C 1 zK2CO3 M 1 zK2CO3 |
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|||||||
|
|
|
0,08 |
моль |
138 |
г |
|
|
0,16 |
моль |
69 |
|
|
|
г |
|
|
г |
|
|
|
|
||||||||||||||||||||
|
|
|
|
моль |
|
|
|
|
моль |
|
|
|
|
|
||||||||||||||||||||||||||||
t K2CO3 |
|
|
|
|
|
|
|
л |
|
|
|
|
|
|
|
|
|
|
|
|
|
л |
|
|
0,011 |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
1000 |
|
|
|
|
|
|
|
|
|
|
1000 |
|
|
мл |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
23

m K2CO3 t K2CO3 Vр-ра 0,011г мл 200мл 2,2г
мл 200мл 2,2г
Ответ: С 1 z K2CO3 0,16моль
z K2CO3 0,16моль л , C K2CO3 0,08моль
л , C K2CO3 0,08моль л , t K2CO3 0,011г
л , t K2CO3 0,011г мл ,
мл ,
m K2CO3 2,2г.
3. Навеску технической соды массой 1,5 г растворили в мерной колбе объёмом
250 мл. На титрование 10 мл полученного раствора затрачено 8,5 мл соляной кислоты с молярной концентрацией эквивалента 0,1 моль/л.
Определите молярную концентрацию эквивалента, молярную концентрацию, титр и массовую долю Na2CO3 в навеске.
Дано:
mнавески 1,5г
Vр ра 250мл
V Na2CO3 10мл
V HCl 8,5мл
С1 zHCl 0,1моль
zHCl 0,1моль л
л
Найти:
С 1 z Na2CO3 ,
z Na2CO3 ,
C Na2CO3 ,
t Na2CO3 ,
Wчист. Na2CO3 %
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Na2CO3 |
+ 2 HCl → 2 NaCl + H2CO3 |
|
|
||||||||||||||||||
по следствию из закона эквивалентов: |
|
|
|||||||||||||||||||
С1 z Na2CO3 V Na2CO3 С 1 z HCl V HCl |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
С 1 z HCl V HCl |
0,1 |
моль |
8,5мл |
|
моль |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
С1 zNa2CO3 |
|
|
|
|
|
|
|
|
л |
0,085 |
|
||||||||||
V Na2CO3 |
|
|
|
10мл |
л |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
1 |
Na |
2CO3 |
1 |
|
следовательно |
|
|
|||||||||||||
|
|
|
|
|
|
||||||||||||||||
|
z |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
C Na |
|
CO |
|
1 |
C 1 z Na |
CO |
|
1 |
0,085моль л 0,0425моль л |
||||||||||||
|
|
2 |
|||||||||||||||||||
|
|
|
2 |
|
3 |
|
z |
2 |
3 |
|
|
|
|
|
|
|
|
||||
Найдем массу соды в приготовленном растворе и титр
этого раствора (М Na2CО3 106г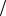 моль):
моль):
m Na2CO3 C Na2CO3 M Na2CO3 Vр ра
m Na2CO3 0,0425моль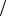 л 106г
л 106г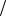 моль 0,25л 1,126г
моль 0,25л 1,126г
t Na2CO3 |
|
m Na2CO3 |
|
1,126г |
0,0045г мл |
|
|
||||
|
|
Vр-ра |
250мл |
||
Рассчитаем массовую долю чистой соды в навеске:
W |
Na |
CO |
% |
m Na2CO3 |
|
100% |
1,126г |
100% 75,07% |
|
|
|||||||
чист. |
2 |
3 |
|
mнавески |
|
1,5г |
||
|
|
|
|
|
||||
Ответ: С1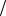 zNa2CO3 0,085моль
zNa2CO3 0,085моль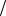 л , C Na2CO3 0,0425моль
л , C Na2CO3 0,0425моль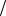 л , t Na2CO3 0,0045г
л , t Na2CO3 0,0045г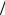 мл ,
мл ,
Wчист. Na2CO3 % 75,07%.
24

4. Определите массу серной кислоты в растворе, если на его титрование
затрачено 6 мл раствора гидроксида калия с молярной концентрацией
0,1 моль/л. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дано: |
|
Решение: |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||||
V KOH 6мл |
|
H2SO4 |
+ 2 KOH → K2SO4 |
+ 2 H2O |
||||||||||
С KOH 0,1моль л |
|
По закону эквивалентов: |
|
|
|
|
||||||||
|
|
n 1 z H2SO4 n 1 z KOH |
следовательно |
|||||||||||
Найти: m KOH |
|
|||||||||||||
|
|
|
|
m H2SO4 |
C1 zKOH V KOH |
|||||||||
|
|
|
|
|||||||||||
|
|
|
M 1 zH2SO4 |
|
||||||||||
|
|
|
1 |
H SO |
|
1 |
М 1 zH |
SO |
|
1 |
98г моль 49г моль |
|||
|
|
|
z |
2 |
4 |
2 |
2 |
4 |
|
2 |
|
|||
|
|
1 z KOH 1 |
C1 zKOH C KOH 0,1моль л |
|||||||||||
m H2SO4 M 1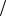 zH2SO4 C1
zH2SO4 C1 zKOH V KOH
zKOH V KOH
m H2SO4 49г моль 0,1моль
моль 0,1моль л 0,006л 0,0294г
л 0,006л 0,0294г
Ответ: m H2SO4 0,0294г.
5. На нейтрализацию раствора NaOH затрачено 10 мл раствора H2SO4 с
молярной концентрацией 0,15 моль/л. Вычислите массу NaOH в растворе.
Дано:
V H2SO4 10мл
С H2SO4 0,15моль л
л
Найти: m NaOH
1 |
H SO |
|
1 |
|
|
||
z 2 4 |
2 |
||
Решение:
2 NaOH + H2SO4 → Na2SO4 + 2 H2O
В момент полной нейтрализации:
С1 z NaOH V NaOH С 1
z NaOH V NaOH С 1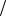 z H2SO4 V H2SO4
z H2SO4 V H2SO4
m NaOH C 1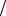 zNaOH V NaOH M 1
zNaOH V NaOH M 1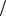 zNaOH
zNaOH
m NaOH C1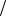 zH2SO4 V H2SO4 M 1
zH2SO4 V H2SO4 M 1 zNaOH
zNaOH
C1 z H SO |
4 |
|
C H2SO4 |
|
|
0,15моль л |
0,3 |
моль |
|
|
|
||||||
2 |
|
1 z |
1 2 |
|
л |
|||
|
|
|
|
|||||
1 z NaOH 1 М NaOH М 1
z NaOH 1 М NaOH М 1 zNaOH 40г
zNaOH 40г моль
моль
m NaOH 0,3моль л 0,01л 40г
л 0,01л 40г моль 0,12г
моль 0,12г
Ответ: m NaOH 0,12г .
25

6. Рассчитайте, сколько миллилитров соляной кислоты с молярной концентрацией эквивалента 0,15 моль/л требуется для нейтрализации 0,2 г
химически чистой соды.
Дано: |
Решение: |
|
|
|
|
|
|
|
|||||||||
m Na2CO3 0,2г |
Na2CO3 |
|
|
+ 2 HCl → 2 NaCl + CO2 ↑ + H2O |
|||||||||||||
C1 zHCl 0,15моль л |
По закону эквивалентов: |
|
|
|
|
|
|
||||||||||
|
n 1 z Na2CO3 n 1 z HCl |
следовательно |
|||||||||||||||
Найти: V HCl |
|||||||||||||||||
|
|
|
m Na2CO3 |
C 1 zHCl V HCl |
|
|
|||||||||||
|
|
|
|
|
|||||||||||||
|
|
M 1 zNa2CO3 |
|
|
|
||||||||||||
|
V HCl |
|
|
|
|
m Na2CO3 |
|
|
|
|
|
|
|||||
|
C 1 zHCl M 1 zNa2CO3 |
|
|
|
|||||||||||||
|
|
1 |
Na |
CO |
|
1 |
М 1 zNa |
CO |
|
1 |
106г моль 53г моль |
||||||
|
|
z |
|
|
2 |
||||||||||||
|
|
2 |
|
3 |
2 |
2 |
3 |
|
|
|
|||||||
|
V HCl |
|
|
|
|
|
|
0,2г |
|
0,02516л 25,16мл |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
0,15моль л 53г моль |
|
|
|
|
||||||
Ответ: V HCl 25,16мл.
Задачи для самостоятельного решения
1. Для нейтрализации раствора серной кислоты объемом 42 мл потребовалось
14 мл раствора щелочи с молярной концентрацией эквивалента 0,3 моль/л.
Какова молярная концентрация серной кислоты в исследуемом растворе?
Ответ: С H2SO4 0,05моль л.
л.
2. Рассчитайте, какой объем воды необходимо взять, чтобы из 45 г сульфата натрия приготовить 20%-ный раствор соли?
Ответ: V H2O 180мл.
3. Рассчитайте молярную концентрацию HCl и титр в растворе с массовой долей соляной кислоты 38% ( 1,19г мл).
мл).
Ответ: C HCl 12,4моль л, t HCl 0,4522г
л, t HCl 0,4522г мл.
мл.
26
4. Раствор с массовой долей глюкозы 5% (М С6Н12О6 180г моль) применяют для восполнения жидкости в организме как источник легкоусвояемого углевода. Вычислите молярную и моляльную концентрации глюкозы в данном растворе. Плотность раствора 1,02 г/мл.
моль) применяют для восполнения жидкости в организме как источник легкоусвояемого углевода. Вычислите молярную и моляльную концентрации глюкозы в данном растворе. Плотность раствора 1,02 г/мл.
Ответ: C С6Н12О6 0,28моль л , Cm С6Н12О6 0,29моль
л , Cm С6Н12О6 0,29моль кг .
кг .
5. Хлорид цинка используется в качестве вяжущего и асептического средства.
Определите молярную концентрацию, молярную концентрацию эквивалента,
массовую долю и титр раствора, содержащего 5 г ZnCl2 в 100 г раствора
( 1г мл).
мл).
Ответ: C ZnCl2 0,37моль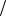 л, С1
л, С1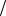 zZnCl2 0,74моль
zZnCl2 0,74моль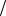 л, W ZnCl2 % 5%,
л, W ZnCl2 % 5%,
t ZnCl2 0,05г мл.
мл.
6. Водный раствор аммиака массой 2,12 г разбавлен в мерной колбе вместимостью 250 мл. На титрование 10 мл разбавленного раствора затрачено
8,4 мл титранта с концентрацией C HCl 0,107моль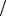 л. Рассчитайте массовую долю аммиака в исходном растворе.
л. Рассчитайте массовую долю аммиака в исходном растворе.
Ответ: W NH3 % 18,04%.
7. Плотность 26%-ного раствора KOH равна 1,246 г/мл. Сколько моль KOH
содержится в 5 л такого раствора?
Ответ: n KOH 28,9моль.
8. На титрование пробы раствора гидроксида натрия затратили 15,1 мл рабочего раствора с концентрацией соляной кислоты 0,103 моль/л. Чему равна масса
NaOH в исследуемом растворе?
Ответ: m NaOH 0,062г .
9. При укусах муравьев, при соприкосновении с крапивой на коже возникает чувство жжения за счет действия муравьиной кислоты. Какая масса муравьиной кислоты может быть нейтрализована с помощью 10 мл 2%-ного раствора
NaHCO3, плотность которого равна 1,013 г/мл.
Ответ: m HCOOH 0,11г.
27
10. Рассчитайте моляльную концентрацию хлорида ртути (II) в неводном растворе, полученном смешиванием 9,98 г этой соли и 120 мл этанола,
плотность которого равна 0,785 г/мл.
Ответ: Cm HgCl2 0,39моль кг .
кг .
11. При определении кислотности желудочного сока на титрование 15 мл сока
было израсходовано 6,5 мл раствора с молярной концентрацией гидроксида натрия 0,02 моль/л. Какова масса соляной кислоты в 200 мл желудочного сока?
Ответ: m HCl 0,064г.
12. Определите массовую долю глюкозы в растворе, содержащем на 300 моль воды 2 моль глюкозы.
Ответ: 6,25%.
13. За сутки в желудке человека выделяется 800 мл желудочного сока
( 1,065г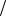 мл). Рассчитайте массу NaCl, необходимую для образования соляной
мл). Рассчитайте массу NaCl, необходимую для образования соляной
кислоты, содержащейся в желудочном соке с W HCl % 0,5%. Предполагается,
что из 1 моль NaCl образуется 1 моль HCl.
Ответ: 6,8 г.
14. Вычислите сколько миллилитров 20%-ного раствора хлорида натрия
( 1,14г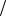 мл) необходимо добавить к 40 мл воды, чтобы получить раствор с массовой долей 6%.
мл) необходимо добавить к 40 мл воды, чтобы получить раствор с массовой долей 6%.
15. Для промывания желудка при отравлениях в качестве антидота применяют раствор тиосульфата натрия с молярной концентрацией 0,33 моль/л.
Вычислите, сколько граммов тиосульфата натрия необходимо для приготовления 500 мл этого раствора.
16. Рассчитайте, какая масса хлора требуется для обеззараживания 500 г воды,
если при хлорировании расходуется 0,002 мг хлора на 1 л воды.
17. Массовая доля неорганических веществ, входящих в состав костей человека, составляет 22%, из них 0,3% фторида кальция. Определите массу
CaF2 в костях человека с массой 70 кг, если массовая доля костей от массы тела 20%.
28
18. Больному ввели 10 мл 10%-ного раствора хлорида кальция ( 1,2г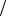 мл)
мл)
внутривенно. Какой станет условно молярная концентрация и титр CaCl2 в
крови (Vкрови 5 л).
19.Рассчитайте сколько моль NaCl необходимо для приготовления 500 г
физиологического раствора с массовой долей хлорида натрия 0,9%.
20.Рассчитайте сколько мл раствора соляной кислоты с молярной концентрацией эквивалента 0,12 моль/л требуется для нейтрализации 0,5 г
химически чистой соды (Na2CO3).
21.Рассчитайте, какую масса слабительного средства MgSO4 7Н2O нужно взять для приготовления раствора с титром 0,018 г/мл и объёмом 500 мл.
22.В табаке одной сигареты содержится в среднем 2,25∙10–5 граммов никеля.
Из них 1,7∙10–5 граммов переходит в пепел, а остальной никель попадает в организм через дыхательные пути в виде токсического вещества – тетракарбонил никеля Ni(CO)4. Какая масса карбонила попадает в организм?
Ni(CO)4 – раздражает глубокие дыхательные пути, вызывая пневмонии и отек легких, независимо от пути поступления в организм. Значительное общетоксическое действие направлено и на нервную систему. Подвергается внутриклеточному метаболизму с образованием никеля и угарного газа. Отравление характеризуется общим недомоганием, головной болью, головокружением, раздражением слизистых, как при вдыхании СО, но после скрытого периода (от нескольких часов до 2 суток) развивается одышка, кашель, повышение температуры, цианоз. У пожилых лиц наблюдают пневмосклероз, эмфизема, дыхательная недостаточность. У молодых людей изменения в легких могут нормализоваться в течение года после прекращения курения. Динамическое наблюдение в течение нескольких лет устанавливает полное выздоровление.
23. В табаке сигарет содержится 8∙10–6 граммов железа. В пепле и окурках остается 6∙10–6 граммов. Сколько газообразного, токсического вещества пентакарбонил железа Fe(CO)5 попадает в организм при выкуривании одной сигареты?
Fe(CO)5 – сильно ядовит при вдыхании, введении внутрь или всасывании через неповрежденную кожу. Вызывает острый отек легких независимо от пути введения. Предполагают, что выделение происходит через легкие. В условиях производства отравления протекают сходно с картиной интоксикации угарным газом.
29
2.2. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Даже химически чистая вода проводит электрический ток, хотя и очень
слабо. Эта проводимость возникает за счет диссоциации молекул воды:
H2О 
 H+ + ОН–
H+ + ОН–
Правильнее записывать уравнение диссоциации воды с учетом гидратации
водой образующегося иона водорода. Т.о. уравнение автопротолиза воды имеет следующий вид:
H2О + H2О 
 Н3О+ + ОН–
Н3О+ + ОН–
Далее будем использовать обозначение Н+ вместо Н3О+, понимая, что ион
водорода в водном растворе всегда гидратирован.
Равновесная концентрация вещества (ионов) в растворе определяется как
произведение степени диссоциации на молярную концентрацию.
x x C x моль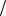 л
л
Измерения проводимости чистой воды показали, что при 250С степень ее диссоциации H2O 1,8 10 9 . Так как в 1 л воды содержится 55,5 моль Н2О, то концентрация ионов в чистой воде будет равна:
H OH 1,8 10 9 55,5моль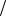 л 10 7 моль
л 10 7 моль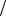 л
л
при t 250C или T 298 K
Kw – величина постоянная при данной температуре для воды и любых водных растворов, равная произведению концентраций ионов водорода и гидроксид-ионов.
Количественной характеристикой кислотности среды является значение рН: pH lg H
Количественной характеристикой щелочности среды является значение рОН:
pOH lg OH-
Ионное произведение воды в логарифмической форме:
pH pOH 14
30
