
Сборник задач и упражнений по химии
.pdf
9. Пользуясь справочными данными (см. приложение Таблица 1), оцените, при каких температурах может протекать разложение гидроксида алюминия.
Пренебречь зависимостью энтальпии и энтропии образования от температуры.
Дано: |
|
|
|
|
2 Al(OH)3 (к) → Al2О3 (к) |
+ 3 Н2О(г) |
|
Н0,кДж моль |
–1294,3 |
–1675,7 |
–241,8 |
S0,Дж (моль K) |
70,1 |
50,9 |
188,7 |
Решение: |
|
|
|
Рассчитываем изменения энтропии и энтальпии реакции:
Н0р-ции 1675,7 3 ( 241,8) 2 ( 1294,3) 187,5 кДж
S0р-ции 50,9 3 188,7 2 70,1 476,8 Дж K
K
Процесс возможен только в том случае, если G0р-ции 0. Следовательно,
необходимо рассчитать энергию Гиббса и найти интервал температур, при
которых |
Gр0 |
-ции 0. |
|
|
Gр0 |
-ции |
Hр0 |
-ции T |
S0р-ции 187,5 T 476,8 10 3 |
Накладываем условие G0р-ции 0, решаем неравенство:
187,5 T 476,8 10 3 0
T 187,5 393,2 K 0,4768
Ответ: Реакция разложения гидроксида алюминия теоретически возможна при температуре выше 393K.
Задачи для самостоятельного решения
1. Определите калорийность 350 г пищевого продукта, содержащего 50% воды, 30% белка, 15% жиров и 5% углеводов, если калорийность белков и углеводов составляет 17,1 кДж/г, а жиров составляет 38,0 кДж/г.
Ответ: калорийность пищевого продукта 4089,75 кДж или 978,4 ккал.
11
2. Вычислите количество теплоты, которое выделится при окислении глюкозы массой 90 г при стандартных условиях:
C6H12O6 (к) + 6 О2 (г) → 6 СО2 (г) + 6 Н2О(ж)
Ответ: Q = 1401,4 кДж.
3. Вычислите изменение энтальпии (тепловой эффект) процесса нейтрализации: H+ (р-р) + ОН– (р-р) = H2О(ж), пользуясь справочными значениями стандартных энтальпий образования веществ, участвующих в реакции.
Ответ: Н0р-ции 55,8 кДж .
4. Вычислите энтропию реакции образования дипепдида из двух молекул глицина при стандартных условиях:
|
CH2 C |
O |
|
CH2 C |
O |
|
|
|
O |
|
|
|
|
O + H O |
|
|||||
|
|
|
+ |
|
|
|
|
|
CH2 |
|
C |
|
|
|
|
(ж) |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
OH |
|
|
OH |
|
|
|
NH |
|
CH |
2 |
|
C |
2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
NH2 |
(р-р) NH2 |
(р-р) |
|
NH2 |
|
|
OH (р-р) |
|
||||||||||||
|
глицин |
|
|
глицин |
|
|
глицилглицин |
|
|
|
||||||||||
Ответ: |
S0р-ции 15,8 Дж K . |
|
|
|
|
|
|
|
|
|
|
|
||||||||
5. Вычислите |
изменение |
энергии |
Гиббса для |
реакции |
гликолиза |
при |
||||||||||||||
стандартных условиях: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
С6Н12О6 (р-р) |
|
|
2 С3Н6О3 (р-р) |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
D-глюкоза |
|
L-молочная кислота |
|
|
||||||||||||
Ответ: |
Gр0 |
-ции 161 кДж . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
6. Рассчитайте |
количество теплоты, которое выделится |
при спиртовом |
||||||||||||||||||
брожении глюкозы массой 54 г при стандартных условиях: |
|
|
|
|||||||||||||||||
C6H12O6 (р-р) → 2 СО2 (г) + 2 C2H5OН(ж)
Ответ: Q 23,76 кДж .
7. Пользуясь справочными значениями стандартных энтальпий образования веществ, участвующих в реакции, вычислите изменение энтальпии реакции:
2 Mg(к) + CO2 (г) → 2 MgO(к) + C(к, графит).
8. Пользуясь справочными данными, рассчитайте изменение энергии Гиббса для реакции: Cl2 (г) + 2 HI(г) → I2 (к) + 2 HCl(г). Определите возможность протекания реакции при стандартных условиях.
12
9. Энергия Гиббса (∆G0298) реакции CuO(к) + C(к, графит) → Cu(к) + CO(г) равна
–8,1 кДж/моль. Пользуясь справочными данными, рассчитайте изменение
энтальпии и энтропии реакции. Оцените влияние энтальпийного и энтропийного факторов на возможность протекания процесса при стандартных
условиях. |
|
|
|
|
|
|
|
10. |
Пользуясь справочными данными, рассчитайте изменение энергии Гиббса |
||||||
для |
реакции: S(к, ромб.) + 2 HCl(г) → H2S(г) |
+ Cl2 (г). Определите возможность |
|||||
протекания реакции при стандартных условиях. |
|
|
|||||
11. |
Вычислите |
изменение |
энтальпии |
(тепловой эффект) |
реакции: |
||
Al2O3 (к) + 3 SO3 (г) = Al2(SO4)3 (к), |
пользуясь |
справочными |
значениями |
||||
стандартных энтальпий образования веществ, участвующих в реакции. |
|||||||
12. |
Пользуясь справочными данными, рассчитайте изменение энергии Гиббса |
||||||
для |
реакции: |
2 CH3OH(ж) |
+ 3 O2 (г) → 2 CO2 (г) + 4 H2O(г). |
Определите |
|||
возможность протекания реакции при стандартных условиях.
13.Вычислите изменение энтальпии (тепловой эффект) реакции разложения: CaCO3 (к) → CaO(к) + CO2 (г), пользуясь справочными значениями стандартных энтальпий образования веществ, участвующих в реакции.
14.Пользуясь справочными значениями стандартных энтальпий образования веществ, участвующих в реакции, вычислите изменение энтальпии реакции синтеза диэтилового эфира, применяемого в медицине для наркоза:
2C2H5OН(ж) → C2H5OC2H5 (ж) + Н2О(ж)
15.Стандартная энтальпия растворения CuSO4 равна –66,5 кДж/моль,
стандартная энтальпия гидратации до пентагидрата равна –78,22 кДж/моль.
Вычислите стандартную теплоту растворения пентагидрата.
16.Вычислите энтропию реакции хлорирования метана до трихлорметана при стандартных условиях.
17.Вычислите энергию Гиббса гидратации β-лактоглобулина при 250С, если
Н0р-ции 6,75 кДж, а S0р-ции 9,74 Дж K. Оцените вклад энтальпийного и
K. Оцените вклад энтальпийного и
энтропийного факторов.
13
Глава 2. СВОЙСТВА РАСТВОРОВ
2.1. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
Существует несколько способов выражения состава растворов.
Массовая доля вещества в растворе W(х) – отношение массы растворенного вещества к массе раствора:
|
W x |
m x |
|
|
m x |
|
|
||
|
|
|
|
|
|
||||
|
|
|
|
mр-ра Vр ра |
|
|
|||
где m x – масса растворенного вещества, г; mр-ра |
– масса раствора, г; |
||||||||
Vр ра |
– объём раствора, мл или см3; – плотность раствора, г/мл или г/см3. |
||||||||
Массовая доля может быть выражена в процентах W(х)%: |
|||||||||
|
W x % |
m x |
100% |
m x |
|
100% |
|||
|
|
|
|
||||||
|
|
mр-ра |
Vр ра |
||||||
Молярная концентрация С(х) – отношение количества растворенного вещества к объему раствора:
C x |
n x |
|
m x |
моль л |
|
Vр-ра |
M x Vр-ра |
||||
|
|
|
где n x – количество вещества, моль; m x – масса растворенного вещества, г;
M x – молярная масса вещества, г/моль; Vр ра – объём раствора, л или дм3.
Химический эквивалент – реальная или условная (гипотетическая)
частица вещества, которая в протолитической реакции вступает в реакцию с одним ионом водорода (протоном – Н+), а в окислительно-восстановительной реакции отдает или присоединяет один электрон.
Фактор эквивалентности (1/z или f) – величина, показывающая, какая доля реальной частицы соответствует эквиваленту.
В кислотно-основных реакциях
H2S + KOH → KHS + H2O
эквивалентом сероводорода будет одна молекула H2S (реальная частица), H2S + 2 KOH → K2S + 2 H2O
эквивалентом будет половина (1/2) молекулы H2S (условная частица).
14
Если химическая реакция не задана, то
– для кислот фактор эквивалентности равен единице деленной на сумму ионов водорода в молекуле. Например:
1 |
HNO |
|
1 |
|
1 |
1 |
H SO |
|
1 |
|
1 |
H |
PO |
|
1 |
z |
3 |
1 |
|
z 2 4 |
2 |
|
z 3 |
4 |
3 |
||||||
– для оснований фактор эквивалентности равен единице деленной на сумму гидроксид-ионов в молекуле. Например:
1 |
NaOH 1 |
1 |
Ba(OH) |
|
1 |
|
z |
|
|||
z |
2 |
2 |
|||
– для солей фактор эквивалентности равен единице деленной на суммарный заряд катионов соли. Например:
|
|
|
|
|
|
1 |
NaCl 1 |
|
|
|
|
|
|
|
1 |
NaHCO3 1 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
z |
|
|
|
|
|
|
|
z |
|
|
|
|
|
|
|
|
|
||
|
1 |
Na SO |
|
1 |
|
1 |
CaCl |
|
1 |
|
|
|
|
1 |
Al |
(SO |
) |
|
1 |
|
|||||
|
z |
2 4 |
2 |
|
|
|
z |
2 |
|
2 |
|
|
|
|
z 2 |
|
4 |
3 |
6 |
|
|||||
|
В окислительно-восстановительных реакциях |
|
|
|
|
|
|
||||||||||||||||||
|
2 H2S2– + H2SO3 → 3 S0 + 2 H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
эквивалентом является 1/2 молекулы H2S, т.к. |
|
S2– |
– 2 ē → S0, |
|
|
|
|
|
|
||||||||||||||||
|
2 H2S2– + 3 О2 → 2 S4+O2 + 2 H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
эквивалентом является 1/6 молекулы H2S, т.к. |
|
S2– |
– 6 ē → S4+. |
|
|
|
|
|
|
||||||||||||||||
|
Таким |
образом, одно и |
то |
же |
вещество может иметь |
несколько |
|||||||||||||||||||
эквивалентов и определить его можно исходя из конкретной химической реакции.
SO32– + H2O + 2 ē → SO42– + 2 H+ |
|
1 |
SO |
|
2 |
|
1 |
|
|
|
|
|
3 |
|
|
||||||
|
|
z |
ок ль |
2 |
|
|
||||
SO32– + 6 H+ – 4 ē → S0 + 3 H2O |
|
1 |
SO |
|
2 |
|
1 |
|
||
|
|
3 |
|
|||||||
|
|
z |
вос ль |
4 |
|
|||||
Для удобства расчетов в |
аналитической |
химии используют |
||||||||
вспомогательный способ выражения состава раствора – молярную концентрацию эквивалента С(1/z х) (нормальную концентрацию) отношение количества вещества эквивалентов в растворе n(1/z х) к объему раствора:
C1 zx |
n 1 zx |
|
m x |
моль л |
|
M 1 z x Vр-ра |
|||
|
Vр-ра |
|
||
15
где n 1 zx – количество эквивалентов вещества, моль;
zx – количество эквивалентов вещества, моль;
m x – масса растворенного вещества, г; Vр ра – объём раствора, л или дм3;
M 1 zx – молярная масса эквивалентав вещества, г/моль.
zx – молярная масса эквивалентав вещества, г/моль.
В соответствии с законом эквивалентов – количества веществ эквивалентов реагирующих соединений равны.
n 1 z x n 1
z x n 1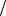 z y
z y
Следствие из закона эквивалентовимеет вид:
С1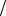 z x V x С1
z x V x С1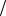 z y V y
z y V y
где С1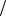 z x , С1
z x , С1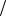 z y – молярные концентрации эквивалентов реагирующих веществ,моль/л; V x , V y – объемы реагирующих веществ, мл или л.
z y – молярные концентрации эквивалентов реагирующих веществ,моль/л; V x , V y – объемы реагирующих веществ, мл или л.
Закон эквивалентов лежит в основе количественного титриметрического анализа.
Титр T(x) или t(x) – отношение массы растворенного вещества m(х) в
граммах к одному миллилитру раствора:
t х |
m x |
|
г мл |
|
Vр-ра |
||||
|
|
|||
где m x – масса растворенного вещества, г; Vр ра – объём раствора, мл.
Моляльная концентрация (моляльность) Cm(х) – отношение количества
вещества n(х) к массе растворителя в кг:
Сm |
x |
n x |
|
m x |
моль кг |
|
mр-ля |
M x mр-ля |
|||||
|
|
|
|
где n x – количество вещества, моль; mр-ля – масса растворителя, кг; m x – масса растворенного вещества, г;
M x – молярная масса вещества, г/моль.
Объемная доля φ(х) – отношение объема растворенного вещества к объему раствора:
x V x
Vр-ра
где V x – объём растворенного вещества, мл; Vр ра – объём раствора, мл.
Объемную долю используют для выражения состава газовых растворов,
например вдыхаемых смесей для наркоза.
16

17

Образцы решений задач
I. Задачи на приготовление растворов из стандартных веществ.
1. Рассчитайте массу хлорида калия и воды, необходимых для приготовления
200 г раствора с массовой долей 14%.
Дано: |
Решение: |
|
|
|
|
|
|
||
mр ра 200г |
W KCl % |
m KCl |
следовательно |
||||||
|
|
|
100% |
||||||
|
|
|
|||||||
W KCl % 14% |
|
|
mр ра |
|
|
||||
|
|
|
|
|
|
|
|
||
|
|
mр ра |
W KCl % |
|
|
|
|||
Найти: |
m KCl |
|
200г 14% |
28 г |
|||||
m KCl , |
|
100% |
100% |
||||||
|
|
|
|
|
|||||
Масса воды для приготовления раствора равна: |
|||||||||
m H2O |
|||||||||
m H2O mр ра |
m KCl 200г 28г 172г |
||||||||
|
|||||||||
|
|
|
|
|
|
|
|
|
|
Ответ: m KCl 28г,m H2O 172г .
2. Рассчитайте сколько граммов химически чистой соды следует взять для приготовления 200 мл раствора с молярной концентрацией эквивалента
0,2 моль/л? Какова молярная концентрация и титр этого раствора?
Дано: |
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Vр ра 200мл |
C1 zNa2CO3 |
|
|
|
|
m Na2CO3 |
|
|
|
следовательно |
|||||||||||||||||
С1 zNa2CO3 0,2моль л |
M 1 z Na |
CO |
V |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
3 |
|
|
р ра |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m Na2CO3 C 1 z Na2CO3 M 1 zNa2CO3 Vр ра |
|
|
||||||||||||||||||||||||
Найти: m Na2CO3 , |
|
|
|||||||||||||||||||||||||
С Na2CO3 , t Na2CO3 |
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
М Na2CО3 106г моль |
|
||||||||||
|
z Na2СO3 |
2 |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
М 1 zNa |
2 |
CО |
3 |
|
1 |
М Na |
2 |
CО |
3 |
|
1 |
106г моль 53г моль |
||||||||||||||
|
|
2 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
m Na2CO3 0,2моль л 53г моль 0,2л 2,12г |
|
|
||||||||||||||||||||||||
|
C Na2CO3 |
|
|
|
|
m Na2CO3 |
|
|
|
|
|
|
2,12г |
0,1 |
моль |
||||||||||||
|
|
M Na |
CO |
V |
|
106г моль 0,2л |
л |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
3 |
|
|
|
р ра |
|
|
|
|
|
|
|
|
||||
|
t Na2CO3 |
m Na2CO3 |
|
2,12г |
|
0,0106г мл |
|
|
|||||||||||||||||||
|
|
200мл |
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
Vр-ра |
|
|
|
|
|
|
|
|
|
|
|||||||
Ответ: m Na2CO3 2,12г , С Na2CO3 0,1моль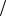 л, t Na2CO3 0,0106г
л, t Na2CO3 0,0106г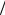 мл.
мл.
18

3. Определите молярную концентрацию и титр физиологического раствора с
W NaCl % 0,89% ( 1г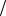 мл). Сколько граммов хлорида натрия требуется
мл). Сколько граммов хлорида натрия требуется
для приготовления 400 мл такого раствора?
Дано: |
Решение: |
|
|
|
|
|
|
|
|
|
|||
W NaCl % 0,89% |
М NaCl 58,5г моль |
|
|
|
|
|
|
|
|
|
|||
1г мл |
C NaCl |
W NaCl % 10 |
|
|
0,89% 10 1г мл |
0,152моль л |
|||||||
|
|
|
|
|
|
||||||||
Vр ра 400мл |
|
|
|
M NaCl |
|
|
|
|
|
58,5г моль |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
W NaCl % |
|
0,89% 1г мл |
|
|
|
||||||
Найти: C NaCl , |
t NaCl |
|
0,0089г мл |
||||||||||
t NaCl , m NaCl |
100% |
|
|
|
100% |
||||||||
|
|
|
|
|
|
|
|
||||||
m NaCl |
W NaCl % mр-ра |
|
|
W NaCl % Vр-ра |
|
||||||||
|
|
|
|
||||||||||
|
|
|
|||||||||||
|
|
100% |
|
|
|
|
100% |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m NaCl 0,89% 400мл 1г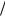 мл 3,56г 100%
мл 3,56г 100%
Массу хлорида натрия можно рассчитать и другими способами по формулам:
m NaCl C NaCl M NaCl V |
0,152 |
моль |
58,5 |
г |
0,4л 3,56г |
|
|
|
|||||
|
р ра |
|
л |
моль |
||
|
|
|
||||
m NaCl t NaCl Vр-ра |
0,0089г мл 400мл 3,56г |
|
|
|||
Ответ: C NaCl 0,152моль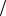 л, t NaCl 0,0089г
л, t NaCl 0,0089г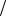 мл, m NaCl 3,56г .
мл, m NaCl 3,56г .
II. Задачи на приготовление растворов из кристаллогидратов.
1. Рассчитайте сколько граммов Na2B4O7 ∙ 10H2O следует взять для приготовления 500 мл раствора, титр которого равен 0,017 г/мл? Найдите молярную концентрацию эквивалента этого раствора.
Дано:
mр ра 500мл
t Na2B4O7 0,017г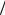 мл
мл
Найти:
m Na2B4O7 10H2O ,
C1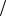 zNa2B4O7
zNa2B4O7
Решение:
М Na2B4O7 10H2O 382г моль |
М Na2B4O7 202г моль |
масса буры в растворе составляет:
m Na2B4O7 t Na2B4O7 Vр-ра 0,017г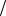 мл 500мл 8,5г
мл 500мл 8,5г
1 |
Na |
B |
O |
|
1 |
М 1 zNa |
B |
O |
|
1 |
202 |
г |
101 |
г |
|
|
|
моль |
моль |
||||||||||
z 2 |
4 |
7 |
2 |
2 |
4 |
7 |
2 |
|
|
|||||
C1 zNa2B4O7 |
m Na2B4O7 |
|
8,5г |
0,17 |
моль |
|||
M 1 zNa |
B |
O |
V |
101г моль 0,5л |
л |
|||
|
2 |
4 |
7 |
р ра |
|
|
|
|
19

Рассчитаем массу кристаллогидрата буры, необходимую для
приготовления раствора: |
|
|
202 г/моль (Na2B4O7) |
– |
382 г/моль (Na2B4O7 ∙ 10H2O) |
8,5 г (Na2B4O7) |
– |
x г (Na2B4O7 ∙ 10H2O) |
m Na2B4O7 10H2O 382г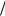 моль 8,5г 16,1 г 202г моль
моль 8,5г 16,1 г 202г моль
Ответ: C1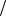 zNa2B4O7 0,17моль
zNa2B4O7 0,17моль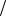 л, m Na2B4O7 10H2O 16,1г .
л, m Na2B4O7 10H2O 16,1г .
2.В дистиллированной воде объемом 500 мл растворили 50 г кристаллической щавелевой кислоты (H2C2O4 ∙ 2H2O). Определите массовую долю кристаллогидрата и безводной щавелевой кислоты в растворе.
Дано: |
Решение: |
|
|
|
V H2O 500мл |
Масса полученного раствора: |
|
||
m H2C2O4 2H2O 50г |
mр ра m H2O m H2C2O4 |
2H2O 500г 50г 550г |
|
|
|
Массовая |
доля |
кристаллогидрата |
H2C2O4 |
Найти: W H2C2O4 % , |
||||
W H2C2O4 2H2O % рассчитывается по формуле:
W H2C2O4 2H2O % m H2C2O4 2H2O 100%
mр ра
W H2C2O4 2H2O |
50г |
100% 9,1% |
|
||
|
550г |
|
М H2C2O4 2H2O 126г моль |
|
М H2C2O4 90г моль |
Масса безводной щавелевой кислоты в 50 г кристаллагидрата:
m H2C2O4 |
|
m H2C2O4 2H2O М H2C2O4 |
||
М H2C2O4 2H2O |
||||
|
|
|||
m H2C2O4 |
|
50г 90г моль |
35,7г |
|
|
||||
|
|
126г моль |
||
Массовая доля безводной H2C2O4 рассчитывается по формуле:
W H2C2O4 % m H2C2O4 100%
mр ра
W H2C2O4 % 35,7г 100% 6,5% 550г
Ответ: W H2C2O4 2H2O % 9,1%, W H2C2O4 % 6,5%.
20
