- •Ярославский государственный университет
- •2. Геометрическая (лучевая) оптика
- •3. Законы отражения и преломления света
- •4. Явление полного внутреннего отражения
- •1. Линзы. Ход лучей и построение изображений
- •2. Аберрации (погрешности) линз
- •3. Устройство и ход лучей в микроскопе
- •1. Волновые явления. Принцип Гюйгенса
- •2. Интерференция света
- •3. Дифракция света на круглом отверстии. Зоны Френеля
- •4. Дифракция Фраунгофера от щели
- •5. Дифракционная решетка
- •6. Дисперсия света
- •7. Поглощение света
- •1. Поляризованный свет
- •2. Методы получения поляризованного света
- •3. Явление вращения плоскости поляризации
- •Квантовая оптика
- •1. Тепловое излучение
- •2. Формулы Рэлея-Джинса и Планка
- •1. Фотоэффект
- •2. Тормозное рентгеновское излучение
- •3. Опыт Боте. Фотоны. Давление света
- •4. Эффект Комптона
- •6. Фотолюминисценсия
- •Квантовая физика и физика атома
- •1. Модели атома
- •1.1. Закономерности атомных спектров
- •1.2. Модель атома Томсона
- •1.3. Опыты Резерфорда. Ядерная модель атома
- •1.4. Постулаты Бора. Опыт Франка-Герца
- •Элементарная боровская теория атома водорода
- •1. Гипотеза де-Бройля. Волновые свойства вещества
- •2. Уравнение Шредингера
- •3. Квантово-механическое описание движения микрочастиц
- •4. Свойства волновой функции. Квантование
- •5. Частица в бесконечно глубокой одномерной потенциальной яме. Прохождение частиц через потенциальный барьер
- •6. Прохождение частицы через барьер
- •Квантово механическая теория атома водорода
- •Ядерная физики и физика элементарных частиц
- •1. Состав и характеристика атомного ядра
- •2. Масса и энергия связи ядра
- •3. Природа ядерных сил
- •4. Радиактивность
- •5. Ядерные реакции
- •Фундаментальные взаимодействия и элементарные частицы
Квантовая физика и физика атома
1. Модели атома
1.1. Закономерности атомных спектров
Изолированные атомы в виде разреженного газа или паров металла испускают спектр, состоящий из отдельных спектральных линий. В соответствии с этим спектр испускания атомов называется линейчатым. На рис. 1. показана часть спектра испускания атомов водорода в видимой и близкой ультрафиолетовой области. Аналогичный характер имеют и спектры других атомов. Линии в спектрах атомов объединяются в группы или, как их называют, серии линий. Символами Н, Н, Н, Н обозначены видимые линии, Н называется границей серии. Очевидно, что линии располагаются в определенном порядке. Бальмер установил, что длины волн показанной серии могут быть точно описаны формулой:
= 0n2/(n2 – 4), (1)
0 – константа, n – целое число, принимающее значения 3, 4, 5, …

Рис. 1.
В спектроскопии обычно пользуются величиной v = 1/ = v/c, которую называют волновым числом (не путать с k = 2/ = v/2c). Тогда из (1) получится:
v
= 1/
=
![]() (n
= 3, 4, 5, …), (2)
(n
= 3, 4, 5, …), (2)
где R = 4/0 – постоянная Ридберга, равная 109737,3090,012 см-1.
Пользуясь обычными обозначениями (2) можно записать:
= R![]() (n
= 3, 4. 5, …). (3)
(n
= 3, 4. 5, …). (3)
Формулы (2), (3) называются формулой Бальмера, а соответствующая ей серия линий – серией Бальмера. Она находится в видимой области.
В ультрафиолетовой области находится серия Лаймана, остальные серии находятся в ИК области спектра. Все они описываются уравнениями, аналогичными (3):
серия Лаймана
= R![]() (n
= 2, 3, 4. , …),
(n
= 2, 3, 4. , …),
серия Пашена
= R![]() (n
= 4. 5, 6, …),
(n
= 4. 5, 6, …),
серия Брэкета
= R![]() (n
= 5, 6, 7, …),
(n
= 5, 6, 7, …),
серия Пфуда
= R![]() (n
= 6, 7, 8, …).
(n
= 6, 7, 8, …).
Частоту любой линии можно представить обобщенной формулой Бальмера:
= R![]() , (4)
, (4)
где m принимает значение 1 для серии Лаймана, 2 для серии Бальмера и т. д., а n – все целочисленные значения, начиная с m + 1.
1.2. Модель атома Томсона
Согласно модели Томсона атом представляет собой равномерно заполненную положительным зарядом сферу радиуса R, внутри которой находится электрон. Напряженность поля положительно заряженной сферы определяется формулой Е(r) = er/R3. Если электрон вывести из положения равновесия, на него в этом поле будет действовать квазиупругая сила f = –eE = –e2r/R3 = –kr, под действием которой он начнет совершать колебания с частотой
=
![]() . (5)
. (5)
Оценка величины R для длин волн видимой части спектра в соответствии с (5) дает значение 3 10-8, что находится в неплохом соответствии с другими оценками размера атома. Однако эта модель приходила в несоответствие многим последующим экспериментам и носит чисто исторический интерес.
1.3. Опыты Резерфорда. Ядерная модель атома
Для выяснения характера распределения зарядов в атоме, было необходимо непосредственное опытное «зондирование» внутренних областей атома. Такое зондирование осуществили Резерфорд с помощью -частиц, наблюдая изменение направления их полета (рассеяние) при прохождении через тонкие слои вещества.
Известно, что -частицы образуются при радиоактивном распаде некоторых веществ и летят со скоростями V порядка 103 см/сек и имеют положительный заряд, равный удвоенному элементарному заряду. При потере этого заряда (при присоединении двух электронов) -частица превращается в атом гелия.
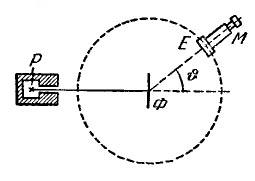
Схема опыта показана на рис. 2. Внутри полости, сделанной в куске свинца, помещалось радиоактивное вещество Р, служившее источником -частиц. На пути получавшегося узкого пучка -частиц располагалась тонкая металлическая фольга Ф. При прохождении через фольгу -частицы отклонялись от первоначального направления движения на различные углы . Рассеянные -частицы ударялись об экран Е, покрытый сернистым цинком, и вызываемые ими сцинтилляции (свечения) наблюдались в микроскоп М. Микроскоп и экран можно было вращать вокруг оси, проходящей через центр рассеивающей фольги, и устанавливать таким образом под любым углом .
|
Рис. 2. |
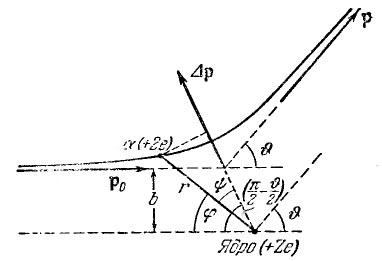
Рис. 3. |
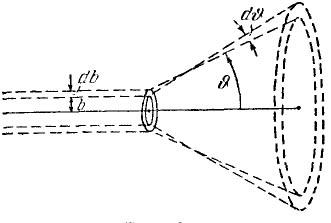
Рис. 4. |
Оказалась, что некоторые -частицы рассеивается на очень большие углы (почти до 180°). Проанализировав результаты опыта, Резерфорд пришел к выводу, что столь сильное отклонение -частиц возможно только в том случае, если внутри атома имеется чрезвычайно сильное электрическое поле, которое создается зарядом, связанным с большой массой и сконцентрированным в очень малом объеме. Основываясь на этом выводе, Резерфорд предложил ядерную модель атома, согласно которой атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом Ze имеющее размеры, не превышающие 10-12 см, а вокруг ядра распределены Z электронов по всему объему, занимаемому атомом. Исходя из таких предположений, Резерфорд разработал количественною теорию рассеяния -частиц и вывел формулу для распределения рассеянных частиц по значениям угла . При выводе формулы Резерфорд полагал, что отклонения -частиц обусловлены воздействием на них со стороны атомных ядер. Заметного отклонения из-за взаимодействия с электронами не может быть, поскольку масса электрона на четыре порядка меньше массы -частицы. Когда частица пролетает вблизи ядра, на нее действует кулоновская сила отталкивания f = 2Ze2/r2, под действием которой -частица начинает двигаться по гиперболе, асимптоты которой образуют между собой угол (рис. 3). Этот угол характеризует отклонение частицы от первоначального направления. Расстояние b от ядра до первоначального направления полета -частицы называется прицельным параметром. Чем ближе пролетает частица от ядра (чем меньше b), тем, естественно, сильнее она отклоняется (тем больше ). Между величинами b и можно установить соотношение, называющееся формулой Резерфорда:
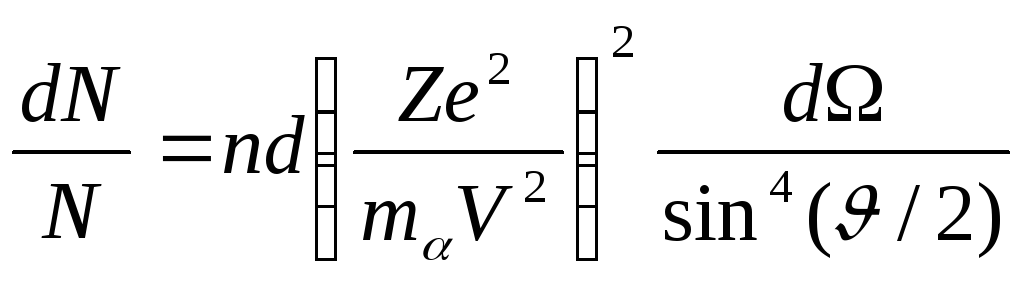 ,
(6)
,
(6)
где dN – число частиц рассеянных в пределах углов … + d (рис. 4), N – полное число рассеянных в пучке частиц.
Резерфорд с сотрудниками произвели проверку этой формулы путем подсчета сцинтилляций, наблюдавшихся под разными углами за одинаковые промежутки времени. В условиях опыта счету подвергались -частицы, заключенные в пределах одного и того же телесного угла (определявшегося площадью экрана и расстоянием его от фольги), поэтому число сцинтилляций, наблюдавшихся под разными углами, должно было быть, в соответствии с формулой Резерфорда, пропорционально 1/sin4(/2). Этот результат хорошо подтвердился на опыте. Зависимость рассеяния от толщины фольги и скорости -частиц также оказалась в соответствии с формулой (6).
Справедливость теории, исходящей из кулоновского взаимодействия между -частицей и ядром атома, свидетельствует о том, что даже отбрасываемая в обратном направлении -частица не проникает в область положительного заряда атома (как мы видели при рассмотрении модели атома Томсона. Летящая точно по направлению к ядру -частица подошла бы к его центру на расстояние, которое можно определить, приравняв кинетическую энергию -частицы потенциальной энергии взаимодействия -частицы с ядром в момент полной остановки частицы. Полученное значение имеет порядок 10-12 см и соответствует области, где локализован положительный заряд.
Таким образом, результаты опытов по рассеянию -частиц свидетельствуют в пользу ядерной модели атома, предложенной Резерфордом. Однако ядерная модель оказалась в противоречии с законами классической механики и электродинамики. Поскольку система неподвижных зарядов не может находиться в устойчивом состоянии, Резерфорду пришлось отказаться от статической модели атома и предположить, что электроны движутся вокруг ядра, описывая замкнутые траектории. Но в этом случае электрон будет двигаться с ускорением, в связи с чем, согласно классической электродинамике, он должен непрерывно излучать электромагнитные (световые) волны. Процесс излучения сопровождается потерей энергии, так что электрон должен двигаться по спирали со все уменьшающимся расстоянием до ядра и в конечном счете упасть на ядро.