
5 курс / Паллиативная помощь / Национальное_руководство_по_паллиативной_медицинской_помощи_в_онкологии
.pdf
4.Крылов В.В., Цыб А.Ф., Дроздовский Б.Я. Радионуклидная терапия у больных с метастатическими поражениями костей // Медицинская радиология и радиационная безопасность. 2006. 51. № 3. С. 65–74.
5.Модников О.П., Новиков Г.А., Родионов В.В. Современные подходы к лечению множественного метастатического поражения костей // Курс лекций по паллиативной помощи онкологическим больным / Под ред. Г.А. Новикова, В.И. Чиссова, О.П. Модникова. М., 2004.
Т.1. С. 493–541.
6.Расулова Н.В., Джалалов Ф.З., Арыбжанов Д.Т., Крылов В.В., Ходжибеков М.Х. Первый опыт применения новых технологий лечения костных метастазов с патологическими переломами позвонков и угрозой сдавления спинного мозга // Хирургия Узбекистана. 2012. № 1 (53). С. 39–44.
7.Расулова Н., Любшин В., Арыбжанов Д. и др. Эффективность лечения костных метастазов самарием-153 оксабифором (Sm-153 Oxabofore) в комбинированной терапии с моноклональным антителом Деносумаб (Xgeva): первый опыт // Consilium. 2014. № 1–2. С. 58–63.
8.Русаков И.Г., Быстров А.А., Амосов Ф.Р. Современная гормонотерапия распространенных форм рака предстательной железы // Онкоурология. 2006. № 2. С. 54–58.
9.Ялфимов А.Н., Жаринов Г.М., Некласова Н.Ю. Непосредственная эффективность системной терапии стронцием-89 у больных генерализованным раком предстательной железы // Паллиативная медицина и реабилитация. 2005. № 2. С. 71.
10.Baczyk M, Baczyk E, Sowinski J. Preliminary results of combined application of radioisotopes and biphosphonates in the management of pain associated with osteoblastic-osteolytic bone metastases of breast cancer. Ortop Traumatol Rehabil. 2003 Apr 30;5(2): 234—237.
11.Boni G., Pastina I., Genovesi D. et al. 153 – Sm-EDTMP combined with docetaxel in patients with hormone-refractory metastatic prostate cancer: preliminary data on toxicity and response. // Eur. J. Nucl. Med. & Molec. Imag., Vol. 33. Suppl. 2 Sept. 2006, Р.195.
12.ColemanR., Hadji P, Body J.-J., et all. Bone health in cancer: ESMO Clinical Practice Guidelinesy //Annals of oncology, 2020, Vol 31, Issue 12, p.1650–1663.
13.Chittenden SJ, Hindorf C, Parker CC, Lewington VJ, Pratt BE, Johnson B, Flux GD. A Phase 1, Open-Label Study of the Biodistribution, Pharmacokinetics, and Dosimetry of 223Ra-Dichloride in Patients with Hormone-Refractory Prostate Cancer and Skeletal Metastases // J Nucl Med. 2015 Sep;56(9):1304–9.
14.Liepe K, Kotzerke J. A comparative study of 188Re-HEDP, 186Re-HEDP, 153Sm-EDTMP and 89Sr in the treatment of painful skeletal metastases // Nucl Med Commun, 2007, 28, No. 8, P. 623–630.
15.Lipton A., Fizazi K., Stopeck A.T., et al. E ect of denosumab versus zoledronic acid in preventing skeletal-related events in patients with bone metastases by baseline characteristics. Eur. J. Cancer. 2016;53:75–83
16.Lewis B, Chalhoub E, Chalouhy C, Sartor O. Radium-223 in Bone-Metastatic Prostate Cancer: Current Data and Future Prospects // Oncology (Williston Park). 2015 Jul;29(7):483-8.
17.Nestaval A., Chodacki A., Rosendorf V. Atlas of Samarium Therapy. First edition. Praha, 2002, P. 65.
18.Nilsson S, Larsen RH, Fosså SD, Balteskard L, Borch KW, Westlin JE, Salberg G, Bruland OS. First clinical experience with alpha-emitting radium-223 in the treatment of skeletal metastases // Clin Cancer Res. 2005 Jun 15;11(12):4451-9.
19.Oosterhof GO, Roberts JT, de Reijke TM, Engelholm SA, Horenblas S, von der Maase H, Neymark N, Debois M, Collette L. Strontium(89) chloride versus palliative local field radiotherapy in patients with hormonal escaped prostate cancer: a phase III study of the European Organisation for Research and Treatment of Cancer, Genitourinary Group. Eur Urol. 2003 Nov;44(5):519-26.
60
20.Palmedo H, Manka-Waluch A, Albers P, et al. Repeated bone-targeted therapy for hormonerefractory prostate carcinoma: randomized phase II trial with the new, high-energy radiopharmaceutical rhenium-188 hydroxyethylidenediphosphonate // J Clin Oncol, 2003, 21, Suppl. 1, No. 15. P. 2869–2875.
21.Pecher С. Biological investigations with radioactive calcium and strontium: preliminary report on the use of radioactive strontium in the treatment of metastatic bone cancer. // Univ. Calif. Publ. Pharmacol. 1942; 2, p.1117–1149.
22.Rasulova N, Lyubshin V, Arybzhanov D, et al. Optimal timing of bisphosphonate administration in combination with samarium-153 oxabifore in the treatment of painful metastatic bone disease // World J Nucl Med, 2013, 12, No. 1. P. 14–18.
23.Roodman G.D. Mechanism of bone metastasis // N Engl J Med. 2004. No. 350. P. 1655–1664.
24.Silberstein E.B., Buscombe J.R., Mc. Ewans A., Taylor A. T. Society of nuclear medicine procedure guideline for palliative treatment of painful bone metastases. Society of nuclear medicine procedure guidelines manual. 2003. Р. 145–153.
25.H. Sinzinger, K. Weiss, Ju. Hiltunen Background, Reasons and Benefits Using the Vienna Protocol for the Treatment of Painful Bone Recurrences with 153Samarium-EDTMP Anticancer Research //August 2009, 29 (8) 3393—3395.
26.Tu SM, Millikan RE, Mengistu В et al. Bone-targeted therapy for advanced androgen-inde- pendent carcinoma of the prostate: a randomized phase II trial.// Lancet, 357: 336-41, 2001.
27.Turner J.H. Treatment of painful skeletal metastases. // Alasbimn Journal, Special Issue: 8-th World Congress of Nuclear Medicine, Number 17, Sept. 2002.
28.van Dodewaard-de Jong JM, de Klerk JM, Bloemendal HJ, et al. A phase I study of combined docetaxel and repeated high activity 186Re-HEDP in castration-resistant prostate cancer (CRPC) metastatic to bone (the TAXIUM trial) // Eur J Nucl Med Mol Imaging, 2011, 38, No. 11. P. 1990–1998.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

ЛЕКАРСТВЕННАЯ ПРОТИВООПУХОЛЕВАЯ ТЕРАПИЯ
Лекарственная противоопухолевая терапия у паллиативных пациентов с генерализованными
опухолевыми процессами
Л.В. Болотина
Для цитирования: Лекарственная противоопухолевая терапия у паллиативных пациентов с генерализованными опухолевыми процессами / Л.В. Болотина // Национальное руководство по паллиативной медицинской помощи в онкологии / Г.Р. Абузарова ; под ред. академика РАН, профессора А.Д. Каприна. — Москва : Молодая гвардия, 2022. — С. 62—78.
Лекарственная терапия, являясь системным методом лечения, представляет собой неотъемлемый компонент противоопухолевой терапии пациентов с диссеминированным опухолевым процессом. Неспроста употребляется термин «лекарственная терапия», так как в настоящее время этот вид противоопухолевого воздействия включает в себя разнообразные группы лекарственных препаратов, общим для которых является лишь способность оказывать системное воздействие на все проявления опухолевого процесса – от первичного очага до отдаленных, а иногда еще и недиагностируемых метастатических очагов, которые могут локализоваться в любых органах и тканях, включая головной мозг, костный мозг и др. В большинстве ситуаций при генерализованном опухолевом процессе именно лекарственная терапия является не только основным, но и самостоятельным видом паллиативного лечения. Вопросы интеграции паллиативной терапии в структуру помощи пациентам с онкологическими заболеваниями изучались на протяжении многих лет. Так, в 2012 году в рекомендациях панели экспертов по паллиативной помощи ASCO указано о необходимости начала подобной терапии в течение 8 недель от установления диагноза. В частности, в опубликованном в 2020 году исследовании Young-Rock Hong с соавторами отмечено, что в США с 2001 по 2015 год произошло сокращение времени до начала паллиативного лечения на 40% (с 13,6 до 8 недель). Также увеличилось число пациентов с клинически значимыми сопутствующими заболеваниями, которым назначалось паллиативное лечение. Еще одним важным выводом авторов из проведенного анализа явились сведения о том, что несмотря на то, что стоимость паллиативной помощи возрастает в силу более раннего ее начала, общая стоимость лечения пациента снижается. Дополнительным резервом снижения стоимости терапии является возможность ее оказания в условиях дневного стационара или амбулаторно. Отдельно авторы отметили значимое увеличение продолжительности жизни пациентов, получающих такой вид лечения. Для больных, получавших помощь в дневном стационаре, увеличение общей выживаемости составило 20%.
Среди лекарственной терапии выделяют несколько основных направлений. К ним относятся химиотерапия, гормональная терапия, использование таргетных (молекуляр- но-нацеленных) препаратов, иммуноонкологических средств, разработка и внедрение в клиническую практику которых произошли благодаря определению в опухолевых клетках молекулярных нарушений, определяющих их иммуногенность. Дополнительно в лечении пациентов применяются лекарственные средства, улучшающие качество жизни и помогающие создать условия для возможности проведения противоопухолевой терапии. Когда мы говорим о лечении паллиативной группы пациентов, то крайне важно стано-
62

вится определение целей, которых мы стремимся достичь. Это связано с тем, что речь идет о лечении пациентов, имеющих неизлечимое заболевание с неблагоприятным прогнозом. Кроме того, пациенты этой группы имеют сниженный функциональный статус, что ограничивает возможности применения высокотоксичных режимов терапии. Локализация метастатических очагов и связанные с ними клинические проявления также могут оказывать влияние как на возможность проведения противоопухолевого лечения, так и на выбор лекарственного препарата, а иногда метода его доставки к опухолевому очагу. Усложняет ситуацию и наличие у большинства пациентов сопутствующих заболеваний, которые могут декомпенсироваться на фоне генерализованного опухолевого процесса, интоксикации, а также в связи с возникновением нежелательных реакций при использовании противоопухолевых средств.
Основной целью лечения паллиативных пациентов является увеличение общей продолжительности жизни, а также сохранение или улучшение ее качества. Достижение этих целей является довольно сложной задачей, когда практикующему врачу необходимо определить наиболее оптимальный режим лекарственной терапии, который окажется не только эффективным при определенной нозологической форме заболевания, но будет обладать приемлемым профилем токсичности, а также может быть использован в сочетании с другими средствами, которые получает пациент в связи с сопутствующей патологией, с целью купирования болевого синдрома и т.д.
Как уже упоминалось, в лечении онкологических пациентов могут использоваться различные классы препаратов, которые иногда при довольно схожей эффективности имеют существенно отличающиеся профили безопасности. Наиболее часто приходится оценивать у паллиативных пациентов возможность применения цитостатиков, и, пожалуй, чаще всего оценке подлежит их кардиобезопасность, а также потенциальная нефротоксичность противоопухолевых средств. И если риски осложнений превышают ожидаемую клиническую пользу, необходимо использовать одну из стратегий снижения токсичности. Среди наиболее часто применяемых подходов можно выделить следующие:
●использование более безопасных форм химиопрепаратов (например, липосомальный доксорубицин; конъюгаты вместо традиционных антрациклинов);
●последовательное применение цитостатиков, а не одновременное (например, антрациклины, далее таксаны);
●инфузионное введение вместо болюсного;
●применение «метрономных» режимов (еженедельное введение вместо 1 раз в 3 недели), что позволяет вводить меньшую разовую дозу цитостатика;
●замена препаратов в пределах группы (цисплатин на карбоплатин; рибоциклиб на палбоциклиб);
●исходная коррекция дозы препаратов или редукция в процессе лечения;
●адекватный мониторинг и своевременная коррекция нарушений (консультации смежных специалистов) – мультидисциплинарная команда.
Существуют лекарственные препараты, от использования которых мы не можем отказаться с точки зрения онкологической целесообразности. При этом возможно использовать более безопасные формы цитостатиков, таких как липосомальные формы или конъюгаты, значимо снижающие негативное воздействие на здоровые ткани; в настоящее время уже отказались от одновременного использования антрациклинов и таксанов, прибегая к их последовательному применению; большинство болюсных введений заменили на инфузионные; в ряде случаев назначаются метрономные режимы с меньшей разовой дозой цитостатиков. В индивидуальных случаях может производиться замена препаратов
63
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
в пределах одной группы на менее кардио-, нейроили нефротоксичные или исходно корректироваться стартовая доза препарата. Ну и, конечно, должна быть обеспечена коррекция существующей сопутствующей (кардиальной, гастроэнтерологической, эндокринной, неврологической и др.) патологии до начала противоопухолевого лечения, а также проводиться адекватный мониторинг развития возможных нежелательных реакций и их своевременная коррекция. Следует проинформировать смежных специалистов о том, что пациенту предстоит прохождение противоопухолевого лечения и, возможно, они скорректируют свои назначения. Так как ряд противоопухолевых препаратов (например, многие таргетные агенты) может сам по себе провоцировать развитие артериальной гипертензии, кожных проявлений, а иммунные препараты – развитие эндокринопатий, консультация любых специалистов может понадобиться и в процессе проведения лечения.
Одной из частых проблем является назначение цисплатина у больных с невозможностью применения гипергидратации, высокими рисками повреждения почек, органа слуха, со значительно сниженным функциональным статусом. Для решения вопроса о возможности применения цисплатина зачастую используется понятие «подходящих» больных. Данный термин вошел в клиническую практику исходно относительно пациентов, страдающих метастатическим уротелиальным раком, став в последующем общеупотребимым независимо от варианта злокачественного новообразования. Среди основных параметров оценивают следующие:
●ECOG PS 2 и более (Karnofsky 60—70%);
●клиренс креатинина менее 60 мл/мин;
●снижение слуха (аудиометрия) 2-й степени и выше;
●периферическая нейропатия 2-й степени и выше;
●кардиальная патология (NYHA класс III).
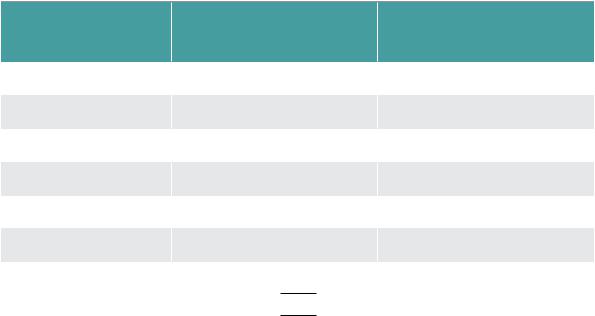
Больные, имеющие хотя бы один из вышеперечисленных критериев, не подходят для терапии цисплатином. Возможным решением данной проблемы может быть замена цисплатина на карбоплатин, который имеет несколько более широкие возможности применения, в том числе у более ослабленных пациентов со сниженной кардиальной функцией (табл. 1).
Таблица 1. Факторы, определяющие возможность
использования препаратов платины
Фактор |
«Не подходит» для |
«Не подходит» для |
|
ЦИСПЛАТИНХТ |
КАРБОПЛАТИНХТ |
||
|
|||
|
|
|
|
Возраст |
>75 лет индивидуально |
>80 лет индивидуально |
|
|
|
|
|
PS |
ECOG PS >1 |
ECOG PS >2 |
|
|
|
|
|
Почечная функция |
< 60 мл/мин |
< 45 мл/мин |
|
|
|
|
|
Кардиальная функция |
NYHA > I |
NYHA > II |
|
|
|
|
|
ОНМК |
исключение |
Неабсолютное ограничение |
|
|
|
|
|
Неконтролируемая АГ |
исключение |
Неабсолютное ограничение |
|
|
|
|
64

Нейропатия |
>1 исключение |
Неабсолютное ограничение |
|
|
|
Снижение слуха |
>1 исключение |
Неабсолютное ограничение |
|
|
|
Симптомные мтс в ГМ |
исключение |
Неабсолютное ограничение |
|
|
|
Психические отклонения |
исключение |
Неабсолютное ограничение |
|
|
|
Отсутствие ухода |
исключение |
Неабсолютное ограничение |
|
|
|
Риски усугубления существующей кардиальной патологии на фоне противоопухолевого лечения характерны для лечения пациенток, страдающих раком молочной железы (РМЖ). Известно, что наиболее часто как в мире, так и в нашей стране спорадический РМЖ устанавливается в возрасте 62–64 лет. К этому времени не менее 20% пациенток имеют риски удлинения интервала QT, что связано с различными вариантами кардиальной патологии (сердечная недостаточность, брадиаритмия, перенесенный инфаркт миокарда, нестабильная стенокардия) или наличием электролитного дисбаланса (гипо-/гиперкалиемия, гипо-/ гиперкальциемия, нарушение метаболизма магния или фосфатов). Дополнительно к этому некоторые препараты должны с осторожностью использоваться при удлинении интервала QT. В частности, к ним относятся гиполипидемические, гипогликемические средства, ингибиторы секреции соляной кислоты и т.д. Для обширной группы пациенток, имеющих люминальные HER-негативные типы диссеминированного РМЖ без признаков висцерального криза, клинические рекомендации всех профессиональных медицинских сообществ предполагают использование в качестве наиболее оптимального варианта 1 линии паллиативного лечения комбинированной эндокринотерапии на основе ингибиторов CDK 4/6 зависимых киназ. Однако для рибоциклиба, одного из препаратов данной группы, во всех проведенных рандомизированных клинических исследованиях (РКИ) были зафиксированы хоть и редкие, но документированные случаи удлинения интервала QT ≥ 2 степеней (более 480 мс) (табл. 2).
Таблица 2. Удлинение интервала QT в исследованиях с рибоциклибом
|
Рибоциклиб + |
Рибоциклиб + |
Рибоциклиб + |
Параметр, % |
летрозол |
фулвестрант |
НсИА/ Там |
|
(MONALEESA-2)4 |
(MONALEESA-3)5 |
(MONALEESA-7)6 |
|
|
|
|
|
QTcF |
QTcF |
QTcF |
|
|
|
|
|
Максимальные значения, |
|
|
|
отличные от исходных, мс |
|
|
|
|
|
|
≥480 |
3,3 |
5,6 |
7,0 |
|
|
|
|
|
Максимальное увеличение |
|
|
|
от исходного, мс |
|
|
|
|
|
|
≥60 |
2,7 |
6,5 |
10,0 |
|
|
|
|
65
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Изменения от исходного уровня, мс
|
Палбоциклиб + летрозол; |
|
Палбоциклиб + летрозол; |
|
ЭКГ: QTcS |
|
ЭКГ: QTcF |
150 |
|
150 |
|
|
|
||
100 |
|
100 |
|
50 |
|
50 |
|
0 |
|
0 |
|
-50 |
|
-50 |
|
-100 |
|
-100 |
|
-150 |
|
-150 |
|
|
C1D14 C2D14 C4D1 C7D1 C10D1 EOT |
|
C1D14 C2D14 C4D1 C7D1 C10D1 EOT |
|
Цикл терапии |
|
Цикл терапии |
График 1. Отсутствие негативного влияния палбоциклиба на увеличение
интервала QT в РКИ PALOMA-2 (не зафиксировано удлинения интервала QTc>480 мс или на >60 мс от исходного уровня)
Решением этой проблемы может быть замена препарата внутри группы на палбоциклиб, для которого такого рода негативного влияния в рамках РКИ зарегистрировано не было даже при включении в исследование PALOMA-2 пациенток с исходным увеличением интервала QT 1-й степени (график 1).
Дополнительной иллюстрацией необходимости учета профиля безопасности препаратов одной группы могут быть результаты метаанализа, опубликованные в 2020 году, в которых представлены данные по частоте нежелательных реакций при использовании палбоциклиба, рибоциклиба или абемациклиба. Метаанализ объединил сведения из 8 исследований о лечении 2799 пациентов люминальным метастатическим РМЖ, из которых 873 получали палбоциклиб, 1153 — рибоциклиб и 773 — абемациклиб. В пяти протоколах CDK 4/6 ингибиторы применялись в сочетании с ингибитором ароматазы (1524 больных), а в трех – с фулвестрантом (1275 больных). При схожей эффективности терапии в отношении первичной конечной точки (ВБП) были обнаружены значимые различия в профиле безопасности каждого из ингибиторов. Для палбоциклиба более выраженной в сравнении с другими препаратами данной группы оказалась нейтропения 3–4-й степени, тогда как для рибоциклиба и абемациклиба достоверно выше в сравнении с палбоциклибом была гастроинтестинальная токсичность. Прием рибоциклиба часто сопровождался тошнотой и рвотой, а для абемациклиба характерно развитие диареи. Наиболее часто досрочно из-за нежелательных явлений пациенты прекращали терапию абемациклибом (графики 2, 3).
Еще одна обширная группа лекарственных средств – таргетные препараты, которые используются для лечения большого числа различных злокачественных новообразований (ЗНО) и для которых характерны кардиологические нежелательные реакции (НР). Так, например, в исследовании III фазы SELECT при высокодифференцированном РЩЖ наиболее частой НР было развитие артериальной гипертензии (АГ), частота ко-
66

График 2. Характеристика нежелательных реакций на фоне приема
палбоциклиба и рибоциклиба у пациенток с люминальным HER-негативным метастатическим РМЖ
торой значимых степеней составила 43%. При этом стратегия редукции дозы позволила продолжать высокоэффективное противоопухолевое лечение, и частота отмены терапии из-за неконтролируемой АГ составила лишь 1%. Более того, очень интересным оказался тот факт, что возникновение АГ было своего рода суррогатным маркером эффективности терапии, так как ее возникновение было сопряжено с более высокими показателями частоты объективного ответа на терапию ленватинибом, времени беспрогрессивной и общей ВЖ. Абсолютно аналогичные закономерности были отмечены при использовании ленватиниба для лечения гепатоцеллюлярного рака: наиболее часто среди НР отмечалась АГ, частота ее также составила 42%. И аналогично раку щитовидной железы АГ коррелировала с увеличением общей продолжительности жизни. Помимо АГ возникновение диареи, протеинурии и гипотиреоидизма ассоциировалось с увеличением продолжительности жизни пациентов с гепатоцеллюлярной карциномой, получавших лечение в данном РКИ REFLECT. Таким образом, полученные данные подтверждают необходимость использования стратегии коррекции НР и при необходимости редукции дозы препарата, чтобы избежать преждевременной отмены таргетного агента с целью оптимизации терапии и получения максимальной пользы для больных паллиативной группы.
При отдельных ЗНО таргетные препараты могут использоваться в комбинированных режимах лекарственной терапии. В случае возникновения клинически значимых
67
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

График 3. Характеристика нежелательных реакций на фоне приема
палбоциклиба и абемациклиба у пациенток с люминальным HER-негативным метастатическим РМЖ
НР в первую очередь необходимо оценить, с каким из препаратов связано проявление токсичности. Примером может служить комбинация ленватиниба с эверолимусом, применяемая при лечении почечно-клеточного рака. В РКИ 205 ведущим нежелательным явлением стала диарея, в то время как для монотерапии ленватинибом наиболее часто фиксировалась АГ. Это позволяет законно предположить существенный вклад эверолимуса в развитие диареи. Для того чтобы можно было не снижать дозу и тем более не прерывать или отменять лечение, в первую очередь необходимо информировать пациента о тех реакциях, которые могут возникнуть. Уже на этом этапе важна роль мультидисциплинарной команды – совместной работы смежных специалистов. Врач, назначающий противоопухолевую терапию, должен обязательно посоветовать пациенту до начала терапии посетить кардиолога, эндокринолога и других специалистов, чтобы скорректировать и подобрать оптимальную терапию сопутствующих заболеваний. Более того, пациент заранее должен знать, к какому из специалистов (кардиологу, терапевту, эндокринологу, нефрологу) он должен обратиться при первых признаках токсичности на лечение конкретным противоопухолевым средством. Необходимо отметить, что НР значимых степеней, требующие коррекции дозы, развиваются не сразу. Временной интервал от возникновения до утяжеления реакции до 3-й степени может колебаться от месяца до трех. Примером может служить все та же комбинация ленватиниба с эверолимусом (табл. 3).
68

Таблица 3. Ленватиниб + эверолимус, метастатический почечно-клеточный
рак: медиана времени до развития новых или ухудшения уже имеющихся нежелательных явлений
Нежелательное явление |
Все степени, |
Степень 3, |
|
недели |
недели |
||
|
|||
|
|
|
|
Диарея |
4,1 |
8,1 |
|
Артериальная гипертензия |
4,9 |
6,9 |
|
Протеинурия |
6,1 |
20,1 |
|
Нарушения со стороны печени |
6,7 |
14,2 |
|
Ладонно-подошвенная эритродизэстезия (ЛПЭ) |
7,2 |
NA |
|
Нарушение функции почек/ |
8,1 |
8,1 |
|
почечная недостаточность |
|||
|
|
||
Геморрагические явления |
10,2 |
7,6 |
|
Снижение фракции выброса левого желудочка/ |
15,7 |
32,8 |
|
сердечная недостаточность |
|||
|
|
||
Венозные тромбоэмболические осложнения |
28,1 |
20,6 |
|
Гипокальцемия |
28,3 |
45,9 |
|
Удлинение интервала QT |
|
35,1 |
|
Артериальные тромбоэмболические осложнения |
69,6 |
69,6 |
Для оптимальной коррекции комбинированного режима прежде всего необходимо оценить, с каким из лекарств связаны проявления токсичности. Если с большей вероятностью отмечается связь с приемом ленватиниба (кардиальные проявления, АГ, снижение веса), то следует редуцировать дозу именно ленватиниба. При связи НР с эверолимусом надо попытаться сохранить полную дозу ленватиниба и произвести редукцию дозы эверолимуса.
В целом применение таргетных препаратов для ЗНО с наличием определенных генетических изменений является высокоэффективной альтернативой традиционным режимам цитостатиков. Яркими примерами являются: немелкоклеточный рак легкого НМРЛ с наличием активирующих мутаций EGFR, ALK; рак молочной железы; рак яичников; рак поджелудочной железы с наличием герминальных мутаций в генах BRCA1,2. Использование монорежимов таргетных агентов позволяет обеспечить не только более выраженный противоопухолевый эффект, но и существенно более благоприятный профиль токсичности, что позволяет проводить полноценное лечение паллиативной группе пациентов.
Мировая ситуация 2020 года поставила перед медицинским онкологическим сообществом крайне сложный, но очень важный вопрос: возможно ли проведение или продолжение противоопухолевого лечения в период пандемии? Проведенные за короткий срок исследования позволили выявить связь между риском инфицирования и рядом факторов, связанных с пациентом. Среди них значимыми оказались наличие диссеминированного опухолевого процесса, проведение химиотерапии, наличие сопутствующей патологии и сниженный функциональный статус. Результаты анализа были опубликованы в журнале Lancet в 2020 году (табл. 4).
За год было создано большое число клинических рекомендаций, которые допускают изменение тактики лечения онкологических больных с целью минимизации социальных контактов и посещения медицинских учреждений. Для реализации данного подхода
69
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
