

При лучевой терапии рака желудка в зону облучения неизбежно попадают жизненно-важные органы верхней половины брюшной полости, толерантность которых к ионизирующему излучению не высока. Максимальная лучевая нагрузка, допустимая при облучении верхнего отдела брюшной полости, не должна превышать 40-50 Грей, что намного ниже дозы, необходимой для разрушения железистых форм рака желудка (Okunieff Р. et al, 1995). Определение необходимой очаговой дозы у неоперабельных больных раком желудка представляет, следовательно, значительные трудности. При обширных поражениях желудка, при развитии опухоли на дегенеративно измененных тканях очаговая доза определяется не столько необходимой, сколько возможной при данных местных условиях величиной и общей реактивностью организма, а также целями и задачами данного метода лечения (П.К.Яшинскас с соавт., 1972; Overgaard I. еt al,.1995).
Рассматривая вопрос о величине суммарной дозы важно учитывать время, в течение которого она распределялась. Установлено, что преимущественное поражение опухолевой ткани при облучении обусловлено неодинаковой репаративной способностью нормальных и опухолевых клеток и реализуется при условии фракционированного лучевого воздействия (С.Н.Александров, 1972). При этом для большего повреждения опухоли целесообразно подведение суммарной дозы за несколько укрупненных фракций (В.С.Зуй, 1995).
Современные радиобиологические данные послужили основанием для разработки схем нетрадиционного фракционирования дозы излучения, которые нашли широкое применение при предоперационном облучении больных раком желудка.
Морфологические исследования удаленной после облучения опухоли позволили объективно оценить эффективность лучевого компонента лечения. Наиболее перспективной методикой предоперационного облучения оказалась нетрадиционная схема динамического фракционирования дозы (СДФ), разработанная в МНИОИ им. П.А. Герцена. Предоперационное облучение больных раком желудка в режиме СДФ в дозе 36-38 Грей позволило преодолеть радиорезистентность аденогенных опухолей желудка и получить в 40% случаев III-IV степень лучевого патоморфоза по методике Г.А. Лавниковой (32,123). По сообщению В.С. Зуя (1994) II-III степени лучевого патоморфоза были выявлены в 53,8% случаев после облучения по схеме СДФ в суммарной дозе 30 Грей. В том числе, при аденокарциноме желудка, лучевой патоморфоз III степени зафиксирован в 47% и при перстневидно-клеточном раке - в 46,7% случаев. Облучение в эквивалентной дозе в режиме классического фракционирования дозы обеспечило только I-11 степень лучевого патоморфоза.
Что касается других схем нетрадиционного фракционирования дозы облучения, то короткий предоперационный интервал и непродолжительность самого курса облучения (3-5 дней) не позволили использовать данный критерий для сравнительной оценки эффективности предложенных методик.
Тем не менее, большинство авторов отметили, что предоперационное облучение с использованием нетрадиционных режимов обеспечивает увеличение выживаемости оперированных больных по сравнению с теми, кто не получил лучевого воздействия или был облучен в классическом режиме (А.В.Бойко с соавт., 1995; О.В.Локтионова с соавт., 1995; М.И.Талаев с соавт., 1995).
Разнообразие методик лучевого и химиолучевого лечения больных с распространенным раком желудка базируется преимущественно на различии
50

представлений о необходимых величинах суммарных доз. Представляется более целесообразным применение эффективных и менее продолжительных нетрадиционных режимов облучения, что оправдано радиобиологическими особенностями опухолей желудка и более экономично.
Перспективным способом радиомодификации несомненно является совершенствование схем облучения, которое обладает разнонаправленным радиомодифицирующим эффектом. Фракционирование дозы излучения обеспечивает реоксигенацию опухоли, что избирательно повышает радиочувствительность опухолевых клеток по сравнению с нормальными. Одновременно в течение курса облучения происходит перераспределение клеток из резистентных фаз клеточного цикла в более чувствительные фазы. При этом величина разовой очаговой дозы и продолжительность курса облучения определяются радиочувствительностью и пролиферативной активностью опухолевой ткани (А.В.Бойко с соавт., 1995; К.П.Хансон с соавт., 1995).
Вклинике были апробированы различные схемы нетрадиционного фракционирования дозы лучевой терапии злокачественных опухолей желудка. Ряд авторов получили при этом увеличение средней продолжительности жизни больных с нерезектабельными процессом в сравнении с аналогичной группой больных, не получивших облучение в предоперационном периоде (Е.А.Надвикова, 1996; А.Р.Калашников с соавт., 1998).
На сегодняшний день лучевая терапия располагает богатым арсеналом средств, позволяющих повысить эффективность лучевого воздействия на такую радиорезистентную опухоль, какой является аденокарцинома желудка. Сюда относятся различные способы радиомодификации, новые виды излучения, применение которых положительно сказалось на результатах лучевого и комбинированного лечения рака желудка. Однако, широкое внедрение этих методов в клиническую практику зачастую ограничено их технической сложностью и высокой стоимостью. Неоценимым преимуществом в этом плане обладает наиболее простой и доступный метод радиомодификации - оптимизация схем лучевой терапии (А.В.Важенин, 1994; С.Л.Дарьялова с соавт., 1997).
Использование жестких режимов дозно-временных соотношений позволяет повысить эффективность и сократить продолжительность лечения. Последнее время интенсивное облучение находит все более широкое применение при лечении распространенных опухолевых процессов (В.М.Виноградов, 1995). Вместе с тем, возможности лучевой терапии неоперабельных больных раком желудка с учетом преимуществ нетрадиционного фракционирования изучены недостаточно.
Влитературе представлены довольно разноречивые мнения авторов о необходимых величинах суммарных и разовых доз. Кроме того, отсутствует четкое представление о целях и задачах лучевой терапии нерезектабельного рака желудка. Решение этих вопросов легло в основу настоящей работы, что позволило приблизиться к оптимальной лечебной тактике и улучшить результаты лечения этой достаточно тяжелой категории больных.
ВЧелябинском областном онкологическом центре за период с 1992 по 1998 годы были обследованы и получили лечение 219 больных распространенным раком желудка.
Преобладали возрастные группы от 51 до 60 лет (33,8%) и от 61 до 70 лет (51,0%). Среди исследуемых больных мужчин было 60,3% , женщин – 39,7%.
51

Под термином распространенного рака желудка понималась такая распространенность опухолевого процесса, при которой было невозможно радикальное хирургическое лечение.
В исследование включались больные, не получившие радикального хирургического лечения из-за наличия неудалимой первичной опухоли (Т4N1- 2М0) или регионарных метастазов (Т3-4N2М1), наличия отдаленных метастазов в органы брюшной полости (диссеминированный процесс Т3-4N1-2М1). Больные, отказавшиеся от операции, и те из них, кому хирургическое лечение не выполнено из-за тяжести сопутствующей патологии, отнесены к группе больных с местно-ограниченным процессом (Т2-3N0-2М0).
Влияние различных факторов на результаты лечения больных с распространенным раком желудка изучались раздельно среди больных после пробной лапаротомии (ПЛТ) и неоперированных больных.
В тех случаях, когда оперативное лечение не планировалось из-за распространенности заболевания, тяжести сопутствующей патологии или отказа больного от операции, лучевая терапия проводилась по схеме динамического фракционирования (СДФ) до суммарной дозы 34-56 Грей, что изоэффективно 40-60 Греям классического фракционирования.
Облучение в режиме СДФ применено у 34 неоперированных больных. Лечение 40 человек группы сравнения ограничилось симптоматическими мерами.
Из 145 оперированных больных 62 был проведен предоперационный курс лучевой терапии в режиме среднего фракционирования с дневным дроблением дозы (СФДДД) до суммарной очаговой дозы 25 Грей (2 фракции в день по 2,5 Грея с интервалом 4 часа 5 раз в неделю), что изоэффективно 42 Греям классического фракционирования. При последующей лапаротомии у этих больных был выявлен нерезектабельный опухолевый процесс. Группу сравнения составили 55 больных после пробной лапаротомии без облучения. Отдельно рассмотрена группа из 28 больных, которым был сформирован обходной гастроэнтероанастомоз (ГЭЛ) без лучевой терапии.
Прослежена сопоставимость исследуемых групп больных по основным прогностическим факторам, к которым отнесены распространенность процесса (стадия), морфологическая структура и форма роста опухоли. Установлено, что во всех исследуемых группах преобладала аденокарцинома (тубулярная, муцинозная, папиллярная). Несколько реже встречались опухоли с перстневидно-клеточной и недифференцированной структурами. Все опухоли имели инфильтративную или смешанную форму роста.
Особое внимание уделялось анализу распространенности процесса, так как данный фактор объяснял причину отказа от радикального хирургического лечения. Среди оперированных больных наиболее часто встречался диссеминированный процесс (до 64%) с метастатическим поражением печени или брюшины. В остальных случаях нерезектабельность была обусловлена наличием местно-распространенного процесса.
У половины из 74 неоперированных больных при обследовании был диагностирован местно-распространенный (21%) или диссеминированный (28%) процессы. У 38 (51%) больных по результатам обследования опухоль представлялась резектабельной (местно-ограниченный процесс). Этим больным операция не выполнена из-за тяжести сопутствующей патологии (54%) или в связи с отказом от операции (46%).
52

Изучение клинической картины у больных с распространенными стадиями рака желудка свидетельствует о том, что длительное время у них превалируют местные симптомы заболевания, что оправдывает применение такого локального метода воздействия, каким является лучевая терапия.
По литературным данным болевой синдром встречается у 60%-95% больных, диспепсические нарушения у 60% больных с 1V стадией заболевания. Наиболее тяжелая клиническая картина связана, как правило, с нарушением пассажа пищи при локализации опухоли в кардиальном или антральном отделах желудка.
Возникающее в результате облучения уменьшение размеров опухоли и ликвидация сопутствующего опухоли воспаления позволяют уменьшить или ликвидировать указанные выше симптомы, что значительно улучшает состояние больного. Подобные изменения клинической картины реализуются к окончанию лечения или в первые недели после его завершения и характеризуют непосредственные результаты терапии.
Непосредственный эффект лучевой терапии оценивался к окончанию курса лечения по степени обратного развития патологических симптомов на основании субъективных данных и проводился по следующей схеме:
0 - эффект не подлежит оценке в связи с отсутствием у больного функциональных нарушений;
1- полное исчезновение субъективных нарушений;
2- частичное улучшение;
3- отсутствие эффекта;
4– ухудшение.
Уряда больных предпринято эндоскопическое и рентгенологическое обследование по окончании лучевой терапии с целью получения объективного эффекта проведенного лечения. При этом не отмечено существенного уменьшения размеров опухолевого поражения, что объясняется преобладанием инфильтративных форм опухолевого роста.
Непосредственные результаты лечения изучались в группах больных, получивших облучение в режимах динамического и среднего фракционирования дозы с дневным дроблением дозы. При этом особое значение придавалось улучшению проходимости пищи, уменьшению болей, прекращению тошноты и рвоты.
53

|
|
|
|
|
|
Таблица |
|
|
Непосредственный эффект лучевой терапии в режиме СДФ у больных |
|
|
||||||
|
распространенным раком желудка |
|
|
|
||||
|
|
|
|
|
|
|
|
|
Симптомы |
Абсолютное |
Число больных |
Выраженность |
Число |
|
|||
Заболевания |
число больных |
с положительным |
эффекта |
|
больных, |
|||
|
с данным |
эффектом |
|
|
|
пролеченных |
||
|
симптомом |
|
|
|
|
|
без эффекта |
|
|
|
Абс. |
|
% |
Полный |
Частичный |
Абс. |
% |
Снижение |
9 |
8 |
|
88,9 |
- |
8 |
1 |
11,11 |
аппетита |
|
|
|
|
|
|
|
|
Боли в эпи- |
25 |
21 |
|
84,0 |
6 |
15 |
4 |
16,0 |
гастральной |
|
|
|
|
|
|
|
|
области |
|
|
|
|
|
|
|
|
Тошнота |
5 |
2 |
|
40,0 |
2 |
- |
3 |
60,0 |
Рвота |
2 |
1 |
|
50,0 |
1 |
- |
1 |
50,0 |
Дисфагия |
13 |
13 |
|
100 |
7 |
6 |
- |
0 |
Общее число |
34 |
27 |
|
79,4 |
- |
- |
7 |
20,6 |
больных |
|
|
|
|
|
|
|
|
Улучшение от проведенного лечения получено у 79,4% больных. Наиболее выражен эффект лучевой терапии в устранении дисфагии (100%), в половине случаев пассаж по пищеводу восстановился полностью.
Хорошо известны тяжелые проявления заболевания при распространении опухоли желудка на пищевод. Для ликвидации нарастающей дисфагии нередко приходится формировать гастроили энтеростомы, которые требуют специального ухода и причиняет больным массу неудобств. Устранение дисфагии в результате лучевой терапии позволяет отказаться от такого рода оперативных вмешательств, что, несомненно, имеет большое практическое значение.
Улучшение аппетита отметили 88,9% больных. Проявления болевого синдрома уменьшились у 84,0% больных. При этом полный эффект получен в 28% случаев, что позволило отказаться от приема анальгетиков. У 7 больных (20,6%) улучшения от проведенного лечения не получено.
В табл. 2 прослежено влияние морфологического варианта опухоли на непосредственные результаты облучения в режиме СДФ.
54

Таблица 2.
Влияние морфологического варианта опухоли на непосредственные результаты лучевой терапии в режиме СДФ
|
Общее |
Число больных с |
Число больных, |
||
Морфологический вариант |
число |
положительным |
пролеченных без |
||
|
больных |
эффектом |
|
эффекта |
|
|
|
Абс. |
% |
Абс. |
% |
Аденокарцинома |
21 |
17 |
80,5 |
4 |
19,5 |
|
|
|
|
|
|
Перстневидно-клеточный рак |
6 |
4 |
66,7 |
2 |
33,3 |
Недифференцированный рак |
7 |
6 |
85,7 |
1 |
14,3 |
Всего |
34 |
27 |
79,4 |
7 |
20,6 |
Не отмечено достоверной зависимости непосредственных результатов лечения от морфологического варианта опухоли (р 0,05), хотя частота положительных ответов была несколько выше при недифференцированном раке (85,7%) и ниже при перстневидно-клеточном раке (66,7%).
Таблица
Влияние распространенности процесса на непосредственные результаты лучевой терапии в режиме СДФ
Распространенность процесса |
Общее |
Число больных с |
Число больных, |
||
|
число |
положительным |
пролеченных без |
||
|
больных |
эффектом |
эффекта |
|
|
|
|
Абс. |
% |
Абс. |
% |
Местно-ограниченный процесс |
18 |
14 |
77,8 |
4 |
22,2 |
Местно-распространенный процесс |
11 |
9 |
81,8 |
2 |
18,2 |
Диссеминированный процесс |
5 |
4 |
80,0 |
1 |
20,0 |
Всего |
34 |
27 |
79,4 |
7 |
20,6 |
Из данных табл. следует, что частота положительных эффектов при диссеминированном процессе (80%) сравнима с таковой при местноограниченном и местно-распространенном процессах (77,8% и 81,8%), различия статистически недостоверны (р 0,05). Применение лучевой терапии при наличии отдаленных метастазов было оправдано, так как устранение местных симптомов заболевания способствовало улучшению общего состояния, положительно сказалось на физическом и психологическом статусе пролеченных больных.
Исключение составляют больные с обширной диссеминацией процесса, когда в клинической картине преобладают симптомы интоксикации.
Аденокарцинома желудка традиционно относится к радиорезистентным опухолям. В связи с этим большинство авторов связывают лучшие результаты лечения с большими значениями суммарных доз. Полученные нами данные опровергают сложившееся мнение в данном вопросе.
55

Таблица
Влияние величины суммарной очаговой дозы лучевой терапии в режиме СДФ на непосредственные результаты лечения
СОД в Гр |
|
Число больных с |
Число больных, |
|||
(изоэффективная |
Общее число |
положительным |
пролеченных без |
|||
доза классического |
больных |
эффектом |
эффекта |
|
||
фракционирования) |
|
Абс. |
% |
Абс. |
|
% |
34-38(40-44) |
20 |
16 |
80,0 |
4 |
|
20,0 |
|
|
|
|
|
|
|
46-54(50-60) |
14 |
11 |
78,6 |
3 |
|
21,4 |
|
|
|
|
|
|
|
Всего |
34 |
27 |
79,4 |
7 |
|
20,6 |
|
|
|
|
|
|
|
Количество больных, пролеченных с положительным эффектом, при увеличении суммарной очаговой дозы составило 80,0% и 78,6% соответственно. Данные различия статистически недостоверны (Х2=0,44; р>0,5).
Необходимо отметить, что у всех больных, отметивших улучшение, наиболее выраженные изменения регистрировались по достижении суммарной дозы, равной 34-38 Греям, или в первые недели после завершения терапии. Последующее локальное облучение после двухнедельного перерыва у 2 больных так и не привела к положительным сдвигам.
В свете полученных данных представляется нецелесообразным дальнейшее увеличение суммарной дозы, так как это не сказывается на непосредственных результатах и необоснованно увеличивает продолжительность лечения. Кроме того, облучение в дозе, изоэффективной 44 Греям не превышает толерантности нормальных тканей, что сводит к минимуму риск лучевых осложнений.
У больных, получивших облучение в режиме СФДДД, время проявления непосредственного эффекта совпадало с ранним послеоперационным периодом, что затруднило достоверную оценку последнего. Тем не менее, 70% больных отметили уменьшение или устранение имевшихся до операции симптомов заболевания.
Непосредственная эффективность лучевой терапии в режиме СДФ оказалась несколько более выраженной в сравнении с облучением в режиме СФДДД (79,4% и 70% соответственно). Достоверность данных различий установить не удалось из-за неоднородности групп больных.
Другим важным показателем эффективности любого метода лечения является динамика продолжительности жизни пролеченных больных. При проведении лечения с паллиативной целью использовать показатели трех- и пятилетней выживаемости не представляется возможным, так как большинство больных не доживает до этого срока. Кроме того, данный показатель не отражает истинный характер паллиативного эффекта.
Анализ отдаленных результатов лечения основывался на изучении выживаемости больных. В качестве таковых были рассмотрены показатели средней продолжительности жизни, одно и двухлетней выживаемости и стандартизованная выживаемость.
Достоверные сведения получены о судьбе 192 больных (92%), в том числе 125 оперированных и 67 неоперированных больных. Выбыло из-под
56

наблюдения в различные сроки от 4 до 8 месяцев 27 больных, все они учтены при составлении таблиц дожития. Средняя продолжительность жизни всех больных с распространенным раком желудка составила 9,3 0,4 месяцев. В том числе среди оперированных больных этот показатель составил 8,2 0,4 месяцев и 11,9 0,4 месяцев среди неоперированных больных.
Очевидно, что на результаты лечения оказывают влияние целый ряд прогностических факторов, значимость которых в литературе оценивается неоднозначно.
В работе рассмотрены наиболее существенные с нашей точки зрения характеристики, определяющие прогноз заболевания. К последним отнесены морфологический вариант опухоли, распространенность процесса и локализация опухоли в желудке. Для оценки влияния прогностических факторов на результаты лечения выполнен расчет показателей выживаемости в зависимости от каждого фактора.
Согласно выполненным расчетам локализация опухоли в желудке, не зависимо от метода лечения, не повлияла на отдаленные результаты, т.е. различия в выживаемости больных в группах сформированных по этому признаку, оказались статистически недостоверными (Х2=1,3;р>0,05).
Установлено, что в группе больных, подвергшихся пробному оперативному вмешательству, проведение предоперационной лучевой терапии в режиме СФДДД способствовало достоверному увеличению средней продолжительности жизни с 6,5 0,5 до 10,6 0,5 месяцев (Х2=32,5; р< 0,05).
Таблица Средняя продолжительность жизни оперированных больных в зависимости от
основных прогностических факторов (в месяцах)
Прогностические факторы |
Метод лечения |
|
Статистический анализ |
||||||
|
|
СФДДД |
ПЛТ |
ГЭА |
СФДДД / ПЛТ |
ГЭА / ПЛТ |
|||
|
|
|
(гр.срав |
|
|
|
|
|
|
|
|
|
|
Х2 |
|
р |
Х2 |
р |
|
|
|
|
нения) |
|
|
|
|
|
|
Морфо- |
Аденокар- |
10,4 0,9 |
6,2 1,6 |
7,0 1,0 |
5,9 |
|
<0,05* |
0,9 |
>0,05 |
логический |
цинома |
|
|
|
|
|
|
|
|
вариант |
Перстне- |
10,2 0,9 |
7,6 1,3 |
7,3 0,7 |
0,6 |
|
>0,05 |
0,03 |
>0,05 |
|
видно- |
|
|
|
|
|
|
|
|
|
клеточный |
|
|
|
|
|
|
|
|
|
рак |
|
|
|
|
|
|
|
|
|
Недиффе- |
10,6 1,2 |
4,7 0,5 |
8,7 2,2 |
5,9 |
|
<0,05* |
0,1 |
>0,05 |
|
ренцированн |
|
|
|
|
|
|
|
|
|
ый рак |
|
|
|
|
|
|
|
|
Распрост- |
Местно- |
10,3 0,8 |
7,3 1,6 |
5,6 1,3 |
2,3 |
|
>0,05 |
0,03 |
>0,05 |
ра- |
распростра- |
|
|
|
|
|
|
|
|
ненность |
ненный |
|
|
|
|
|
|
|
|
процесса |
процесс |
|
|
|
|
|
|
|
|
|
Диссеминир |
10,8 0,8 |
6,5 0,7 |
6,9 1,2 |
3,9 |
|
<0,05* |
0,6 |
<0,05* |
|
ованный |
|
|
|
|
|
|
|
|
|
процесс |
|
|
|
|
|
|
|
|
*- различия статистически достоверны
57
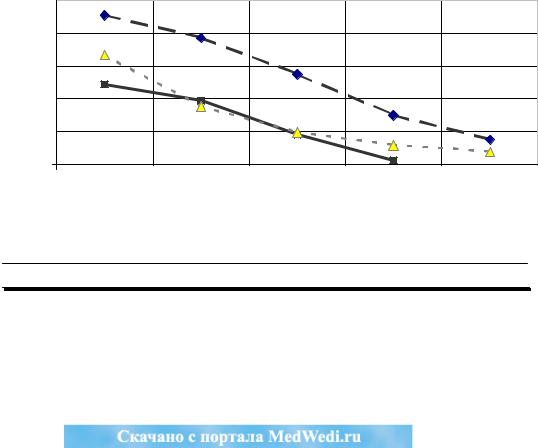
При различных морфологических формах и распространенности процесса получено улучшение выживаемости больных, облученных в режиме СФДДД. Более заметное, статистически достоверное увеличение средней продолжительности жизни под влиянием лучевой терапии в режиме СФДДД отмечено при недифференцированных морфологических формах (с 4,7 0,5 до 10,6 1,2 мес.) и диссеминированном опухолевом процессе (с 5,9 0,7 до 10,8 0,8 мес.) в сравнении с контрольной группой.
Таблица
Общая одно- и двухлетняя выживаемость оперированных больных в зависимости от метода лечения, в %
Выживаемость |
|
Методы лечения |
|
|
СФДДД |
ПЛТ |
ГЭА |
|
|
(гр.сравнения) |
|
Однолетняя |
35,7 8,2 |
12,7 4,5 |
17,1 6,8 |
Двухлетняя |
3,2 0,6 |
1,8 1,8 |
0 |
|
Облучение в режиме СФДДД способствовало увеличению однолетней |
|||||||
выживаемости по сравнению с больными, не получившими облучение с |
||||||||
12,7 4,5% до 35,5 8,2% и двухлетней – с 1,8 1,8% до 3,2 0,6%. |
|
|||||||
|
Установлено, что облучение в режиме СФДДД обеспечило улучшение |
|||||||
показателей стандартизованной выживаемости по отношению к |
группе |
|||||||
сравнения. Различия статистически достоверны (Х2 =55,9, р<0,01). |
|
|||||||
|
Средняя |
продолжительность |
жизни |
неоперированных |
больных, |
|||
в |
|
|
|
|
|
|
|
|
ы |
|
100 |
|
|
|
|
|
|
ж |
|
|
|
|
|
|
|
|
и |
|
80 |
|
|
|
|
|
|
в |
|
|
|
|
|
|
|
|
а |
|
60 |
|
|
|
|
|
|
е |
% |
|
|
|
|
|
|
|
м |
|
40 |
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
с |
|
20 |
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
ь |
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в |
|
|
4 |
8 |
|
12 |
16 |
20 |
|
|
|
|
|
Срок наблюдения в месяцах |
|
||


 группа СФДДД
группа СФДДД  контрольная группа (ПЛТ)
контрольная группа (ПЛТ) 

 группа ГЭА
группа ГЭА 
получивших облучение в режиме СДФ составила 14,7 1,3 месяцев и 8,4 1,0 месяцев в группе сравнения, различия статистически достоверны (Х2=13,48 р
58

0,05). Значения средней продолжительности жизни при различных морфологических формах и распространенности процесса прослежены в таблиц. Наиболее заметные и статистически достоверные изменения выживаемости в результате облучения в режиме СДФ отмечены при недифференцированном раке (с 6,4 0,6 до 16,3 3,9 мес.) и диссеминированном опухолевом процессе (с 3,9 0,4 до 11,7 1,0 мес.). Менее выраженное улучшение показателей средней продолжительности жизни имелось при всех вариантах аденокарциномы, а также при местно-ограниченном и местнораспространенном процессах.
Таблица Средняя продолжительность жизни неоперированных больных в зависимости от
основных прогностических факторов, в месяцах
|
|
Метод лечения |
Статистический |
||
Прогностические факторы |
|
|
анализ |
||
|
|
СДФ |
Симптоматическое |
Х2 |
Р |
|
|
|
лечение |
|
|
|
|
|
(гр.сравнения) |
|
|
Морфологи |
Аденокарцинома |
15,8 2,4 |
9,3 1,0 |
5,7 |
<0,05* |
ческий |
Перстневидно- |
9,1 2,6 |
8,0 0,6 |
1,35 |
>0,05 |
Вариант |
клеточный рак |
|
|
|
|
|
Недифференцирован |
16,3 3,9 |
6,4 0,6 |
6,04 |
<0,05* |
|
ный рак |
|
|
|
|
Распростра |
Местно- |
15,3 1,2 |
14,3 1,3 |
0,24 |
>0,05 |
ненность |
ограниченный |
|
|
|
|
Процесса |
процесс |
|
|
|
|
|
Местно- |
21,0 4,7 |
11,0 3,1 |
0,15 |
>0,05 |
|
распространенный |
|
|
|
|
|
процесс |
|
|
|
|
|
Диссеминированный |
11,7 1,0 |
3,9 0,4 |
14,2 |
<0,05* |
|
процесс |
|
|
|
|
* - различия статистически достоверны
Таблица Общая одно- и двухлетняя выживаемость неоперированных больных в
зависимости от метода лечения, в %
Выживаемость |
|
Метод лечения |
|
|
СДФ |
|
Симптоматич. терапия |
|
|
|
(гр.сравнения) |
Однолетняя |
47,6 9,5 |
|
24,7 8,1 |
Двухлетняя |
8,7 5,8 |
|
3,6 3,5 |
59
