
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / Национальное_руководство_по_паллиативной_медицинской_помощи_в_онкологии
.pdf
водно-электролитных нарушений, эндогенной интоксикации, при инфекционносептических осложнениях назначается антибактериальная терапия. Если кишечная непроходимость не разрешается, проведенное консервативное лечение будет являться предоперационной подготовкой.
При отсутствии признаков перфорации, перитонита, кровотечения, полной окклюзии просвета кишки опухолью может быть рекомендована установка саморасширяющихся металлических стентов. В случаях наличия множественных метастазов или поражения более 25 % объема печени, в сочетании с тяжелым общим состоянием больной, тяжелой анемией, риск от проведения хирургического вмешательства может оказаться выше, чем возможный положительный эффект. В таких случаях использование колоректальных стентов является относительно безопасным и действенным симптоматическим средством.
У больных ЗОЯ прогрессирование заболевания, как правило, ассоциировано с карциноматозом брюшины и явления кишечной непроходимости обусловлены имплантационными метастазами, которые деформируют и перекрывают просвет кишечника на том или ином уровне. Выбор хирургической тактики у этих пациентов представляет значительные трудности. В зависимости от локализации карциноматозных узлов, вызывающих кишечную непроходимость, могут быть выполнены следующие операции: проксимальная илеостомия (при расположении препятствия в дистальных отделах подвздошной кишки); формирование обходного энтеро-энтероанастомоза (при высоком уровне непроходимости). При локализации препятствия в правых отделах ободочной кишки (слепая, восходящая ободочная кишка, правый изгиб, проксимальная часть поперечной ободочной кишки): петлевая илеостомия или правосторонняя гемиколэктомия. При отсутствии декомпенсированной кишечной непроходимости и отсутствии тотального канцероматоза возможно выполнение правосторонней гемиколэктомии с формированием илео-транс- верзоанастомоза; при наличии отдаленных метастазов и/или тяжелом состоянии пациентки — формирование проксимальной кишечной стомы. При локализации препятствия в левых отделах ободочной кишки (дистальная часть поперечной ободочной кишки, левый изгиб, нисходящая ободочная кишка, сигмовидная кишка) — петлевая колостомия (сигмостомия, трансверзостомия – в зависимости от локализации опухоли). Также может быть выполнена резекция левых отделов ободочной кишки по типу операции Гартмана.
В условиях острой декомпенсированной кишечной непроходимости и канцероматоза брюшины от формирования анастомоза следует отказаться.
ВЛИЯНИЕ НА КАЧЕСТВО ЖИЗНИ И ПРОГНОЗ
Хирургическое лечение у пациенток с диссеминированными формами ЗОЯ в большинстве случаев направлено на улучшение качества жизни и устранение жизнеугрожающих симптомов. Это в свою очередь может облегчить состояние больных и дать возможность продолжить основное лечение и тем самым улучшить прогноз заболевания.
Литература
1.Adam RA, Adam YG. Malignant ascites: past, present, and future. J Am Coll Surg. 2004;198(6):999–1011.
2.Caceres A. Colorectal stents for palliation of large-bowel obstructions in recurrent gynecologic cancer: an updated series. Gynecologic Oncology 2008;108(3):482-5.
3.Caprotti R. Palliative surgery for recurrent bowel obstruction due to advanced ovarian cancer. Minerva Ginecologica 2006;58(3):239-44.
4.Chung M, Kozuch P. Treatment of malignant ascites. Curr Treat Options Oncol. 2008;9(2–3):215–33.
240

5.D.F. Kolomainen, A. Daponte, D.P. Barton, et al. Outcomes of surgical management of bowel obstruction in relapsed epithelial ovarian cancer (EOC). Gynecol Oncol, 125 (2012), pp. 31-36
6.Duran Gimenez-Rico H., et al., Hartmann’s procedure for obstructive carcinoma of the left colon and rectum: a comparative study with one-stage surgery. Clin Transl Oncol. 2005. 7(7):306-13
7.Fleming ND et al (2009) Indwelling catheters for the management of refractory malignant ascites: a systematic literature overview and retrospective chart review. J Pain Symptom Manage 38(3): 341–349
8.G. Mangili, Franchi M, Mariani A. Octreotide in the management of bowel obstruction in terminal ovarian cancer. Gynecologic Oncology 1996; 61:345-8
9.Gardener G.J., Reidy-Lagunes D., Gehrig P.A. Et al. Neuroendocrine tumors of the gynecological tract: A Society of Gynecologic Oncology (SGO) clinical document. Gynecol Oncol 2011;122(1): 190–8.
10.Gatta G., van der Zwan J.M., Casali P.G. et al. Rare cancers are not so rare: the rare cancer burden in Europe. Eur J Cancer 2011; 47:2493–511.
11.Hodge C, Badgwell BD. Palliation of malignant ascites. Journal of Surgical Oncology 2019;120(1):67-73.
12.Iyengar TD, Herzog TJ. Management of symptomatic ascites in recurrent ovarian cancer patients using an intra-abdominal semi-permanent catheter. Am J Hosp Palliat Care. 2002;19(1):35–8.
13.Kao HW, et al. The e ect of large volume paracentesis on plasma volume--a cause of hypovolemia? Hepatology. 1985;5(3):403–7.
14.Keen A, Fitzgerald D, Bryant A, Dickinson HO.2010Management of drainage for malignant ascites in gynaecological cancer Cochrane Database Syst RevCD007794
15.Khot U.P., Lang A.W., Murali K., et al. Systematic review of the e cacy and safety of colorectal stents. Br J Surg. 2002. 89(9):1096-102.
16.Kuo L.J., Leu S.Y., Liu M.C., et al. How aggressive should we be in patients with stage IV colorectal cancer? Dis Colon Rectum. 2003. 46(12):1646-52
17.Macdonald R, Kirwan J, Roberts S, Gray D, Allsopp L, Green J. Ovarian cancer and ascites: a questionnaire on current management in the United Kingdom. J Palliat Med. 2006; 9:1264–1270.
18.McNamara P. Paracentesis--an e ective method of symptom control in the palliative care setting? Palliat Med. 2000;14(1):62–4.
19.Meyer L, Suidan R, Sun C, Westin S, Coleman RL, Mills GB. The management of malignant ascites and impact on quality of life outcomes in women with ovarian cancer. Expert Review of Quality of Life in Cancer Care 2016;1(3):231-8.
20.Muduly, D.K. An Update in the Management of Malignant Pleural E usion / D. MudulyK, S.V. DeoS., T.S. Subi, et al. // Indian J Palliat Care. – 2011. – Т. 17. –№ 2. – С. 98–103.
21.Ooijen B, Burg ME, Planting AS, Siersema PD, Wiggers T. Surgical treatment of gastric drainage only for intestinal obstruction in patients with carcinoma of the ovary or peritoneal carcinomatosis of other origin. Surgery, Gynecology and Obstetrics 1993;176(5):469-74.
22.Özkul, S. Rapid pleurodesis is an outpatient alternative in patients with malignant pleural e u- sions: a prospective randomized controlled trial / S. Özkul, A. Turna, A. Demirkaya, et al. // J Thorac Dis. – 2014. – Т. 6. – № 12. – С. 1731–1735.
23.Parsons SL, Lang MW, Steele RJ. Malignant ascites: a 2-year review from a teaching hospital. Eur. J. Surg. Oncol. 1996; 22:237–239
24.Parsons SL, Watson SA, Steele RJ. Malignant ascites. Br J Surg. 1996;83(1):6–14.
25.Prat J. Ovarian sex cord-stromal and steroid cell tumors (Chapter 28). In: Mutter G.L.,
26.Redman CW. Survival following intestinal obstruction in ovarian cancer. Eurupean Journal of Surgical Oncology 1988;14(5):383-6.
27.Reynolds TB. Renaissance of paracentesis in the treatment of ascites. Adv Intern Med. 1990; 35:365–73.
241
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
28.Ripamonti C, Mercadante S. Pathophysiology and management of malignant 392 bowel obstruction. In: Doyle D, Hanks GW, McDonald N, Cherny N, eds. Oxford textbook of palliative medicine, 3rd 393 ed. New York: Oxford University Press, 394 2005:496-506
29.Roberts, M.E. Management of a malignant pleural e usion: British Thoracic Society pleural disease guideline 2010 / M.E. Roberts, E. Neville, R.G. Berrisford, et al. // Thorax. – 2010. – Т. 65 (Suppl 2). – С. 32-40
30.Seike M, Maetani I, Sakai Y. Treatment of malignant ascites in patients with advanced cancer: peritoneovenous shunt versus paracentesis. J Gastroenterol Hepatol. 2007;22(12):2161–6.
31.Srour, N. Management of malignant pleural e usions with indwelling pleural catheters or talc pleurodesis / N. Srour, K. Amjadi, A.J. Forster, et al. // Can Respir J. – 2013. –Т. 20. – № 2. – С. 06–110.
32.T. Perri, J. Korach, G. Ben-Baruch, et al.Bowel obstruction in recurrent gynecologic malignancies: defining who will benefit from surgical intervention. Eur J Surg Oncol, 40 (7) (2014), pp. 899–904
33.Tarin D, et al. Clinicopathological observations on metastasis in man studied in patients treated with peritoneovenous shunts. Br Med J (Clin Res Ed) 1984;288(6419):749–51
34.Tarin D, et al. Mechanisms of human tumor metastasis studied in patients with peritoneovenous shunts. Cancer Res. 1984;44(8):3584–92.
35.Tran E et al (2016) Malignant bowel obstruction in patients with recurrent ovarian cancer. Am J Hosp Palliat Care 33(3):272–275
36.Zarogoulidis, K. Malignant pleural e usion and algorithm management / K. Zarogoulidis, P. Zarogoulidis, K. Darwiche, et al. // J Thorac Dis 2013. – Т. 5. (S4). – С. 413-419
37.Ачкасов Е.Е., Пугаев А.В., Алекперов С.Ф. и соавт. Классификация обтурационной толстокишечной непроходимости опухолевого генеза // Колопроктология. 2009. № 3. C. 17–23.
38.Ашрафян Л.А., Антонова И.Б., Басова И.О. и др. // Опухоли женской репродуктивной системы. 2008. № 4. С. 57–63.
39.Бохман Я.В. Руководство по онкогинекологии. СПб., 2002. С. 240.
40.Гилязутдинов З.Ш., Михайлов М.К., Хасанов Р.Ш. Злокачественные новообразования органов репродукции у женщин. Руководство для врачей. Казань, 2007. С. 123.
41.Жестков К.Г. Торакоскопическая плеврэктомия и декортикация при метастатическом плеврите: аспекты хирургической техники / К.Г. Жестков, Р.Т. Ядута // Поволжский онкологический вестник. 2016. № 2. С. 43–47.
42.Завертыленко С.П. Метод лечения метастатических опухолевых плевритов внутриполостным введением полиплатиллена / С.П. Завертыленко, И.С. Бацей, А.А. Клюсов, А.А. Семенченко // Российский биотерапевтический журнал. 2013. Т. 12, № 2. С. 31.
43.Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2019. 250 с.
44.Острая кишечная непроходимость опухолевой этиологии у взрослых. Клинические рекомендации. 2017.
45.Ройтберг Г.Е. Внутренние болезни. Система органов дыхания / Г.Е. Ройтберг, А.В. Струтынский. М.: Изд-во £Бином¤, 2005. 464 с.
46.Севергин В.Е. Применение видеоторакоскопических оперативных вмешательств в лечении метастатических плевритов / В.Е. Севергин, В.В. Грубник, П.П. Шипулин, Амит Аграхари // Вестник неотложной и восстановительной медицины. 2013. Т. 14. № 4. С. 506–508.
47.Смирнова С.В. Выбор метода лечения стриктур мочеточника у больных злокачественными опухолями органов малого таза: дисс. … канд. мед. наук. М., 2009. С. 179.
48.Трахтенберг А.Х. Торакоскопическая флюоресцентная диагностика и внутриплевральная фотодинамическая терапия у онкологических больных с первичным и метастатическим плевритом / А.Х. Трахтенберг, В.В. Соколов, Е.В. Филоненко, Д.Г. Сухин, О.В. Пикин // Российский онкологический журнал. 2009. № 2. С. 8–11.

ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ЛЕЧЕНИЯ В ПАЛЛИАТИВНОЙ МЕДИЦИНЕ
Паллиативная фотодинамическая терапия в онкологии
В.Н. Капинус, Е.С. Филоненко
Для цитирования: Паллиативная фотодинамическая терапия в онкологии / В.Н. Капинус, Е.С. Филоненко // Национальное руководство по паллиативной медицинской помощи в онкологии / Г.Р. Абузарова ; под ред. академика РАН, профессора А.Д. Каприна. — Москва : Молодая гвардия, 2022. — С. 243—262.
ВВЕДЕНИЕ
Проблема борьбы со злокачественными новообразованиями остается приоритетной для современного общества, поэтому разработка и внедрение новых, высокотехнологичных методов лечения рака является актуальной проблемой современной медицины.Особую сложность представляет оказание помощи больным, не подлежащим радикальному лечению из-за распространенности опухолевого процесса или при неэффективности проводимой терапии. В решении этой задачи одно из ведущих мест в современной паллиативной онкологии заняла лазерная медицина, и в частности фотодинамическая терапия (ФДТ).
ФДТ основана на способности ряда химических веществ-фотосенсибилизаторов селективно накапливаться и удерживаться в ткани злокачественных опухолей. Под действием энергии лазерного излучения в сенсибилизированных клетках и тканях развиваются фотохимические реакции с выделением синглетного кислорода и свободных радикалов, что приводит к гибели и разрушению опухолевых клеток.
В результате злокачественная опухоль резорбируется и замещается соединительной тканью. Многие фотосенсибилизаторы обладают свойством флуоресцировать при облучении светом определенной длины волны, что в сочетании с их преимущественным накоплением в опухолевой ткани составляет основу флуоресцентной диагностики, которая может с успехом применяться для определения границ опухолевого поражения перед проведением специфического противоопухолевого лечения, а также для выявления скрытых опухолевых поражений кожи и слизистых оболочек.
Широкое клиническое применение метода в мире насчитывает более 40 лет, в России – 30 лет. Однако основы метода были заложены в далеком прошлом. Лечебные свойства солнечного света были описаны еще в античные времена. Геродот по праву считается отцом гелиотерапии, которая применялась для лечения широкого круга заболеваний. Фототоксический эффект на живые клетки ряда природных красителей был открыт лишь
в1900 году, когда О. Raab, работая под руководством профессора Н. Tappeiner в Мюнхенском университете, установил, что акридин, инертный в темноте, при облучении его
врастворе солнечным светом способен убивать такой одноклеточный организм, как парамеция. Метод был апробирован для лечения ряда заболеваний кожи, о чем имелись сообщения в 1903–1905 годах. Тогда же появился термин «фотодинамическое воздействие», а используемые природные красители получили название фотосенсибилизаторов.
ФДТ эффективно разрушает опухоль, максимально сохраняя окружающие здоровые ткани. Морфологические исследования изменений в тканях под влиянием ФДТ показа-
243
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

ли, что при разрушении клеточных элементов сохраняются коллагеновые волокна, то есть происходит так называемый «коллагенсохраняющий некроз».
Механизм действия ФДТ базируется также на том, что в результате фотохимических реакций запускается запрограммированный процесс гибели клеток (апоптоз); кроме того, существенное значение имеют и развивающиеся вторичные эффекты ФДТ, а именно нарушение кровоснабжения опухолевого узла за счет повреждения эндотелия сосудов и стимуляция иммунного ответа.
Внастоящее время ФДТ опухолей кожи широко используется во всем мире в связи с доступностью метода, удобством подведения светового излучения и контроля за результатами лечения.
Кроме того, к преимуществам ФДТ в сравнении с другими методами консервативного лечения опухолей относятся:
● селективное разрушение опухоли; ● стимуляция неспецифического иммунного ответа;
● совмещение в одном сеансе диагностической и лечебной процедур; ● отсутствие резистентности опухоли при многократном воздействии;
● возможность многократного применения метода без отрицательного влияния на здоровые органы и ткани;
● экономическая эффективность при использовании отечественных фотосенсибилизаторов и лазерной аппаратуры.
Внастоящее время в мире и в России накоплен большой опыт применения ФДТ с использованием различных классов фотосенсибилизаторов. Поскольку производные гематопорфирина стали первыми фотосенсибилизаторами для ФДТ, большинство литературных данных, касающихся данного метода, получено с применением препаратов этой группы (фотофрин I и фотофрин II в США; фотосан в Германии; фотогем в России). В мире накоплен богатый опыт использования производных гематопорфирина для флуоресцентной диагностики и ФДТ рака кожи. Препараты других групп, как правило, по своим характеристикам и фотодинамической активности сравниваются с производными гематопорфирина. Другим распространенным в настоящее время препаратом для диагностики и лечения рака кожи является 5-аминолевулиновая кислота (5-АЛК). Это вещество под разными торговыми названиями производит ряд фирм (Левулан — в США, Аласенс — в России и др.).
Впоследние годы ведутся активные исследования по использованию производных фталоцианина в качестве фотосенсибилизаторов для ФДТ. Главными преимуществами этих соединений являются их химическая однородность, растворимость, поглощение света в длинноволновой части спектра (675–680 нм), высокий коэффициент экстинкции и высокий квантовый выход синглетного кислорода. Российский препарат Фотосенс, относящийся к данному классу, тоже имеет ряд преимуществ перед фотосенсибилизаторами первого поколения, созданными на основе производных гематопорфирина: препарат обладает высокой фотодинамической активностью в красной области спектра и имеет пик поглощения на длине волны, для которой ткани являются более «прозрачными» для лазерного излучения, что дает возможность лечить более глубоко расположенные опухоли.
Большой интерес в качестве фотосенсибилизаторов вызывают производные хлорина.
ВРоссии проведены исследования соединений хлоринового ряда с целью создания на их основе лекарственных форм. Была разработана технология извлечения из растительного сырья комплекса биологически активных хлоринов, которые содержат в качестве основного компонента хлорин е6. В результате были созданы фотосенсибилизаторы второго
244

поколения − радахлорин и фотодитазин, которые способны разрушать опухоль при возбуждении светом с длиной волны 662 нм. Препараты имеют высокий квантовый выход синглетного кислорода, высокую флуоресцентную контрастность опухоль/норма, а также быструю фармакокинетику, позволяющую сократить время соблюдения светового режима после введения фотосенсибилизатора до 3–4 дней.
Введущих медицинских центрах России методики ФДТ с использованием отечественных фотосенсибилизаторов (фотогем, фотосенс, радахлорин, фотодитазин, фоторан и аласенс-индуцированный ППIX) разрабатываются и применяются для лечения больных со злокачественными первичными, рецидивными и метастатическими опухолями кожи с 1992 года.
Внастоящее время определены оптимальные параметры ФДТ в зависимости от стадии заболевания, а также от формы роста и локализации опухоли, отработаны показания и противопоказания к назначению ФДТ, сроки проведения диагностических и лечебных мероприятий и т.д.
Всвязи с хорошей переносимостью и высокой эффективностью ФДТ не уступает традиционным методам лечения и синергично сочетается с ними, поэтому является все более востребованным и в паллиативной медицине.
ФДТ практически не имеет противопоказаний, абсолютными противопоказаниями являются сердечно-сосудистая и дыхательная недостаточность, заболевания печени и почек в стадии декомпенсации, системная красная волчанка, кахексия.
ПАЛЛИАТИВНАЯ ФДТ ПРИ ПЕРВИЧНОМ И МЕТАСТАТИЧЕСКОМ ПОРАЖЕНИИ КОЖИ
Не будет преувеличением утверждение, что в современной онкологии злокачественных новообразований кожи ведущее место заняли лазерные технологии как наиболее наукоемкие, перспективные и, как показал клинический опыт, эффективные. Одна из лазерных технологий, а именно фотодинамическая терапия (ФДТ), наряду с лучевой и химиотерапией, во многих специализированных клиниках России стала полноправным
ивысокотехнологичным компонентом комбинированного лечения как первичных, так
ирецидивных опухолей кожи, которое проводится по радикальной и паллиативной программам, самостоятельно и в качестве компонента комбинированной терапии.
Общепринятыми показаниями к применению ФДТ при злокачественных опухолях кожи являются: первичные, рецидивные, остаточные и метастатические опухоли; опухоли устойчивые к традиционным методам лечения; множественные опухоли; опухоли большой площади; опухоли, расположенные в сложных анатомических зонах (наружный слуховой проход, веки, крылья носа и т.д.).
При местно-распространенных, эрозивно-язвенных и узловых формах, непрерывно рецидивирующих опухолях кожи ФДТ может выполняться с паллиативной целью для достижения гемостатического и противовоспалительного эффекта, уменьшения экзофитной части опухоли.
Втаких ситуациях, как правило, применяется методика пролонгированной ФДТ с однократным введением препарата фотосенс или введением перед каждым сеансом фотосенсибилизаторов хлоринового ряда и фракционированием дозы лазерного облучения. Необходимость разработки данной методики объясняется тем, что при этих заболеваниях проведение ФДТ с использованием стандартных доз лазерного облучения
245
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

приводит к обширному и глубокому некрозу опухоли и окружающих тканей, вызванному одномоментным применением терапевтической дозы лазерного излучения по всей поверхности опухоли; как следствие возможно резкое ухудшение общего состояния пациента с развитием у него болевых реакций, а также интоксикации, обусловленной всасыванием продуктов некроза опухоли большой площади. Применение пролонгированной ФДТ повышает эффективность лечения инфильтративных злокачественных опухолей кожи, имеющих площадь поражения 100 см2 и более, за счет снижения риска непосредственных и отдаленных осложнений. Оптимизация режима ФДТ достигается путем фракционирования терапевтической дозы лазерного облучения. Суть метода в том, что снижают разовую дозу облучения (плотность энергии в расчете на один сеанс), чтобы исключить развитие местных осложнений и одномоментного обширного некроза в зоне ФДТ, но при этом общую курсовую дозу делают больше стандартной за счет удлинения курса лечения до 7–10 сеансов. Фотодинамический эффект при многократном ежедневном лазерном облучении развивается постепенно, с медленной резорбцией опухоли и минимальным повреждением окружающих тканей. Развитию противоопухолевого эффекта при пролонгированном световом воздействии способствует свойство фотосенса длительно (до 7–10 дней) удерживаться в терапевтической концентрации в опухолевой ткани, что подтверждается данными флуоресцентной диагностики.
Опубликован успешный опыт ФГБУ «НМИЦ радиологии» пролонгированной ФДТ
спрепаратом фотосенс и фракционированием дозы лазерного облучения у 33 больных местно-распространенным базальноклеточным раком кожи ТIII-IVN0M0 (площадь очагов рака кожи составляла от 9 до 60 см2). Полная регрессия опухоли наблюдалась в 61% случаев, частичная регрессия – в 22%, ограниченная регрессия – в 17%, срок безрецидивного наблюдения составлял до 6 лет, а больным с частичной регрессией опухоли проводились повторные курсы ФДТ. Данная методика была не менее успешно применена и у больных с рецидивами рака кожи головы после ранее выполненного хирургического лечения (моноблочные резекции опухоли, мягких тканей и костных структур черепа
спластикой), у всех пациентов группы(38 человек) отмечался гемостатический эффект после первых сеансов облучения, а также ослабление болевого синдрома и уменьшение опухолевой массы после окончания ФДТ. Стабилизация опухолевого процесса произошла у 28% больных. Максимальный срок наблюдения – 3,5 года.
Еще в одном научном исследовании (В.Н. Капинус и соавт.) представлены результаты многокурсовой ФДТ только уже с фотосенсибилизатором хлоринового ряда у 166 больных местно-распространенным первичным и рецидивным базальноклеточным и плоскоклеточным раком кожи, использовались малые световые дозы и повторные сеансы для поэтапного разрушения опухоли. Полная регрессия опухолевых очагов была зарегистрирована у 88,0%, частичная регрессия – у 9,6% пациентов, стабилизация в течение 3–6 мес. – у 2,4% пациентов с обширными образованиями более 12,0–15,0 см в диаметре, что позволило значительно уменьшить объем опухолевых масс, купировать болевой синдром и улучшить качество жизни (рис. 1). На сроках наблюдения от 6 мес. до 5 лет у 22,3% пациентов были диагностированы локализованные рецидивы заболевания, на которые были проведены повторные курсы ФДТ или лучевая терапия. Среднее время до появления рецидива заболевания составило 29,2 ± 4,1 мес.
Взарубежной литературе также есть ряд публикаций о применении ФДТ с паллиативной целью у пациентов с обширными новообразованиями кожи, которым невозможно в силу тех или иных причин выполнить радикальное лечение или у которых уже развилась резистентность к лекарственной терапии.
246
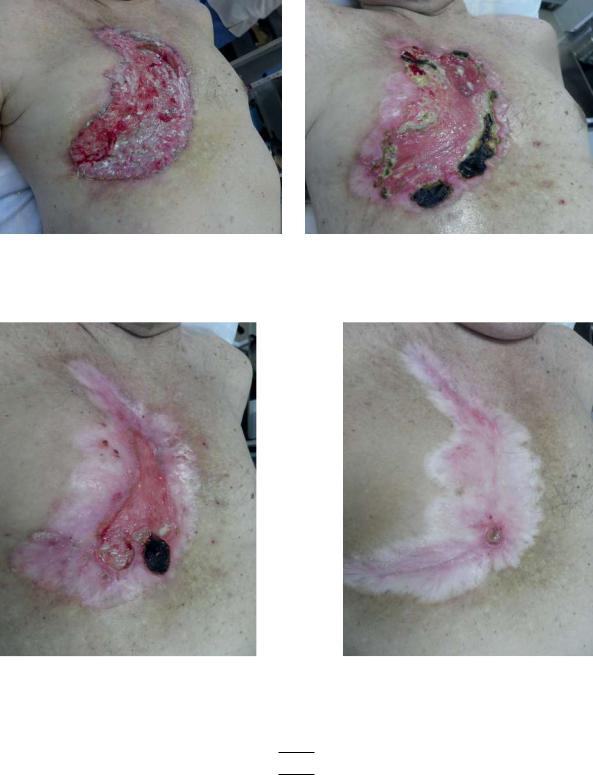
Клинический пример № 1. Пациент Е., 76 лет. Диагноз: Базальноклеточный рак кожи грудной стенки справа, сT3N0M0
а) до ФДТ (15,0х20,0 см) |
б) 3 мес. после 1-го курса ФДТ |
в) 5 мес. после 2-го курса ФДТ |
г) 12 мес. после 3-го курса ФДТ |
Рис. 1.
247
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

Клинический пример № 2. Диагноз: Базальноклеточный рак кожи правой височной, скуловой и околоушной областей, сT3N0M0
а) до ФДТ (9,0×9,5 см)
б) через 2 мес. после ФДТ
в) через 6 мес. после ФДТ
Рис. 2. Пациентка М., 81 год.
Диагноз: Базальноклеточный рак кожи правой височной, скуловой и околоушной областей, сT3N0M0
Исследования показывают, что ФДТ достаточно эффективна в качестве паллиативного лечения у инкурабельных больных с местно-рас- пространенными и рецидивными опухолями кожи (рис. 2).
Наряду с первичными и рецидивными злокачественными опухолями особое место занимает
метастатическое поражение кожных покровов. По данным литературы, частота метастазов рака внутренних органов в кожу колеблется от 0,29 до 3,3%.
Из метастатических злокачественных опухолей кожи наибольшую группу составляет рак молочной железы. Частота метастазирования рака молочной железы в кожу составляет от 20 до 30%. Метастазы чаще локализуются на грудной стенке вблизи от первичной опухоли и преимущественно развиваются после хирургического лечения. Основным методом лечения больных с внутрикожными метастазами рака молочной железы остается химиоили гормонотерапия с многократным повторением курсов лечения. Однако полный или частичный регресс метастазов рака молочной железы в коже и мягких тканях грудной клетки достигается только в 22–27% случаях со сроком ремиссии не более 2–3 мес. Рост метастазов проявляется в виде целого симптомокомплекса: кожный зуд, боли, ограничения подвижности верхней конечности, в дальнейшем появляется изъязвление зон метастазирования, кровоточивость, возможно инфицирование. ФДТ в таких ситуациях становится методом выбора и может проводиться как самостоятельно, так и в сочетании с другими методами лечения.
Об успешном применении ФДТ при лечении метастазов в кожу рака молочной железы имеется ряд как отечественных, так и зарубежных публикаций.
В одном из сообщений пролонгированная ФДТ с препаратом фотосенс и фракционированием дозы лазерного облучения была проведена 61 больной с внутрикожными метастазами рака молочной железы, площадь поражения составила от 40 до 500 см2 и имелся раковый лимфангит
248

Клинический пример № 3
а) после проведения многокурсовой ФДТ
б) 1,5 мес. после проведения ФДТ
|
Рис. 3. Клинический пример. |
|
Пациентка А., 67 лет. Диагноз: |
|
Метахронный рак молочных желез: |
|
рак правой молочной железы, |
|
Т1N2М0, I ст. (комбинированное |
|
лечение в 1992 г.: радикальная |
|
мастэктомия, лучевая терапия); |
|
рак левой молочной железы, |
|
Т1N2М0, III ст. (комбинированное |
|
лечение в 2011 г.: радикальная |
|
мастэктомия, лучевая терапия). |
|
Прогрессирование заболевания |
|
(2012 г.): множественные |
|
метастазы в кожу передней |
в) 3 мес. после проведения ФДТ |
грудной стенки |
249
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
