
6 курс / Гастроэнтерология / Российский_журнал_гастроэнтерологии,_гепатологии,_колопроктологии (54)
.pdf
Содержание
Редакционная
В.Т. Ивашкин |
|
|
|
Иммунный гомеостаз и иммунные заболевания печени...................................................... |
4 |
||
Лекции и обзоры |
|
|
|
С.Ф. Галимова, М.В. Маевская, В.Т. Ивашкин |
|
||
Современные подходы к лечению больных хроническим гепатитом В................................ |
13 |
||
О.Ю. Катикова, Е.В. Ших |
|
|
|
Особенности витаминного статуса у больных с заболеваниями печени |
|
||
различной этиологии. Возможности витаминотерапии...................................................... |
21 |
||
И.Н. Григорьева |
|
|
|
Билиарный сладж........................................................................................................ |
|
|
32 |
Оригинальные исследования |
|
|
|
В.В. Цуканов, О.В. Хоменко, О.С. Ржавичева, Н.Н. Буторин, О.В. Штыгашева, |
|
||
А.С. Маады, Т.Б. Бичурина, О.С. Амельчугова |
|
||
Распространенность Helicobacter pylori и ГЭРБ у монголоидов |
|
||
и европеоидов Восточной Сибири.................................................................................. |
38 |
||
И.А. Булатова, В.В. Щёкотов, А.П. Щёкотова |
|
||
Функциональное состояние эндотелия при хроническом гепатите С................................... |
42 |
||
С.Г. Шаповальянц, А.А. Линденберг, И.П. Марченко, |
|
||
К.Б. Луммер, С.С. Согрешилин |
|
|
|
Особенности проведения санационных вмешательств |
|
||
при распространенном перитоните................................................................................. |
46 |
||
Национальная школа гастроэнтерологов, гепатологов |
|
||
С.Т. Метельский |
Вести |
|
|
|
|
|
|
Физиологические механизмы всасывания в киш чнике..................................................... |
51 |
||
Н.М. Леоневская, С.И. Эрдес, М.А. Ратникова |
|
||
|
- |
|
57 |
Протокол лечения болезни Гиршпрунга у д й............................................................... |
|||
Новости колопроктологии |
|
|
|
Э.Э. Болквадзе |
Ми хирургического лечения острого |
|
|
Особенности диагностики |
63 |
||
анаэробного парапроктита............................................................................................ |
|
|
|
Обмен опытом |
|
|
|
В.Т. Ивашкин, М.А. Морозова, М.В. Маевская, Е.А. Федосьина |
|
||
Препараты растительного происхождения в лечении гепатита С........................................ |
70 |
||
А.О. Буеверов |
|
|
|
Профилактика и коррекция гематологических побочных эффектов |
|
||
противовирусной терапии хронического гепатита С......................................................... |
76 |
||
Методические рекомендации |
|
|
|
Лечение осложнений цирроза печени |
|
||
(Методические рекомендации для врачей)...................................................................... |
82 |
||

Соntents
Editorial
V.Т. Ivashkin |
|
|
|
Immunological homeostasis and immune diseases of liver...................................................... |
4 |
||
The lectures and reviews |
|
|
|
S.F.Galimova, М.V. Mayevskaya, V.Т. Ivashkin |
|
||
Modern approaches to the treatment of patients with chronic hepatitis B.............................. |
13 |
||
O.Yu. Katikova, Ye.V. Shikh |
|
|
|
Features of the vitamin status in patients with liver diseases of various etiology. |
21 |
||
Potentials of vitamin therapy................................................................................. |
|||
I.N. Grigorieva |
|
|
|
Biliary sludge.............................................................................................................. |
|
|
32 |
Original investigations |
|
|
|
V.V. Tsukanov, O.V. Khomenko, O.S. Rzhavicheva, N.N. Butorin, O.V. Shtygasheva, |
|
||
A.S. Maady, T.B. Bichurina, O.S. Amelchugova |
|
||
Prevalence of Helicobacter pylori and GERD at Mongoloids and Caucasians |
|
||
of Eastern Siberia......................................................................................................... |
|
|
38 |
I.A. Bulatova, V.V. Schekotov, A.P. Schekotova |
|
||
The functional state of endothelium at chronic hepatitis C.................................................. |
42 |
||
S.G. Shapoval’yants, A.A. Lindenberg, I.P. Marchenko, |
|
||
K.B. Lummer, S.S. Sogreshilin |
|
|
|
Features of debridement at the diffuse peritonitis.............................................................. |
46 |
||
National college of gastroenterologist, hepatologist |
|
|
|
S.T. Metelsky |
Вести |
|
|
|
|
|
|
Physiological mechanisms of intestinal absorbtion ............................................................. |
51 |
||
N.M. Leonevskaya, S.I. Erdes, M.A. Ratnikova |
|
||
Treatment algorithm for Hirschsprung disease at children................................................... |
57 |
||
News of coloproctology |
|
|
|
|
М |
|
|
E.E. Bolkvadze |
- |
|
63 |
Features of diagnostics and surgical treatment of acute anaerobic paraproctitis....................... |
|||
Exchange of experience |
|
|
|
V.Т. Ivashkin, M.A.Morozova, М.V. Mayevskaya, Ye.A.Fedos’ina |
|
||
Herbal medications in the treatment of hepatitis C............................................................ |
70 |
||
A.O. Buyeverov |
|
|
|
Treatment and prophylaxis of hematological side effects |
|
||
of chronic hepatitis C antiviral therapy............................................................................ |
76 |
||
Guideline |
|
|
|
Treatment of complications of liver cirrhosis (the second |
..........................................part) |
82 |
|

Российский журнал Гастроэнтерологии, Гепатологии, Колопроктологии
№ 3 • Том 19 • 2009
Russian Journal of
Gastroenterology,
Hepatology,
Coloproctology
Volume 19 • № 3 • 2009
Учредитель:
Российская
гастроэнтерологическая
ассоциация
Издатель:
ООО «Издательский дом «М-Вести»
E-mail: mvinfo@m-vesti.ru
Периодичность издания:
1 раз в 2 месяца
Тираж: 3000 экз.
Подписной индекс: 73538
Журнал зарегистрирован Комитетом РФ по печати 15.12.1994 г.
(Регистрационный № 013128)
Информация о журнале
находится в Интернете на сайте www.m-vesti.ru
Адрес:
119146, г. Москва, а/я 31, «ГАСТРО», Российский журнал гастроэнтерологии,
гепатологии, колопроктологии
Телефон: 8-901562-2287
Эл. почта: ros.jurn.gastro@mail.ru
Журнал входит в Перечень ведущих научных журналов и изданий ВАК Министерства образования и науки России, в которых должны быть опубликованы основные научные результаты диссертаций на соискание ученой степени доктора наук
Перепечатка материалов только с разрешения главного редактора и издателя
Ответственность за достоверность рекламных публикаций несут рекламодатели
Российский журнал гастроэнтерологии, гепатологии, колопроктологии
Состав редакционной коллегии и редакционного совета журнала
Главный редактор:
В.Т.Ивашкин
Исполнительный директор проекта:
Г.Г.Пискунов
Ответственный секретарь:
Т.Л.Лапина
(Эл. почта: ros.jurn.gastro@mail.ru)
Редакционная коллегия:
Е.К.Баранская А.О.Буеверов С.А.Булгаков П.С.Ветшев Г.И.Воробьев А.В.Калинин
(зам. главного редактора)
З.А.Лемешко А.Ф.Логинов И.В.Маев М.В.Маевская
(зам. главного редактора)
А.В.Охлобыстин |
|
|
Ю.М.Панцырев |
|
|
С.И.Рапопорт |
|
|
Ю.В.Тельных |
|
|
А.С.Трухманов |
|
|
О.Я.Бабак |
ВестиХарьков |
|
А.И.Хазанов |
|
|
С.А.Чернякевич |
|
|
А.А.Шептулин |
|
|
(зам. главного редактора) |
||
- |
|
|
Редакционный совет: |
|
|
М |
Хабаровск |
|
С.А.Алексеенко |
||
Э.И.Белобородова |
Томск |
|
Э.Г.Григорян |
|
Ереван |
А.К.Ерамишанцев |
Москва |
|
А.Р.Златкина |
|
Москва |
Г.Ф.Коротько |
|
Краснодар |
С.А.Курилович |
Новосибирск |
|
В.А.Максимов |
Москва |
|
С.Н.Маммаев |
|
Махачкала |
Ю.Х.Мараховский |
Минск |
|
Г.А.Минасян |
|
Ереван |
О.Н.Минушкин |
Москва |
|
И.А.Морозов |
|
Москва |
Ю.Г.Мухина |
|
Москва |
А.И.Пальцев |
|
Новосибирск |
Л.К.Пархоменко |
Харьков |
|
В.Д.Пасечников |
Ставрополь |
|
С.Д.Подымова |
Москва |
|
Г.В.Римарчук |
|
Москва |
В.И.Симоненков |
Санкт-Петербург |
|
А.В.Ткачев |
|
Ростов-на-Дону |
Е.Д.Федоров |
|
Москва |
И.Л.Халиф |
|
Москва |
Г.В.Цодиков |
|
Москва |
А.В.Шапошников |
Ростов-на-Дону |
|
Editor-in-chief:
V.T.Ivashkin
Production Manager:
G.G.Piskunov
Editorial Manager: T.L.Lapina
(E-mail: ros.jurn.gastro@mail.ru)
Editorial board:
Ye.K.Baranskaya
A.O.Bueverov
S.A.Bulgakov
P.S.Vetshev
G.I.Vorobiev
A.V.Kalinin
(deputy editor-in-chief) Z.A.Lemeshko A.F.Loginov I.V.Mayev M.V.Mayevskaya (deputy editor-in-chief) A.V.Okhlobystin Yu.M.Pantsyrev S.I.Rapoport Yu.V.Tel’nykh A.S.Trukhmanov A.I.Khazanov S.A.Chernyakevich A.A.Sheptulin
(deputy editor-in-chief)
Editorial council: |
|
S.А.Alexeyenko |
Khabarovsk |
O.Ya.Babak |
Kharkov |
E.I.Byeloborodova |
Tomsk |
E.G.Grigoryan |
Yerevan |
A.K.Yeramishantsev |
Moscow |
A.R.Zlatkina |
Moscow |
G.F.Korot’ko |
Krasnodar |
S.A.Kurilovich |
Novosibirsk |
V.A.Maximov |
Moscow |
S.N.Mammaev |
Machachkala |
Yu.Kh.Marakhovsky |
Minsk |
G.A.Minasyan |
Yerevan |
O.N.Minushkin |
Moscow |
I.A.Morozov |
Moscow |
Yu.G.Mukhina |
Moscow |
A.I.Pal'tsev |
Novosibirsk |
L.K.Parkhomenko |
Kharkov |
V.D.Pasyechnikov |
Stavropol |
S.D.Podymova |
Moscow |
G.V.Rimarchuk |
Moscow |
V.I.Simonenkov |
Saint-Petersburg |
A.V.Tkachev |
Rostov-on-Don |
Ye.D.Fedorov |
Moscow |
I.L.Khalif |
Moscow |
G.V.Tsodikov |
Moscow |
A.V.Shaposhnikov |
Rostov-on-Don |

Редакционная |
3, 2009 |
УДК 616.36-008.64-036.72-002.12
Иммунный гомеостаз и иммунные заболевания печени
В.Т. Ивашкин
(Кафедра пропедевтики внутренних болезней Московской медицинской академии им. И.М. Сеченова)
Immunological homeostasis and immune diseases of liver
V.T. Ivashkin
Цель обзора. Осветить механизмы регуляции |
The aim of review. To present mechanisms of reg- |
иммунного гомеостаза печени и патологических |
ulation of liver immunological homeostasis and patho- |
реакций, обусловливающих развитие аутоиммун- |
logical reactions causing autoimmune diseases. |
ных заболеваний. |
Original positions. Predisposition to autoimmune |
Основные положения. Предрасположенность |
hepatitis is determined by carriage of HLA-DR B1*0301 |
к заболеванию аутоиммунным гепатитом опреде- |
or HLA-DR B1*0401 alleles. Patients with autoimmune |
ляется носительством аллелей HLA-DR B1*0301 |
hepatitis receiving no treatment and relapse phase of |
или HLA-DR B1*0401. У пациентов с аутоиммунным |
disease have deficiency or the functional failure of CD4+ |
Вести |
|
гепатитом при отсутствии лечения и в периоде |
CD25+ regulatory Т-cells. Th1-cells induce expression |
обострения обнаруживается дефицит или функцио- |
of HLA class I molecules on hepatocytes that increases |
нальная недостаточность CD4+ CD25+ регулятор- |
sensibility of hepatocytes to attacks of cytotoxic CD8+ |
ных Т-клеток. Th1-клетки индуцируют экспрессию |
Т-cells. Th2-cells induce autoantibodies production by |
- |
B-lymphocytes. Th17-cells are involved in development |
молекул HLA класса I на гепатоцитах, что способ- |
|
ствует повышению восприимчивости гепатоцитов |
of inflammation and autoimmune reactivity. |
М |
Congenital or acquired defects of expression of |
к атакам со стороны цитотоксических CD8+ Т кле- |
|
ток. Th2-клетки индуцируют продукцию аутоантител |
MDR3/ABCB4, CFTR, AE2/SLC4A2, genes that encode |
В-лимфоцитами. Th17-клетки участвуют в развитии |
proteins of various transport systems of bile duct and |
воспаления и аутоиммунной реактивности. |
tubule epithelium can take part in pathogenesis of |
В патогенезе первичного билиарного цирроза и |
primary biliary cirrhosis and primary sclerosing chol- |
первичного склерозирующего холангита могут уча- |
angitis. These genetic changes are accompanied by |
ствовать врожденные или приобретенные дефекты |
disorders of hydration, alkalinisation and colloidisation |
экспрессии генов MDR3/ABCB4, CFTR, AE2/SLC4A2, |
of bile, biliary thrombosis of tubules, inflammatory |
кодирующих белки различных транспортных систем |
Т-cellular infiltration, development of cholangiogenic |
эпителия желчных протоков и канальцев. Эти ген- |
fibrosis and cirrhosis. |
ные изменения сопровождаются нарушением гид- |
Nuclear factor NF-kB represents the molecular bond |
ратации, алкалинизации и коллоидизации желчи, |
bridging inflammatory, immune, protective and meta- |
желчным тромбозом желчных канальцев, воспа- |
bolic reactions in the liver. It is one of the key factors of |
лительной Т-клеточной инфильтрацией, развитием |
pathogenic mechanisms, resulting in development of |
холангиогенного фиброза и цирроза. |
non-alcoholic steatohepatitis and hepatocellular car- |
Ядерный фактор NF-kB представляет молеку- |
cinoma. |
лярное звено, соединяющее воспалительные, |
Conclusion. Understanding of mechanisms of |
иммунные, защитные и метаболические реакции, |
autoimmune liver disease broadens diagnostic and |
протекающие в печени; служит одним из ключевых |
clinical horizons of modern doctor and yields new medi- |
факторов патогенетических механизмов, приводя- |
cal methodology. |
щих к развитию неалкогольного стеатогепатита и |
Key words: autoimmune hepatitis, primary biliary cir- |
гепатоцеллюлярной карциномы у человека. |
rhosis, cytotoxic T-lymphocytes, nuclear factor NF-kB. |
Заключение. Знание механизмов аутоиммун- |
|
ной патологии печени расширяет диагностические и |
|
клинические горизонты современного врача и дает |
|
ему новые лечебные методологии. |
|
Ключевые слова: аутоиммунный гепатит, пер- |
|
вичный билиарный цирроз, цитотоксические Т-лим- |
|
фоциты, ядерный фактор NF-kB. |
|

3, |
2009 |
|
|
|
|
|
|
Редакционная |
|
|
|
|
|
|
|
|
|
|
|
утоиммунный процесс в печени захваты- |
печени с распространенностью 1/10 000 в Европе |
||||||||
вает преимущественно паренхиму (при |
и США; на его долю приходится 2–6% всех |
||||||||
Ааутоиммунном гепатите) или портальные |
трансплантаций печени. АИГ диагностируется |
||||||||
тракты, содержащие желчные протоки, – первич- |
на основании повышенной активности аланин- |
||||||||
ный билиарный цирроз (ПБЦ), аутоиммунный |
аминотрансферазы (АлАТ), обнаружения в био- |
||||||||
холангит (АХ) и первичный склерозирующий |
птате клеточного инфильтрата (лимфоциты и |
||||||||
холангит (ПСХ). |
|
мононуклеары), наличия гипергаммаглобулин- |
|||||||
Вопрос о связи вирусной инфекции и аутоим- |
емии и аутоантител при отсутствии других забо- |
||||||||
мунной реактивности постоянно обсуждается в |
леваний вирусной, токсической или метаболиче- |
||||||||
научной среде. Распространена точка зрения, что |
ской природы. Внутрипеченочный Т-клеточный |
||||||||
вирусы обладают способностью запускать и уси- |
инфильтрат представляет собой гистологический |
||||||||
ливать аутоиммунные процессы, поскольку могут |
фундамент аутоиммунного гепатита и коррели- |
||||||||
инициировать |
воспаление. |
Экспериментальные |
рует с прогрессированием болезни [3]. Наиболее |
||||||
данные позволяют обсуждать два возможных сце- |
вероятно, что аутоантиген-специфические Т-клет- |
||||||||
нария. В первом случае вирусная инфекция спе- |
ки непосредственно участвуют в патогенезе забо- |
||||||||
циализированных клеток демаскирует эти клетки |
левания. Каким бы ни был этот начальный сти- |
||||||||
для иммунного распознавания, что облегчает их |
мул образования лимфоцитарного инфильтрата, |
||||||||
разрушение аутореактивными клетками (напри- |
в последующем большое число активированных |
||||||||
мер, при сахарном диабете I типа стимулируется |
клеток воспаления инициирует и поддерживает |
||||||||
экспозиция молекул МНС класса I на поверх- |
повреждение печени. |
||||||||
ности β-клеток). При втором варианте на фоне |
|
Аутоиммунная атака на гепатоциты может осу- |
|||||||
текущего воспаления перекрестная реактивность |
ществляться различными способами. Полагают, |
||||||||
между вирусными антигенами и аутоантигенами |
что способностью запускать и управлять повре- |
||||||||
(обозначаемая как «молекулярная мимикрия») |
ждением печени обладают CD4+ Т-лимфоциты, |
||||||||
усиливает аутоиммунные процессы в органе- |
распознающие аутоиммунные пептиды на поверх- |
||||||||
мишени. |
|
|
|
ности гепатоц тов. Для того чтобы инициировать |
|||||
Вместе с тем ряд авторов считает, что вирус- |
иммунный ответ, пептид должен находиться в |
||||||||
ные инфекции в большинстве случаев оказывают |
комплексе |
молекулой HLA класса II на поверх- |
|||||||
обратный эффект в отношении аутоиммунитета, |
но |
и кле ки |
|
презентироваться некоммитиро- |
|||||
т. е. предупреждают развитие аутоиммунных реак- |
ванным (наивным) CD4+ Т-хелперным (Th0) |
||||||||
ций [12]. Согласно этому предположению (обозна- |
кл ткам профессиональными антиген-презенти- |
||||||||
чаемому как «гигиеническая гипотеза»), вирусные |
рующими клетками (АРС) с ко-стимулирующи- |
||||||||
инфекции предупреждают |
Вести |
|
|||||||
(или предотвращают) |
ми лиганд-лигандными CD28+ на ThO и CD80+ |
||||||||
|
|
|
- |
на АРС, усиливающими взаимодействие между |
|||||
развитие диабета I типа путем повышения активно- |
|||||||||
сти регуляторных Т-клеток (Treg)Мили посредст- |
этими двумя типами клеток [2]. ThO-клетки акти- |
||||||||
вом стимуляции продукции PD1L и TNF-α, которые |
вируются и дифференцируются в функциональ- |
||||||||
усиливают апоптоз аутоагрессивных Т-клеток. Оба |
ные фенотипы (Th1 и Th2) в зависимости от при- |
||||||||
эти процесса зависят от каскада реакций, иниции- |
роды антигена и цитокинов, превалирующих в их |
||||||||
руемых толл-подобным рецептором 2 (TLR2). |
микроокружении. Дальнейший каскад иммунных |
||||||||
По мнению исследователей, системные инфекции |
реакций определяется цитокинами, продуцируе- |
||||||||
выступают в роли регуляторов иммунной системы |
мыми Th1 и/или Th2-клетками (рис. 1). |
||||||||
в целом и скорее предупреждают нежели вызыва- |
|
Th1-клетки, обретающие свой фенотип под |
|||||||
ют аутоиммунные реакции, при условии, что эти |
влиянием продуцируемого макрофагами интер- |
||||||||
инфекции не оказывают непосредственное влияние |
лейкина 12 (IL-12), секретируют преимуществен- |
||||||||
на органы-мишени, делая их более чувствитель- |
но IL-2 и интерферон-гамма (IFN-γ). Указанные |
||||||||
ными для последующего иммунопатологического |
цитокины активируют макрофаги, увеличивают |
||||||||
разрушения. |
|
|
|
экспрессию молекул HLA класса I (это повыша- |
|||||
При рассмотрении более конкретных проблем |
ет чувствительность гепатоцитов по отношению |
||||||||
гепатологии, в частности аутоиммунного гепа- |
к |
атакам |
со |
стороны CD8+ цитотоксических |
|||||
тита, большинство исследователей сходится во |
Т-клеток) и индуцируют экспрессию молекул |
||||||||
мнении, что в образовании массивного воспали- |
HLA класса II на гепатоцитах. Th2-клетки, диф- |
||||||||
тельного инфильтрата в печени, обнаруживаемого |
ференцирующиеся из Th0 в микроокружении, |
||||||||
на момент установления диагноза, участвует мощ- |
содержащем IL-4, продуцируют преимущественно |
||||||||
ный стимул неизвестной природы. |
IL-4, IL-10 и IL-13, которые способствуют про- |
||||||||
|
|
|
|
дукции аутоантител В-лимфоцитами. |
|||||
Аутоиммунный гепатит |
|
В обычных физиологических условиях Th1 и |
|||||||
Th2 выступают антагонистами по отношению друг |
|||||||||
|
|
|
|
||||||
Аутоиммунный гепатит (АИГ) представляет |
к другу. Th17-клетки, недавно охарактеризован- |
||||||||
собой хроническое воспалительное заболевание |
ная популяция лимфоцитов [7, 19], обретают свой |
||||||||
Редакционная |
|
|
|
|
|
|
|
|
|
3, 2009 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
тивных клеток при АИГ 2-го типа. Знание того, |
||||||
|
|
|
|
|
|||||||
|
|
|
|
|
что цитохром P4502D6 (CYP2D6) – главный |
||||||
|
Th1 |
|
IFN γ |
аутоантиген при этом заболевании, позволило |
|||||||
IL 12 |
|
|
|
|
охарактеризовать как CD4, так и CD8 Т-клетки, |
||||||
|
|
|
|
|
для которых мишенью атаки служит CYP2D6. |
||||||
|
|
|
|
|
Показано, что у пациентов с АИГ 2-го типа CD4 |
||||||
IL 4 |
Th2 |
|
IL 4 |
Т-клетки, позитивные |
по |
предрасполагающему |
|||||
Th0 |
|
|
|
|
к |
заболеванию аллелю |
DRB1*0701, распознают |
||||
|
|
|
|
семь областей CYP2D6, пять из которых, как |
|||||||
TGF β |
|
|
|||||||||
IL 23 |
|
|
обнаружилось позже, распознают и CD8 Т-клет- |
||||||||
|
Th17 |
|
|
IL 17 |
ки [9]. При аутоиммунном гепатите в биоптатах |
||||||
TGF α |
|
|
обнаруживается большое количество CD4 и CD8 |
||||||||
|
|
|
|
||||||||
|
|
|
|
|
Т-клеток, продуцирующих IFN-γ. Этот фено- |
||||||
|
|
|
|
|
мен сопряжен с биохимическими показателями |
||||||
|
Treg |
|
TGF α |
повреждения печени – повышение активности |
|||||||
|
|
аспартатаминотрансферазы (АсАТ), |
АлАТ и |
||||||||
IL 6 |
|
|
|
|
|||||||
|
|
|
|
др., что указывает на комбинированную клеточ- |
|||||||
|
|
|
|
|
|||||||
|
|
|
|
|
но-опосредованную иммунную атаку. Недавно |
||||||
|
|
|
|
|
|||||||
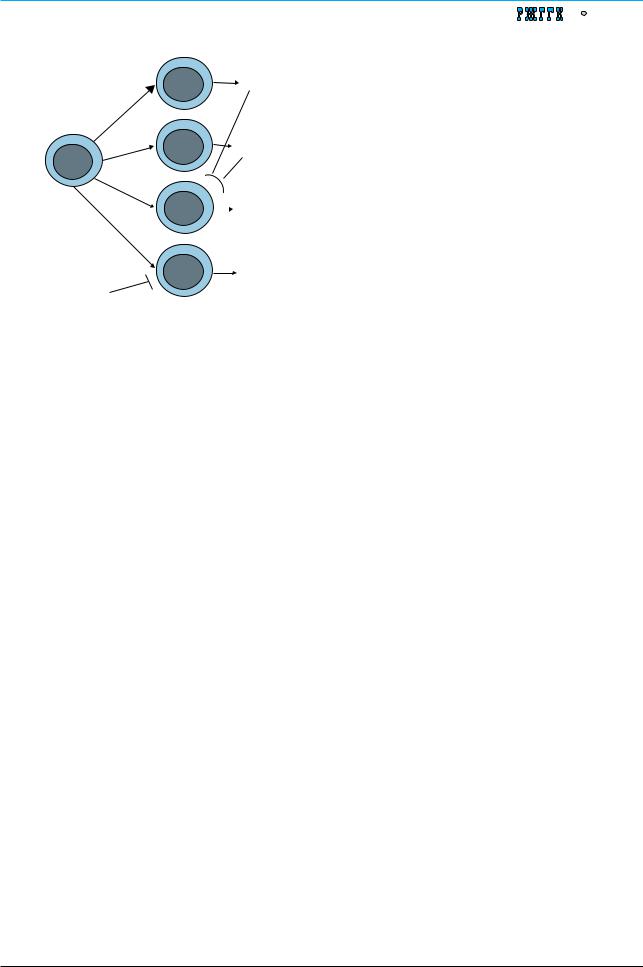
Рис. 1. Субпопуляции CD4+ Т-клеток |
обнаружено наличие эпитопов Т-клеток на солю- |
||||||||||
CD4 – антиген гликопротеиновой природы, кото- |
билизированном печеночном антигене, который |
||||||||||
рый экспрессируется примерно на 2/3 |
перифериче- |
служит мишенью для аутоиммунных реакций у |
|||||||||
ских Т-лимфоцитов. На этапе созревания клеток в |
части пациентов с АИГ. |
|
|
|
|||||||
тимусе CD4 экспрессируется всеми клетками, а в ходе |
|
|
|
||||||||
|
Клональное ограничение популяции внутрипе- |
||||||||||
их дифференцировки сохраняется только на субпопу- |
|
||||||||||
ляции, переставшей экспрессировать CD8-антиген. |
ченочных Т-клеток и факты, свидетельствующие, |
||||||||||
Дифференцировка субпопуляций CD4+ Т-клеток |
что аллели HLA DRB1*0301 и HLA DRB1*0401 |
||||||||||
– важный этап на пути формирования эффектор- |
предрасполагают к развитию АИГ и определяют |
||||||||||
ных функций. Тот или иной путь дифференцировки |
|||||||||||
тяжес ь заболевания, способствовали возникно- |
|||||||||||
зависит от следующих факторов: |
|
|
|||||||||
|
|
вению г потезы, в соответствии с которой внут- |
|||||||||
– место презентации антигена; |
|
|
|||||||||
– ко-стимулирующие молекулы, участвующие в кле- |
рипеченочные CD4 Т-клетки распознают аутоан- |
||||||||||
точном взаимодействии; |
|
|
|
|
тигены в неразрывной связи с HLA DRB1*0301 |
||||||
– АРС и продуцируемые ими цитокины; |
|
|
|
|
|
|
|||||
|
|
|
- |
|
HLA DRB1*0401. Однако, несмотря на значи- |
||||||
– цитокиновый профиль и баланс цитокинов при |
тельные усилия, все еще остается неясным, какие |
||||||||||
ответе на антиген; |
|
|
|
|
|||||||
– активность ко-стимулирующих молекул иВестигормо- иммунногенные белки распознаются при ауто- |
|||||||||||
нов, присутствующих в локальном микроокружении; |
иммунном гепатите CD4 Т-клетками, клонально |
||||||||||
– генетические особенности организма |
обособленными посредством HLA DRB1*0301 и |
||||||||||
|
М |
||||||||||
|
|
|
|
|
HLA DRB1*0401. В настоящее время этот вопрос |
||||||
фенотип из Th0 при наличии в микроокружении |
изучается. Исследователи пытаются идентифи- |
||||||||||
трансформирующего |
фактора |
бета (TGF-β) |
цировать и охарактеризировать аутоантигенные |
||||||||
и IL-6. Th17-клетки играют важную роль в раз- |
белки в структуре человеческого АИГ – специа- |
||||||||||
витии воспаления и аутоиммунной реактивно- |
лизированного солюбилизированного печеночного |
||||||||||
сти. Процесс распознавания аутоантигенов строго |
антигена/печеночно-панкреатического антигена, |
||||||||||
контролируется регуляторными механизмами, в |
которые служат мишенями для CD4 Т-клеток и |
||||||||||
частности CD4+ CD25+ регуляторными Т-клетка- |
соседствуют с ограниченным геном предрасполо- |
||||||||||
ми, которые, в свою очередь, дифференцируются |
женности к АИГ HLA DRB1*0301. Проводятся |
||||||||||
из Th0 при наличии в микроокружении TGF-β, |
также исследования по созданию реагентов, кото- |
||||||||||
но обязательно в отсутствие IL-6. При развитии |
рые позволили бы анализировать аутоантиген- |
||||||||||
недостаточности регуляторных механизмов ауто- |
специфические Т-клетки в крови у пациентов с |
||||||||||
иммунная атака приобретает длительное течение. |
АИГ [17]. |
|
|
|
|||||||
В последние три |
десятилетия были изуче- |
|
|
|
|
|
|
||||
ны различные аспекты изложенных патогенети- |
|
Холестатические заболевания |
|
||||||||
ческих механизмов аутоиммунных процессов. |
|
|
|||||||||
|
печени |
|
|
|
|||||||
Дефект иммунорегуляции вследствие недостаточ- |
|
|
|
|
|||||||
|
|
|
|
|
|
||||||
ности CD4+ CD25+ регуляторных Т-клеток про- |
|
Успехи в изучении этиопатогенеза первич- |
|||||||||
демонстрирован при аутоиммунном гепатите [16]. |
ного билиарного цирроза в значительной мере |
||||||||||
У нелеченных пациентов с АИГ (и при рецидиве |
обусловлены получением строгих характеристик |
||||||||||
заболевания) отмечаются функциональная недос- |
антимитохондриальных реакций, которые служат |
||||||||||
таточность этих клеток или уменьшение их коли- |
серологическим эквивалентом ПБЦ. Во-первых, |
||||||||||
чества. По сравнению с другими заболеваниями |
достоверно установлено, что циркулирующие IgG |
||||||||||
наиболее изучены механизмы участия аутореак- |
и |
антимитохондриальные |
антитела |
(АМА) |
|||||||

3, |
2009 |
|
|
|
|
|
|
Редакционная |
|
|
|
|
|
|
|
|
|
|
|
распознают белки внутренней митохондриаль- |
крови, особенно в клетках приобретенного (адап- |
||||||||
ной мембраны, которые представлены энзимами |
тивного) иммунитета, т. е. в Т- и В-лимфоцитах. |
||||||||
пируват дегидрогеназного |
комплекса (PDC) |
Частота моносомии коррелирует с возрастом. |
|||||||
и 2-оксоглютарат |
дегидрогеназного |
комплекса. |
Дальнейшее углубление наших представлений |
||||||
Главным антигеном при ПБЦ (найден у 90% паци- |
о патогенезе хронических холангиопатий (таких |
||||||||
ентов) выступает дигидролипоамид ацетилтранс- |
как ПСХ и ПБЦ), а также развитие новых |
||||||||
фераза, представляющая Е2 компонент PDC. |
диагностических, прогностических и терапевти- |
||||||||
Во-вторых, аутореактивные CD4+ и CD8+ Т-клет |
ческих методологий зависит от наличия легко |
||||||||
ки обнаруживаются в периферической крови паци- |
воспроизводимых экспериментальных моделей |
||||||||
ентов с ПБЦ независимо от наличия или отсутствия |
[10, 18]. Исследователи до настоящего време- |
||||||||
АМА, а инфильтрация аутореактивными Т-клет- |
ни не располагают экспериментальной моделью, |
||||||||
ками паренхимы печени и перидуктулярных про- |
которая в полном объеме воспроизводила бы |
||||||||
странств служит одной из главных характеристик |
ПСХ. Индукция у животных синдрома ПСХ |
||||||||
аутоиммунного статуса. Аутореактивные Т-клетки |
компонентами бактериальных клеток или предше- |
||||||||
обоих субтипов |
распознают |
последовательности |
ствующей инициацией колита помогает объяснить |
||||||
PDC – Е2, в том числе эпитопы для антимито- |
сильную связь между ПСХ и воспалительными |
||||||||
хондриальных антител. Установлено увеличение |
заболеваниями кишечника. Другие модели бази- |
||||||||
числа предшественников цитотоксических Т-кле- |
руются на прямом повреждающем воздействии |
||||||||
ток на ранних стадиях болезни по сравнению с их |
на билиарный эпителий, перибилиарный сосу- |
||||||||
числом в развернутых стадиях, а также десяти- |
дистый эндотелий или на эндотелий порталь- |
||||||||
кратное повышение специфических CD8+ Т-кле- |
ной венозной сети. Гистологические изменения, |
||||||||
ток в печени по сравнению с их содержанием в |
обнаруживаемые при этом у экспериментальных |
||||||||
периферической крови. В-третьих, обнаружено |
животных, указывают на определенное значение |
||||||||
уменьшение числа CD4+ CD25+ регуляторных |
CD4 и CD8 Т-клеток с фенотипом Th1, которые |
||||||||
Т-клеток при ПБЦ. В-четвертых, клетки желч- |
инфильтрируют портальные тракты под влиянием |
||||||||
ных канальцев в ходе течения ПБЦ демонстри- |
цитокинов, секретируемых макрофагами печени. |
||||||||
руют специфические особенности при апоптозе. |
ряде случаев процесс характеризуется появ- |
||||||||
|
|
|
|
|
|
Вести |
|||
В частности, клетки, находящиеся в апоптозе, |
лением |
ан |
нейтрофильных цитоплазматиче- |
||||||
фагоцитируются |
билиарными |
эпителиальными |
ких ан |
и |
ел (ANCA). |
||||
клетками и становятся источником аутоантигенов, |
При направленном выключении у мышей гена |
||||||||
|
|
|
|
|
|
- |
Mdr2, кодирующего каналикулярную фосфоли- |
||
представляемых холангиоцитами, наиболее веро- |
|||||||||
ятно посредством анти-CD16. Таким образом, |
пидную флиппазу (транспортер фосфолипидов), |
||||||||
становятся более понятными значение и связь |
склерозирующий холангит развивается спонтан- |
||||||||
апоптоза и аутофагии, осуществляемых холан- |
но; при этом обнаруживаются макроскопиче- |
||||||||
гиоцитами при ПБЦ. В-пятыхМ, более детально |
ские и микроскопические изменения, которые |
||||||||
охарактеризован иннатный (врожденный) имму- |
идентичны таковым у человека при ПСХ [4]. |
||||||||
нитет при ПБЦ; например, показано, что моноци- |
Повреждение билиарных трактов в этой модели |
||||||||
ты пациентов с ПБЦ продуцируют повышенные |
сцеплено с нарушением секреции фосфолипидов |
||||||||
количества провоспалительных цитокинов в ответ |
через апикальную мембрану канальцев. Далее |
||||||||
на стимуляцию различными патогенами. Стало |
регистрируется определенная последовательность |
||||||||
очевидным, что высокое содержание IgM, обычно |
изменений: повышение концентрации свободных, |
||||||||
обнаруживаемое при ПБЦ, служит отражением |
не включенных в мицеллы, желчных кислот в |
||||||||
аберрантного ответа иннатной иммунной системы |
желчи и повреждение этими кислотами эпителия |
||||||||
вследствие стимуляции TLR9 макрофагов бакте- |
желчных протоков, затем развитие перихоланги- |
||||||||
риальным компонентом CpG-B [11]. |
|
та, перидуктулярного фиброза и пролиферации |
|||||||
Предрасположенность женщин к ПБЦ служит |
желчных протоков и, наконец, склерозирующего |
||||||||
важным ключом к расшифровке этиологии забо- |
холангита. Целесообразно отметить, что спектр |
||||||||
левания. X-сцепленные гены определяют половые |
генной экспрессии, регистрируемый на мышиной |
||||||||
характеристики на различных уровнях и одно- |
модели Mdr2–/–, существенно близок генному |
||||||||
временно регулируют иммунную функцию, в осо- |
спектру, экспрессируемому пациентами с ПСХ. |
||||||||
бенности поддержание толерантности. Большие |
По аналогии с указанной Mdr2–/– моделью |
||||||||
дефекты X-хромосомы, обусловливающие, напри- |
склерозирующего холангита, дефекты в экспрес- |
||||||||
мер, развитие синдрома Тернера или раннюю |
сии генов MDR3/ABCB4 (человеческий аналог |
||||||||
недостаточность яичников, обычно сочетаются с |
мышиной модели Mdr2/Abcb4) могут иметь |
||||||||
аутоиммунными синдромами (наиболее часто с |
существенное значение в патогенезе различных |
||||||||
патологией щитовидной железы), реже с холе- |
холангиопатий у человека [4]. В частности, вро- |
||||||||
стазом. Установлено, что у женщин с ПБЦ обна- |
жденные дефекты экспрессии MDR3 (протеи- |
||||||||
руживается более |
высокая |
частота |
моносомии |
на, обеспечивающего транспорт фосфолипидов |
|||||
X-хромосомы |
в |
лейкоцитах |
периферической |
из гепатоцитов) сопровождаются повреждением |
|||||

Редакционная |
3, 2009 |
желчных протоков и развитием различных кли- |
му билиарному циррозу печени. Скармливание |
||||||||
нических синдромов начиная с прогрессирующе- |
животным 3,5-диэтоксикарбонил-1,4-дигидрохол- |
||||||||
го семейного холестаза 3-го субтипа (PFIC-3) у |
лидина |
сопровождается |
повышением |
желчной |
|||||
детей и билиарного фиброза/цирроза у взрос- |
секреции порфирина и индукцией экспрессии |
||||||||
лых. Более того, феномен снижения каналь- |
холангиоцитами молекул |
VCAM, остеопонтина |
|||||||
цевого транспорта |
фосфолипидов |
относительно |
и TNF-α. Этот феномен сопряжен с развити- |
||||||
канальцевой экспрессии желчных кислот обна- |
ем массивного перихолангита и значительным |
||||||||
руживается в клинических условиях в печеноч- |
увеличением числа CD11b-позитивных клеток, |
||||||||
ных трансплантатах при развитии признаков |
дуктальной клеточной инфильтрацией и актива- |
||||||||
повреждения желчных протоков; в этих ситуаци- |
цией перидуктальных миофибробластов, разви- |
||||||||
ях генные мутации/полиморфизм MDR3 могут |
тием билиарного фиброза. Литохолевая кислота, |
||||||||
непосредственно определять патогенез различных |
будучи высокогидрофобной и токсичной сама по |
||||||||
холангиопатий, таких как ПСХ, ПБЦ и идиопа- |
себе, вызывает повреждение билиарных трактов. |
||||||||
тическая дуктопения/фиброз взрослых. Можно |
Включение в рацион мышей литохолевой кисло- |
||||||||
заключить, что независимо от любой предпо- |
ты сопровождается сегментарной обструкцией |
||||||||
лагаемой причины |
склерозирующего |
холангита |
желчных протоков, деструктивным холангитом и |
||||||
мышиная Mdr2–/– модель может служить ключе- |
перидуктулярным фиброзом. На ультраструктур- |
||||||||
вой экспериментальной моделью, поскольку дает |
ном уровне нередко обнаруживают обструкцию |
||||||||
возможность надежного воспроизведения общих |
малых желчных протоков кристаллами желчи, |
||||||||
конечных путей повреждения желчных протоков |
что указывает на ведущую роль механического |
||||||||
и развития перибилиарного фиброза, а также |
повреждения/обструкции малых протоков в раз- |
||||||||
позволяет оценивать новые терапевтические под- |
витии выраженных холестатических синдромов. |
||||||||
ходы, в частности применение 24-норурсодезок- |
В настоящее время исследователи изучают |
||||||||
сихолевой кислоты [5]. |
|
|
несколько спонтанных геномных вариантов, не |
||||||
Другим примером транспортного дефекта, |
требующих предварительного нарушения имму- |
||||||||
сопряженного |
со склерозирующим |
холанги- |
нотолерантности к Е2-протеину (пируват дегид- |
||||||
|
|
|
|
Вести |
|
|
|||
том, служит кистозный фиброз (муковисцидоз). |
рогеназы) мышиных моделей ПБЦ: не туч- |
||||||||
Такая ассоциация обусловлена мутациями гена |
ной диабе |
ческой мыши (NODc3c4; non obese |
|||||||
– регулятора |
трансмембранной |
проводимости |
diabetic), IL-2Rα–/–-мыши, доминантно негатив- |
||||||
кистозного фиброза (CFTR/ABCC7), что сопро- |
ной по рецептору II TGF-β-мыши (dnTGFβRII) и |
||||||||
|
|
|
- |
Ae2a,b-мыши. Общей чертой всех «спонтанных» |
|||||
вождается выключением транспорта Cl–, нару- |
|||||||||
шением гидратации и алкалинизации желчи, |
мышиных моделей ПБЦ служит относительное |
||||||||
желчным тромбозом желчных канальцев, их |
уменьшение числа циркулирующих Treg, что |
||||||||
повреждением |
и |
развитием склерозирующего |
позволяет предполагать ключевую роль наруше- |
||||||
холангита у 7–18% взрослыхМпациентов, стра- |
ния функции регуляторных Т-клеток в патогене- |
||||||||
дающих кистозным фиброзом. Мышиная модель |
зе аутоиммунных заболеваний, таких как ПБЦ, |
||||||||
Cftr–/– позволяет воспроизводить прогрессирую- |
вследствие потери аутотолерантности. Помимо |
||||||||
щее заболевание печени с признаками гепатостеа- |
этого NODc3c4-мыши воспроизводят аутоиммун- |
||||||||
тоза, очагового холангита, нарушенной желчной |
ный холестаз с высокими уровнями антимитохон- |
||||||||
секреции, пролиферации желчных канальцев и |
дриальных и антинуклеарных антител (АNА). |
||||||||
трансформации до очагового билиарного цир- |
При гистологическом исследовании обнаружива- |
||||||||
роза в течение одного года. Индукция колита у |
ются лимфоцитарная инфильтрация портальных |
||||||||
Cftr–/–-мышей углубляет повреждение желчных |
трактов, хронический негнойный холангит и |
||||||||
протоков. Воспалительная реакция в кишечнике |
ПБЦ-подобные гранулемы. |
|
|||||||
может повреждать экспрессию гена Cftr посред- |
АХ на модели dnTGFβRII-мыши манифести- |
||||||||
ством нарушения экспрессии гена PPARα, кото- |
рует появлением антимитохондриальных антител |
||||||||
рый также вовлечен в регуляцию транскрипции |
в 100% |
случаев. Рецептор II TGF-β |
участвует |
||||||
Mdr2. Эти данные позволяют предполагать, что |
в регуляции функциональной активности лим- |
||||||||
пациенты с хроническими воспалительными забо- |
фоцитов. На модели аутоиммунного холангита |
||||||||
леваниями кишечника (болезнь Крона, неспеци- |
IL-2Rα–/–-мыши во всех случаях удается вос- |
||||||||
фический язвенный колит), если они относятся к |
производить появление ANA и АМА, лимфо- |
||||||||
гетерозиготным носителям мутаций CFTR, несут |
цитарную |
инфильтрацию |
портальных |
трактов |
|||||
повышенный риск развития ПСХ. |
|
|
и снижение числа желчных канальцев. Модель |
||||||
Ксенобиотики и лекарства также могут повре- |
AЕ2a,b-мыши позволяет воспроизводить имму- |
||||||||
ждать билиарные протоки и вызывать билиарный |
нологические, биохимические и гепатобилиарные |
||||||||
фиброз. Токсические лекарственные метаболи- |
морфологические изменения, весьма близкие тем, |
||||||||
ты, экскретируемые в желчь, приводят к раз- |
которые наблюдаются у пациентов с ПБЦ [14]. |
||||||||
витию лекарственно-индуцированного синдрома |
Установлено, что вследствие гиперплазии CD8+ и |
||||||||
исчезновения желчных протоков и последующе- |
снижения числа природных регуляторных Т-кле- |
||||||||

|
3, 2009 |
|
|
Редакционная |
|
|
|
|
|
|
|
ток (Treg) у большинства животных спонтанно |
МНС и MIC. Следовательно, существенными |
||||
повышаются уровни IgG, IgM и АМА. Полагают, |
звеньями патогенеза могут выступать измененные |
||||
что дефицит молекул АЕ2 на клеточной мембране |
иммунные реакции против микробных продуктов, |
||||
иммуноцитов и холангиоцитов сопровождается |
нарушенная иммунная защита против проникаю- |
||||
нарушением |
регуляции |
|
внутриклеточного рН |
щих в печень бактерий. |
|
соответственно в иммуноцитах и холангиоцитах |
При ПСХ печень и кишка могут экспрес- |
||||
и ведет к характерным иммунологическим и гепа- |
сировать одинаковые хемокины и адгезивные |
||||
тобилиарным изменениям, которые наблюдаются |
молекулы, что позволяет кишечным Т-клеткам |
||||
также и у пациентов с ПБЦ. Следует отметить, |
мигрировать в печень и поступать в портальные |
||||
что аллельные варианты АЕ2 (SLC4A2) – гена, |
тракты. Реактивация кишечных Т-клеток памяти |
||||
кодирующего белок-переносчик анионов HCO3–/ |
может объяснять тот факт, что ПСХ может раз- |
||||
Cl– (anion exchange, AE) на апикальной мембране |
виваться у пациентов через годы после удаления |
||||
гепатоцитов и холангиоцитов, могут у некоторой |
сегментов воспаленной кишки. На эксперимен- |
||||
подгруппы пациентов с ПБЦ определять пред- |
тальных моделях животных показано, что в пато- |
||||
расположенность к заболеванию, его прогресси- |
генез ПСХ могут быть вовлечены транспортеры |
||||
рование и ответ на проводимую терапию. В ряде |
апикальной мембраны эпителиоцитов печени, в |
||||
работ найдено снижение экспрессии и функции |
частности MDR3/ABCB4. Между тем до настоя- |
||||
АЕ2 (HCO3–/Cl– белок-переносчик) при ПБЦ, |
щего времени отсутствуют сведения о цитокинах, |
||||
что может лежать в основе уменьшения скорости |
участвующих в развитии перибилиарного фиб- |
||||
оттока желчи и развития холестаза. Более того, |
роза, так же как и о потенциальных дефектах |
||||
снижение экспрессии АЕ2 в эпителии слюнных |
в иммунной регуляции, в том числе со стороны |
||||
и слезных желез может объяснить встречаю- |
регуляторных Т-клеток. Нуждается в дальнейшей |
||||
щуюся ассоциацию с «сухим» синдромом у этих |
разработке и патогенез вариантных форм ПСХ, |
||||
пациентов и указывает на возможность генерали- |
ПСХ малых протоков, IgG4 ассоциированного |
||||
зованной «гландулярной недостаточности» при |
склерозирующего холангита, детского аутоим- |
||||
ПБЦ. Урсодезоксихолевая кислота (УДХК) |
мунного склерозирующего холангита и синдрома |
||||
восстанавливает нарушенную функцию АЕ2 у |
перекрес а ПСХ и аутоиммунного гепатита. |
||||
пациентов с ПБЦ, и недавно полученные данные |
|
||||
подтверждают, что комбинированное применение |
Сигнальные пути и патология |
||||
УДХК и глюкокортикоидов синергично активи- |
|||||
печени |
|||||
рует промотер АЕ2. |
- |
||||
|
|||||
|
|
|
|||
В отличие от определенных успехов, достиг- |
Современное состояние гепатологии требует |
||||
нутых в понимании патогенеза ПБЦ, патогенезВестиот клинициста понимания ряда ключевых путей |
|||||
первичного склерозирующего холангита остается |
регуляции прохождения внутриклеточных сиг- |
||||
во многом загадкой. ПСХ частоМотносят к ауто- |
налов. В их число входит и NF-kB (Nuclear |
||||
иммунным процессам. Однако для него не харак- |
Factor), участвующий в регуляции транскрипции |
||||
терны типичные критерии аутоиммунного забо- |
большого числа генов, вовлеченных в контроль |
||||
левания, такие как женский пол и отчетливый |
над иммунными и воспалительными реакциями, |
||||
положительный ответ на иммуносупрессивную |
в гибели и пролиферации клеток. Именно вслед- |
||||
терапию. Вместе с тем целый ряд фактов свиде- |
ствие фундаментальной роли NF-kB в клеточных |
||||
тельствует о том, что в патогенезе ПСХ заметную |
реакциях на инфекцию, повреждение и дру- |
||||
роль играют иммуноопосредованные реакции: |
гие патогенные воздействия активация данного |
||||
лимфоцитарные инфильтраты портальных трак- |
фактора представляется ключевой составляющей |
||||
тов, аутоантитела к эпителиальным билиарным |
в патогенезе значительного числа заболеваний, |
||||
клеткам, повышение уровня гамма-глобулинов, |
включая воспалительные, дегенеративные и рак. |
||||
наличие атипичных p-ANCA у 80% пациентов |
Активированный NF-kB инициирует воспаление |
||||
и частые ассоциации с другими аутоиммунными |
и тканевые повреждения посредством индук- |
||||
болезнями [6]. Наиболее впечатляющей клини- |
ции экспрессии провоспалительных медиаторов |
||||
ческой особенностью патогенеза ПСХ служит |
и эффекторных молекул, однако этот же фактор |
||||
ассоциация |
с воспалительными заболеваниями |
защищает клетки от цитокин-индуцированной |
|||
кишечника, главным образом с язвенным коли- |
смерти посредством регуляции генов, обеспечи- |
||||
том (более чем у 70% пациентов). Полагают, |
вающих антиапоптотическую и антиоксидантную |
||||
что бактерии или бактериальные продукты через |
функции. Суммарный эффект активации NF-kB |
||||
нарушенный |
кишечный |
эпителиальный барьер |
в патогенезе заболевания, вероятно, определяется |
||
могут поступать в портальный кровоток и печень, |
соотношением обоих видов активности и может |
||||
тем самым |
инициируя |
портальное воспаление |
иметь разное значение в разных типах клеток и |
||
у предрасположенных лиц. Генетическая осно- |
тканей (рис. 2). |
||||
ва ПСХ представляется достаточно сложной. |
Активацию NF-kB осуществляет IkB-киназа |
||||
Найдено несколько ассоциаций с генами регионов |
(IKK), которая состоит из двух каталитических |
||||
|
|
|
|
|
|
Редакционная |
|
|
|
|
|
|
3, 2009 |
||
|
|
NEMO |
NEMO |
|
|
|
NIK |
|
|
|
|
|
|
IKKкомплекс |
|
|
|
|
|
|
|
|
Фосфорилирование |
|
|
|
IKKкомплекс |
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
Фосфорилирование |
|
|
|
RolA |
p50 |
|
|
|
p100 |
Процессинг р100 |
|
|
|
|
|
|
RolB |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Транслокация |
|
|
|
Транслокация |
|||
|
|
|
|
Ядро |
|
|
|
|
Ядро |
|
|
RolA |
p50 |
Транскрипция |
|
RolB |
p52 |
Транскрипция |
|
|
|
|
|
|
DNA |
|
|
DNA |
|
|
|
Канонический путь |
|
|
Альтернативный путь |
||||
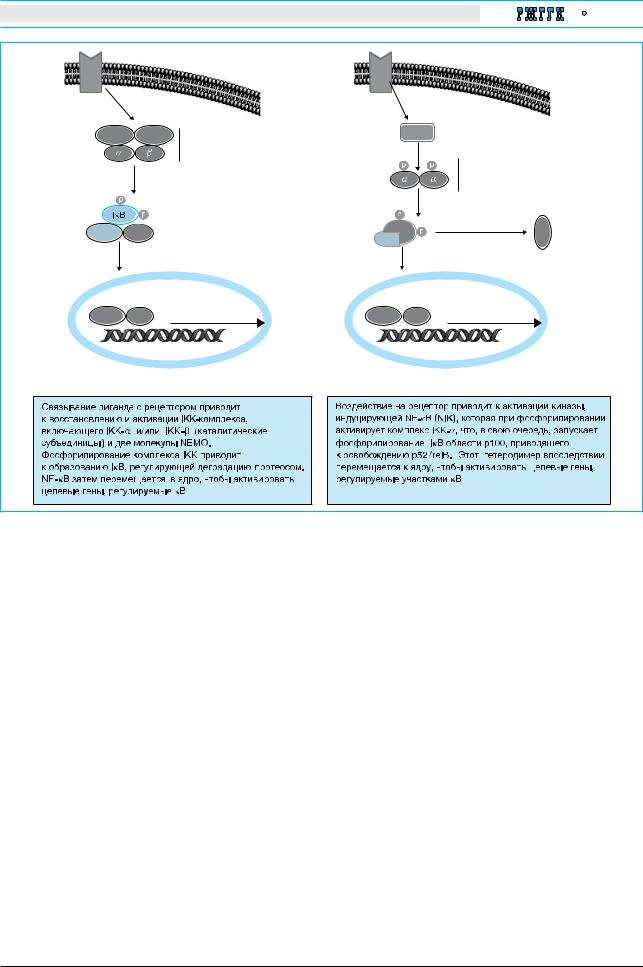
Рис. 2. Активация NF-kB |
|
- |
|
|
|
||||
|
|
|
|
|
|
|
|
||
субъединиц – IKK1 (IKK-α) и IKK2 (IKKВести-β) птозу. Однако выключение NEMO или комби- |
|||||||||
регуляторной субъединицы IKKМ-γ, или NEMO |
нированное выключение как IKK1, так и IKK2 |
||||||||
(NF-kB Essential Modulator). Большая часть |
сопровождается |
полной блокадой канонической |
|||||||
индуцирующих стимулов, вызываемых NF-kB, |
NF-kB-зависимой внутриклеточной сигнальной |
||||||||
активирует «каноническую» регуляторную после- |
системы и повышением готовности гепатоци- |
||||||||
довательность, которая зависит от IKK2 и NEMO |
тов к эндотоксин/TNF-индуцируемому апоптозу. |
||||||||
и способствует деградации IkВ-α и активации |
Далее выключение в гепатоцитах р65/relA также |
||||||||
транскрипции димеров NF-kB, содержащих р50, |
повышает восприимчивость печени по отношению |
||||||||
р65 и c-rel. IKK1 |
требуется |
для |
активации |
к эндотоксин/TNF-индуцируемому апоптозу. Эти |
|||||
NF-kB |
на |
«альтернативном» |
пути, |
который |
данные указывают на то, что ингибирование кано- |
||||
включает процессинг р100 рецепторов LTβ-R и |
нической NF-kB-зависимой внутриклеточной сиг- |
||||||||
BAFF-R, и далее для генной экспрессии посред- |
нализации ниже определенного порога повышает |
||||||||
ством p52/relB. Отмечено, что IKK1 и IKK2 |
чувствительность печени к LPS/TNF-индуцируе- |
||||||||
обычно демонстрируют определенную функцио- |
мому апоптозу. При этом становится очевидным, |
||||||||
нальную избыточность при активации NF-kB- |
что IKK1 и IKK2 с избытком перекрывают друг |
||||||||
зависимых ответов на провоспалительные сигна- |
друга в опосредовании канонической активации |
||||||||
лы, и это может определяться типом исследуемых |
NF-kB и защите гепатоцитов от TNF-индуцируе- |
||||||||
клеток и характером стимулов. |
|
|
мого повреждения. |
||||||
В печени NF-kB участвует в регуляции вос- |
Изолированное выключение IKK1, IKK2 или |
||||||||
палительных и метаболических реакций, а также |
р65/relA в паренхиме не сопровождается спон- |
||||||||
в канцерогенезе. Показано [13], что выключение |
танным развитием патологии печени. Однако |
||||||||
IKK1 или IKK2 в печеночных паренхиматозных |
комбинированное выключение IKK1 и IKK2 в |
||||||||
клетках сопровождается частичным ингибирова- |
печеночной паренхиме сочетается со спонтанным |
||||||||
нием канонической NF-kB-зависимой сигнальной |
развитием тяжелой холестатической болезни пече- |
||||||||
последовательности и не повышает готовность |
ни, обусловленной воспалительной деструкцией |
||||||||
печеночных |
клеток |
к |
TNF-опосредуемому апо |
малых портальных желчных протоков. Мыши с |
|||||
10
