
Лекции ОФТТ
.pdfЗав. кафедрой электронных систем и устройств УТВЕРЖДАЮ д.т.н., профессор
_______________ Матюнин С.А. «____» ________________ 2012г.
Лекции дисциплина «Основы физики твердого тела»
211000.65 «Проектирование и технология радиоэлектронных средств»
Разработал А.И. Колпаков
САМАРА 2012
4
1. КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ТВЕРДЫХ ТЕЛ
Твердые тела классифицируют по степени периодичности расположения атомов в трехмерной кристаллической решетке. По этому критерию все кристаллические материалы подразделяются монокристаллы, поликристаллы и кристаллы с аморфной структурой. Монокристаллы в идеальном случае обладают абсолютной периодичностью расположения атомов в трехмерной структуре кристаллической решетки. Поликристаллы содержат несколько областей, внутри которых кристалл имеет монокристаллическую структуру, однако, кристаллографические оси этих монокристаллических областей не совпадают друг с другом и образуют из-за этого границы несоответствия электронных связей атомов различных областей. Это несоответствие приводит к возникновению в области границ большого количества разорванных связей склонных к захвату свободных электронов и образованию потенциальных барьеров. В результате этого границы монокристаллических областей приобретают специфические свойства, а именно: являются идеальными изоляторами в направлениях перпендикулярным к ним и вдоль границ наблюдается эффект высокой проводимости.
В твердых телах аморфной структуры периодичность расположения атомов сохраняется только в области неизменяемой конструкции расположения атомов, т.к. малейшее изменение их расположения в этой конструкции приводит к значительному изменению свойств материала. Эту совокупность атомов называют элементарной ячейкой. Таким образом, аморфный материал подобен поликристаллу, в котором монокристаллические области уменьшены до размеров элементарной ячейки. С периодическим расположением атомов в твердом теле также связаны и его фундаментальные физико-химические свойства: тепловые, электромагнитные, гальваномагнитные, дифракции всех частиц, движущихся внутри кристалла или попавших в него извне, таких, например, как электроны, фотоны, нейтроны и т.д. Из этого следует, что при управляемом нарушении периодичности кристаллической решетки становится возможным изменение параметров этих свойств. Например, путем введения в
структуру решетки примесных атомов, образования атомных пустот-вакансий. В процессе обработки твердого тела возникают также макродефекты в виде краевых и винтовых дислокаций, распространяющихся на единицы, десятки микрон способные значительно ухудшить параметры полупроводниковых приборов. Из этого следует и необходимость изучения физических основ строения кристалла, позволяющих полнее освоить механизмы
5
возникновения различных свойств в твердых телах, представляемых в последующих разделах.
1.1. ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА
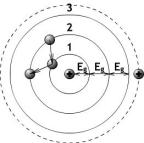
Физика твердого тела являются основой квантовой электроники, т.к. изучение структуры кристалла связано с изучением ее частиц фононов, позитронов, атомов и совокупности атомов, являющихся объектом рассмотрения в качестве квантовых частиц. Поэтому в качестве базового элемента квантовых частиц можно взять атом, свойства которого в кристалле и вне его обладают значительными различиями. Например, атомы в кристалле способны вступать во взаимодействие с другими атомами, испаряться, сублимировать, перераспределять свои атомные связи и т. д. Это означает неустойчивое положение атомов в кристалле, нарушаемое при любом внешнем воздействии на его структуру. Отдельный атом, избавившись от всяких внешних воздействий, приобретает минимальное количество энергии, т.е. находится в потенциальной «яме». Устойчивое положение отдельных атомов позволяет располагать их на расстоянии половины длины волны, что обеспечивает сверхпроводимость в цепочке таких атомов. Подобное явление в структуре кристалла можно достигнуть только при сверхнизких температурах. Поэтому становится необходимым изучение свойств отдельного атома, структуру которого можно представить в виде планетарной модели Резерфорда (рис.1).
Рис.1. Планетарная модель атома Резерфорда.
Согласно этой модели в центре структуры атома располагается позитрон, вокруг которого непрерывно перемещаются по орбиталям электроны. Причем в области между орбиталями электрону запрещено всякое продольное движение и разрешено движение по нормали, т.е. разрешено переходить с орбитали на орбиталь (см. рис.1 переходы 2-1-3). Образование вакантного места на орбитали 1 приводит к необходимости перехода электрона орбитали 2 на освободившееся место орбитали 1, восстанавливая этим
6
энергетическое равновесие. В связи с этим пространство между орбиталями назвали
запрещенной зоной и обозначили Еq.
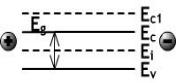
Физико-химические свойства атомов при их взаимодействиях в кристалле определяются параметрами электронов находящимися на энергетическом уровне внешней орбитали, называемой валентной и обозначаемой Еv. Если электрону находящемуся на валентной орбитали сообщить энергию равную Еq, то он переходит на некоторый энергетический уровень, в области которого он способен перемещаться под действием внешних источников энергии, т.е. электрон становится свободным. Такие электроны в кристалле образуют электрический ток, поэтому такую орбиталь назвали энергетическим уровнем проводимости и обозначили Еc. Характерной особенностью валентных электронов является равенство их параметров в любой точке орбитали. В связи этим мы можем выделить участок dx , в области которого орбитали имеют приблизительно прямолинейное направление. Это позволяет изобразить процесс перехода электрона с валентной орбитали на энергетический уровень проводимости энергетической диаграммой вида (рис.2):
Рис.2. Простейшая энергетическая диаграмма дискретного атома.
Из анализа диаграммы вытекают два случая:
1.Поскольку движение электрона разрешено только вдоль энергетических уровней орбиталей, то электрическое поле необходимо прикладывать к торцам диаграммы (см.
рис.2);
2.Уровень своей энергии электроны изменяют перемещаясь по нормали к энергетическим
уровням ЕC и ЕV.
Подобные энергетические диаграммы справедливы только для дискретных атомов, находящихся в потенциальных ямах и располагающихся на расстоянии r, обеспечивающего их невзаимодействие из-за возникновения барьера δ (рис. 3).
7

Рис.3. Структура расположения дискретных атомов, при выполнении условия r>>a, где,
а – расстояние между атомами в кристалле, E(r) – потенциальная энергия взаимодействия электрона с ядром.
Пространство каждого атома ограничено в этом случае потенциальной кривой E(r). Поэтому электроны находящиеся на энергетических уровнях Е1, Е2..Еn обладают отрицательной энергией, а валентные электроны лишены возможности переходить на энергетические уровни соседних атомов ввиду наличия барьера δ. Если эти атомы сближать относительно друг друга, то потенциальные энергии, описывающие потенциальную яму, начнут взаимодействовать друг с другом и на расстоянии r=a происходит их объединение, приводящее к опусканию уровня нулевой энергии 0-0΄ ниже уровня Еn и устранению барьера δ. (см. рис.4)
Рис.4. Структура расположения дискретных атомов, при их взаимодействии, т.е. при выполнении условия r=a.
Появление возможности перехода валентных электронов по уровню En к соседнему атому и обратно создает условие возникновения неопределенности, выражаемую в том, что атомы не в состоянии определить «свой» валентный электрон. Это означает появление на энергетической диаграмме двух дополнительных энергетических уровней Ec1 и Ev1 (рис. 5,
а).
8

а |
б |
Рис.5. Энергетическая диаграмма: а - |
двух взаимодействующих атомов водорода; б – |
при наличие на валентной орбитали атома 4 электронов.
При взаимодействии нескольких атомов, имеющих на валентных орбиталях более одного электрона, на энергетической диаграмме возникают дополнительные энергетические уровни. Это приводит к образованию энергетических зон, называемых зоной проводимости и валентной зоной (рис.5,б). При T=0K все энергетические уровни в зоне проводимости свободны, а в валентной зоне все уровни заняты электронами. Причем их положение в этих зонах формирует и конкретные свойства атомов в структуре кристалла или в дискретном положении.
1.2.КВАНТОВОЕ СОСТОЯНИЕ ЭЛЕКТРОНОВ В СТРУКТУРЕ АТОМОВ
Вобщем случае квантовое состояние электронов в структуре атома определяется совокупностью четырех квантовых чисел: главным квантовым числом (n), азимутальным квантовым числом ( l ), магнитным квантовым числом (m), спиновым квантовым числом
(s).
Главное квантовое число n может принимать только целые положительные значения. Совокупность электронов характеризующихся одинаковым главным квантовым числом образуют электронную оболочку (орбиталь) атома.
Квантовое число l определяет величину движения электронов и может иметь (n-1) различных значений l = 0, 1, 2… (n-1). В отсутствие внешних магнитных или электрических полей энергия электрона описывается равенством Е=Е(n, l ).
Электроны с одинаковым квантовым числом l образуют группу электронов, являющихся частью орбитали атома. Различные электронные оболочки принято еще обозначать латинскими буквами по следующей схеме:
l = 0, 1, 2, 3, ….. s, p, d, f, …
9
В соответствии с этим совокупность электронов принадлежащих к определенной оболочке атома и определенной его группе будем обозначать главным квантовым числом n и буквенным обозначением группы, а индексом сверху указываем число имеющихся в атоме таких электронов. Например, 3р2 означает, что в атоме имеется два электрона в
квантовом состоянии характеризуемого квантовыми числами n=3, l =1.
Третье квантовое число m устанавливает возможные пространственные направления, вектора момента количества движения при наличии какого-либо физически выделенного
направления |
и |
может |
принимать |
(2 l -1) |
выделенных |
значений, |
т.е. |
m = −1,−(l − 1)....,0,....(l − 1), l . |
|
|
|
|
|
||
Четвертое квантовое число s обусловлено наличием у самого электрона, независимо от его положения на орбитали атома, определенного механического момента количества движения, так называемого «спина» и связанного с ним магнитного момента. Для собственного механического момента электрона также имеет место пространственное квантование. Однако спиновое квантовое число способно принимать только два различных значения s =±1/2. Согласно принципу Паули в атоме в одном и том же квантовом состоянии не может быть более 1 электрона. Этот принцип приводит к определенной конечной вместимости электронных групп и оболочек. Согласно
указанному, вместимость групп при |
l =const |
равно |
числу |
различных значений m |
|
умноженных на 2 (вследствие двух |
возможных значений s), т.е. вместимость равна |
||||
2 (2l + 1). Это дает для различных групп электронов следующую схему значений: |
|||||
Группа |
s |
p |
d |
f |
… |
l |
0 |
1 |
2 |
3 |
… |
Вместимость |
2 |
6 |
10 |
14 |
… |
В каждой заполненной группе всегда имеется четное число электронов и при этом каждому электрону с определенными квантовыми числами n, l ,m всегда соответствует другой электрон с теми же квантовыми числами, но с противоположным спином. При выполнении условия n=const совместимость оболочек описывается равенством:
m−1
∑2(2l + 1) = 2n 2 .
l =0
Данное равенство позволяет получить расчетные значения квантовых чисел, приведенные в таблице
Оболочка |
К |
L |
М |
N |
О |
Р |
n |
1 |
2 |
3 |
4 |
5 |
6 |
10
Вместимость |
2 |
8 |
18 |
32 |
50 |
72 |
Заполненные электронные группы обладают особой устойчивостью, поэтому атомы благородных газов обладают значительной химической инертностью, а металлы, характеризуемые небольшим количеством электронных групп наоборот высокой химической активностью. Именно это свойство металлов позволяет электронам легко переходить из одной группы электронов в другую, изменяя кардинальным образом свойства материалов. Рассмотрим типичный атом металла натрий (Z=11), обладающий 11 электронами, расположенными согласно электронной структуре вида:
Na11 = (1s)2 (2s)2 (2 p)6 (3s)1 = (Ne)10 (3s)1 .
У атома натрия имеется только один валентный электрон с квантовыми параметрами (3s)1 и поэтому натрий одновалентный. С другой стороны у атома металлоида валентная оболочка почти заполнена, поэтому он легко принимает электроны из окружающей среды, становясь отрицательным ионом. В связи с этим все металлоиды имеют ионную связь. Типичным металлоидом является хлор, схема структуры которого имеет вид:
Cl17 : (Ne)10 (3s)2 (3 p)5
Здесь для заполнения группы электронов 3 p , валентность которой равна шести, не хватает одного электрона, поэтому атом хлора также одновалентен.
Таким образом, и атом натрия, и атом хлора свои свойства формируют только одним электроном, что дает право отнести их в одну группу.
1.3. ПРИРОДА СИЛ АТОМНЫХ СВЯЗЕЙ В КРИСТАЛЛАХ.
При сближении атомов между ними возникают силы взаимодействия, конечной целью которых является образование правильной структуры кристалла. Характерные особенности этой структуры также участвуют в формировании свойств твердых тел. Наиболее распространенными типами связи атомов в твердых телах являются: силы Ван- дер-Ваальса, ионная, ковалентная и металлическая связи.
Силы Ван-дер-Ваальса являются наиболее общими и возникают между любыми атомами взаимодействующих в структурах различных материалов. Впервые они были введены для описания и обоснования уравнения состояния реальных газов, особенностью которых является отсутствие взаимодействия между атомами с энергией ионизации валентного электрона E=0.2 Эв. В реальности они имеют место между нейтральными атомами и молекулами. Сущность сил Ван-дер-Ваальса состоит в том, что постоянный дипольный момент нейтральных атомов или молекул равен нулю, поэтому они
11

притягиваются друг к другу электрическими силами. Механизм притягивания возникает при нулевых колебаниях частиц, существующих в силу принципа неопределенности. Это приводит к созданию у каждого атома структурирующего дипольного момента с постоянной механической амплитудой. Образовавшееся поле убывает пропорционально кубу расстояния таким образом, что между двумя ядрами атомов в каждый момент времени диполь одного из них создает мгновенное поле пропорциональное отношению
1 |
|
3 |
|
|
|
|
|
|
|
, где r – расстояние между ядрами. Тогда потенциальная энергия взаимодействия |
|||||
r |
|
|
|
|
|
|
|
этих диполей может быть определена из выражения: |
|
||||||
|
|
E |
|
= − |
A |
|
(1). |
|
|
прит |
r 6 |
||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
С уменьшением расстояния между атомами возникают силы их отталкивания, обусловленные перекрытием электронных оболочек атома. Численное значение этого отталкивания определяется расстоянием между атомами и описывается либо степенным законом вида (r -11…r -12), либо с помощью характеристического параметра
|
A |
|
r |
|
||
E = − |
|
|
+ B exp − |
|
|
(2) |
|
6 |
|
||||
|
r |
|
|
|
|
|
|
|
|
ρ |
|
||
Энергия образующейся связи (Е) и равновесного состояния между связанными атомами определяются параметрами A, B и ρ . Графическое изображение равенства (2)
представлено на рис.5:
Рис.5. Графическое представление решения уравнения (2), где r0 - расстояние между атомами в равновесном состоянии, r - в текущем состоянии.
Из этой зависимости видно, что устойчивая связь образуется при межъядерном расстоянии равном r0. Характеристическая длина мала по сравнению с межатомным расстоянием, в равновесной конфигурации структуры атомов и отвечает минимуму энергии Е. Причем член равенства (2), соответствующий силе отталкивания, вносит весьма малый вклад в значение Е. Выше изложенное относится к механизму
12

взаимодействия двух атомов. В полном же виде в выражении (2) представлены эффекты дипольного притяжения и отталкивания, определяющие полное значение энергии связи для трехмерных кристаллов. Поскольку ограничение на направление связи отсутствует, то твердые тела, в которых связи обусловлены силами Ван-дер-Ваальса, стремятся образовать плотноупакованные кристаллические структуры с максимально возможным числом ближайших соседей у каждого атома. Однако силы притяжения быстро спадают с увеличением расстояния между атомов. Это означает, что все остальные атомы, кроме ближайших соседей, оказывают несущественное влияние на механизм взаимодействия атомов, т.е. силы Ван-дер-Ваальса действуют только на одно межатомное расстояние. Кристаллы инертных газов являются прекрасными примерами материалами, в которых связи обусловлены исключительно силами Ван-дер-Ваальса. Следует также заметить, что значительно чаще встречаются кристаллы, в которых силы Ван-дер-Ваальса связывают между собой молекулы с насыщенными связями, в то время как внутри самой молекулы между атомами действуют более сильные механизмы связи. Чаще всего это проявляется у молекул типа Н2, N2, О2, F2, CL2, Br2, I2. Так например CL2 имеет энергию диссоциации 0,2 Эв на молекулу, в то время как энергия диссоциации атомов содержащихся в самой молекуле составляет 2,5 Эв. Это связано с тем, что молекулы в кристалле связаны силами Ван-дер-Ваальса, а атомы в молекуле ковалентной связью.
Дисперсионная связь возникает, когда в каждый момент времени электроны на орбитали располагаются в определенных точках ее пространства. Это приводит к тому, что при взаимодействии каждый атом создает мгновенные диполи (см. рис. 6).
Рис.6. Модельные представления сил Ван-дер-Ваальса.
Подобные образования создают диполь, т.к. отсутствие электрона в какой-то точке орбитали означает «+», а его присутствие на противоположной стороне орбитали «-». Величина положительного заряда в этом случае равна заряду электронов, формирующих отрицательный заряд. Этот мгновенный дипольный момент способен индуцировать
13
