
- •Академия
- •Глава 1. Идеальный газ Тема
- •1.1. Тепловые явления. Характеристики тепловых явлений
- •1.2. Свойства газа, полученные на опыте
- •1.3. Уравнение состояния идеального газа
- •1.4. Изопроцессы
- •1.4.1. Изотермический процесс
- •1.4.2. Изобарный процесс
- •1.4.3. Изохорный процесс
- •1.5. Массы, размеры, энергии в мире молекул. Основные положения молекулярно-кинетической теории
- •1.5.1. Доказательства существования молекул
- •1.5.2. Движение молекул
- •1.5.3. Взаимодействие молекул
- •1.5.4. Твердые, жидкие и газообразные тела
- •1.6. Молекулярные основы теории идеального газа
- •1.7. Основное уравнение молекулярно-кинетической теории
- •1.8. Температура — мера средней кинетической энергии молекул
- •1.9. Растворенное вещество как идеальный газ
- •1.10. Реальные газы
- •Главное в главе 1
- •Глава 2. Термодинамика Тема
- •2.1. Первое начало термодинамики
- •2.1.1. Изохорный процесс
- •2.1.2. Изобарный процесс
- •2.1.3. Изотермический процесс
- •2.2. Адиабатный процесс
- •2.3. Энтропия
- •2.4. Второе начало термодинамики
- •Главное в главе 2
- •Глава 3. Статистика молекул Тема
- •3.1. Скорости молекул. Опыт Штерна
- •3.2. Распределение молекул по скоростям
- •3.3. Вероятность
- •3.4. Распределение Больцмана
- •3.4.1. Распределения молекул под действием силы тяжести
- •3.4.2. Распределение молекул по проекциям скоростей их движения
- •3.5. Распределение Максвелла
- •3.6. Наиболее вероятная скорость. Метод анализа размерностей
- •3.7. Барометрическая формула
- •3.8. Термоэлектричество. Термопара
- •3.8.1. Электроны у поверхности металла
- •3.8.2. Контактная разность потенциалов
- •Главное в главе 3
- •Глава 4. Явления переноса Тема
- •4.1. Длина свободного пробега молекулы
- •4.2. Диффузия. Закон Фика
- •4.3. Диффузия как случайное блуждание
- •4.4. Теплопроводность
- •4.5. Трение. Вязкость — внутреннее трение
- •Главное в главе 4
- •Глава 5. Молекулярная физика жидкой и твердой фаз, явлений на границе фаз и фазовых превращений Тема
- •5.1. Поверхностное натяжение
- •5.1.1. Методы исследования поверхностного натяжения жидкости
- •5.1.2. Адсорбция
- •5.1.3. Поверхностно-активные вещества. Применение поверхностно-активных веществ в фармации
- •5.2. Давление под изогнутой поверхностью жидкости. Формула Лапласа
- •5.3. Процессы испарения и конденсации
- •5.4. Капиллярные явления
- •5.4.1. Смачивание
- •5.4.2. Зависимость давления насыщенного пара от кривизны поверхности жидкости
- •5.4.3. Капиллярная конденсация. Гигроскопические материалы
- •5.5. Твердые тела. Аморфные и кристаллические твердые тела
- •5.6. Фазы. Равновесие фаз. Фазовые переходы
- •5.6.1. Сублимация (испарение)
- •5.6.2. Плавление и кристаллизация
- •5.6.3. Размягчение и стеклование
- •5.7. Жидкокристаллическое состояние вещества
- •5.8. Кристаллические модификации
- •5.8.1. Полиморфные превращения, их роль в изменении свойств фармацевтических препаратов
- •5.9. Теплоемкость твердых тел
- •5.9.1. Закон Дюлонга и Пти
- •5.9.2. Понятие о квантовой теории твердых тел
- •5.10. Механические свойства твердых тел
- •5.10.1. Упругость и пластичность
- •5.10.2. Особенности строения и свойства эластомеров
- •Главное в главе 5
2.3. Энтропия
Анализ изотермического процесса показывает, что теплота может выделяться (или поглощаться) и без изменения температуры, поэтому запись изменения теплоты в виде, пропорциональном изменению температуры δQ= СΔТ, по крайней мере, не универсальна. Кроме того, записав приращение теплоты как
δQ = dU + pdV, (2.20)
что прямо следует из первого начала, можно заметить: справа стоят такие величины, значения которых для тела в целом, например в изобарном процессе, равны сумме значений тех же величин для отдельных частей этого тела. В самом деле, энергия целого равна сумме энергий частей, объем целого также равен сумме объемов частей. Температура, очевидно, таким свойством не обладает. Если сложить две части тела, одну нагретую до 340 К (нагретую воду), а другую нагретую до 310 К (палец), то вместе они нагревания до 650 К не дадут.
С другой стороны, теплота δQсоответствует (например, в изохорном процессе) изменению энергииdU, а температураТ— средней энергии, поэтому отношениеδQ/Tдолжно определятьсячислом состояний, в которых могут бытьтакие «средние» энергии.
Итак, введем формально величину S, называемуюэнтропией, по формуле
![]() (2.21)
(2.21)
По своему смыслу энтропия должна быть связана с числом возможных состояний энергии в теле.Числовозможных состояний энергии, очевидно, связано «просто» с числом возможных сочетанийΓ частей той или иной системы.
Число сочетаний определяется числом частиц-молекул и их энергетическими состояниями, например уровнями энергии. Оказывается, что
S = k lnΓ. (2.22)
Эта формула была открыта Больцманом, и k— все та жепостоянная Больцмана:k = R/NA =1,4⋅10–23Дж/К. (По размерности подходит!)
Теперь от рассуждений перейдем к вычислениям, и тогда, может быть, станет яснее. Вычислим энтропию идеального газа. Это система, удовлетворяющая уравнению состоянияр/Т =νR/Vи имеющая внутреннюю энергиюU= сV νT. Из первого начала:
![]() (2.23)
(2.23)
Интегрируя (причем помня, что интеграл дает логарифм), получим:
![]() (2.24)
(2.24)
Из этой формулы видно, что энтропия — функция состояния, т. е. каждому состоянию газа соответствует определенная энтропия (как, например, внутренняя энергия U). Как и многие другие величины в физике (например, потенциал да и потенциальная энергия), энтропия определена лишь с точностью до постоянной — постояннойS0— значения энтропии, определяемой особо. ОпределениеS0выходит за рамки этого курса.
Практически важно знать только разность энтропий. Так обстоит и, например, с потенциалом электрического поля, важна лишь разность потенциаловΔφ, определяющая напряжениеU. Вычислим разность энтропий двух состояний (разность логарифмов свернется в частное):
![]() (2.25)
(2.25)
Теперь легко получить формулы для изменения энтропии в различных, изученных ранее изопроцессах.
Найдем изменение энтропии визотермическом процессе(приT2/T1=1):
![]() (2.26)
(2.26)
Изменение энтропии визохорном процессе(приV2/V1 = 1):
![]() (2.27)
(2.27)
Изменение энтропии визобарном процессе, когда по закону Гей-ЛюссакаV2/V1=T2/T1, подставив, увидим, что
![]() (2.28)
(2.28)
Здесь использовано, что по закону Майера теплоемкость при постоянном давлении (изобарная) равна сp= сV + R.
На диаграмме S–T(рис. 2.5), учитывая, чтоcp > cV, изобара пройдет выше изохоры при одинаковых исходных состояниях. На такой диаграмме (рис. 2.6)теплота — это площадь между кривой иосью энтропии.

Рис. 2.5.ДиаграммаS–T: (1) — изобара; (2) — изохора
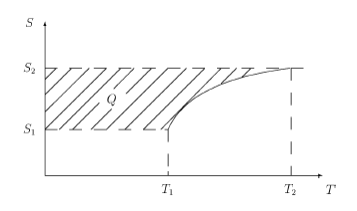
Рис. 2.6.Теплота на диаграммеS–Т
Наконец, изменение энтропии вадиабатном процессе(приdQ = 0), очевидно,
![]() (2.29)
(2.29)
Итак, в адиабатном процессе энтропия не изменяется. Часто именно это положение используют как определение адиабатного процесса.
Легко увидеть, что формула (2.29) есть просто другая запись закона адиабатного процесса. СокращаяνсVи «загоняя» все под логарифм (в показатель степени), а затем опуская логарифм, получим:
![]() (2.30)
(2.30)
Это соотношение с помощью уравнения состояния преобразуется в
![]() (2.31)
(2.31)
Получился уже выведенный ранее закон и постоянная Пуассона, равная γ=cp/cV.
