
- •Введение
- •1 Коллоидное состояние вещества
- •2 Поверхностный слой
- •3 Свободная поверхностная энергия. Поверхностное натяжение
- •4 Адгезия и когезия
- •5 Смачивание
- •6 Адсорбция
- •7 Адсорбция Гиббса
- •8 Поверхностно-активные вещества
- •9 Адсорбция поверхностно-активных веществ
- •10 Уравнение Шишковского. Правило Траубе
- •11 Поверхностная активность. Работа адсорбции
- •12 Адсорбция на твердых адсорбентах
- •12.1 Уравнение Ленгмюра
- •12.2 Уравнение Фрейндлиха
- •12.3 Полимолекулярная (потенциальная) теория адсорбции Поляни
- •12.4 Теория полимолекулярной адсорбции БЭТ
- •13 Адсорбционное понижение прочности. Эффект Ребиндера
- •Лабораторная работа №1. Адсорбция ПАВ на твердом абсорбенте
- •Вопросы
- •Задания
- •14 Получение коллоидных растворов. Лиофильные и лиофобные коллоидные растворы
- •15 Образование и строение заряженных коллоидных частиц
- •16 Очистка коллоидных систем
- •17 Теории строения двойного электрического слоя
- •18 Электрокинетические явления
- •19 Устойчивость дисперсных систем
- •20 Коагуляция лиофобных дисперсных систем
- •21 Защита коллоидных частиц и сенсибилизация
- •Лабораторная работа №2. Получение коллоидных систем конденсационными методами
- •Лабораторная работа №3. Очистка коллоидных систем
- •Лабораторная работа 6. Определение порога коагуляции
- •Лабораторная работа 7. Определение защитного числа желатины для золя Fе(ОН)3
- •Лабораторная работа 8. Взаимная коагуляция золей
- •Вопросы для самоподготовки и контроля.
- •Задания.
- •22 Общая характеристика высокомолекулярных соединений
- •23 Растворы полимерных электролитов. Изоэлектрическая точка
- •24 Белки – природные полиамфолиты
- •25 Влияние рН на структуру и свойства растворов белка
- •26 Оптические свойства коллоидных систем
- •26.1 Рассеяние света
- •26.2 Абсорбция света
- •27 Оптические методы исследования коллоидных систем
- •28 Фотоэлектроколориметр ФЭК-56
- •Порядок работы на приборе ФЭК-56
- •Лабораторная работа 9. Определение изоэлектрической точки казеина
- •Вопросы для самоподготовки и контроля.
- •Список использованной литературы

kcs . (11.5) cv
Зависимость величины поверхностного натяжения сильно разбавленного раствора от его концентрации также является прямолинейной:
o kRTdc . (11.6)
Произведение kRT является постоянной величиной для данного водного раствора и совпадает со значением поверхностной активности растворенного вещества по отношению к
воде: |
|
|
|
|
k RT |
d |
|
kRT g . (11.7) |
|
dc |
||||
|
|
|
12Адсорбция на твердых адсорбентах
12.1Уравнение Ленгмюра
Фундаментальным вкладом в учение об адсорбции явилась теория Ленгмюра. Эта теория позволяет учесть наиболее сильные отклонения от закона Генри, связанные с ограниченностью адсорбционного объема или поверхности адсорбента. Ограниченность этого параметра приводит к адсорбционному насыщению поверхности адсорбента по мере увеличения концентрации распределяемого вещества. Это положение является основным в теории Ленгмюра и уточняется следующими допущениями:
1.Адсорбция происходит на дискретных адсорбционных центрах, которые могут иметь различную природу.
2.При адсорбции соблюдается строго стехиометрическое условие - на одном центре адсорбируется одна молекула.
3.Адсорбционные центры энергетически эквивалентны и независимы, то есть адсорбция на одном центре не влияет на адсорбцию на других центрах.
4.Процесс адсорбции находится в динамическом равновесии с процессом десорбции. Первое положение означает, что адсорбированные молекулы прочно связаны с
адсорбционными центрами; они как бы локализованы на центрах (локализованная адсорбция). Из второго положения следует, что на поверхности может образовываться только один адсорбционный слой, поэтому адсорбцию по Ленгмюру называют мономолекулярной. Третье положение означает, что дифференциальная теплота адсорбции постоянна и что силами взаимодействия адсорбированных молекул можно пренебречь. И, наконец, согласно последнему положению, адсорбированные молекулы вследствие флуктуаций энергии могут отрываться от центров и возвращаться в газовую фазу.
На основании этих положений можно получить уравнение изотермы адсорбции. Скорость адсорбции из газовой фазы Vадс (то есть число молекул, адсорбированных за единицу времени) пропорциональна давлению газа и числу свободных центров на поверхности твердого тела. Если общее число центров А , а при адсорбции оказывается занятыми А центров, то число центров, остающихся свободными равно (А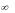 - А). Поэтому Vадс = kадс. р (А - А). Адсорбция динамически уравновешена процессом десорбции. Скорость десорбции пропорциональна числу адсорбированных молекул Vдес = kдес. А . При равновесии V адс = Vдес или kадс . р (А - А) = kдес . А . Переобозначив kадс / kдес = К (где К - это константа адсорбционного равновесия) и А/А = . (относительное заполнение поверхности) получим
- А). Поэтому Vадс = kадс. р (А - А). Адсорбция динамически уравновешена процессом десорбции. Скорость десорбции пропорциональна числу адсорбированных молекул Vдес = kдес. А . При равновесии V адс = Vдес или kадс . р (А - А) = kдес . А . Переобозначив kадс / kдес = К (где К - это константа адсорбционного равновесия) и А/А = . (относительное заполнение поверхности) получим
Kc
A A 1 Kc (12.1)
Уравнение называется уравнением изотермы адсорбции Ленгмюра Необходимо отметить, что константа адсорбционного равновесия Ленгмюра
характеризует энергию взаимодействия адсорбата с адсорбентом. Чем сильнее это взаимодействие, тем больше константа адсорбционного равновесия. Адсорбционное
17
уравнение Ленгмюра часто представляют относительно степени заполнения поверхности — отношения величины адсорбции к емкости монослоя.
Kc |
(12.2) |
1 Kc |
Типичная изотерма адсорбции Ленгмюра показана на рисунке 5.
Рисунок 5 – Изотерма адсорбции Ленгмюра
Важны экстраполяционные следствия из соотношений. При малых концентрациях или давлениях (участок 1 на рисунке 5), когда с→0 получаем:
A A Kc и 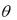 Kc
Kc
Выражения соответствуют закону Генри: величина адсорбции линейно растет с увеличением концентрации. Таким образом, уравнение Ленгмюра является более общим соотношением, включающим и уравнение Генри. При больших концентрациях и давлениях (участок 3 на рисунке 5), когда Кс >> 1 и Кр >> 1, уравнения переходят в соотношения
A A и |
1 |
Соотношения отвечают насыщению, когда вся поверхность адсорбента покрываѐтся мономолекулярным слоем адсорбата.
Важно отметить, что, несмотря на то, что уравнение Ленгмюра было выведено специально для описания процессов адсорбции на границе раздела твердое тело-газ, оно хорошо применимо для растворов ПАВ на границе с воздухом.
Для экспериментальной проверки применимости уравнения Ленгмюра и нахождения констант, уравнение Ленгмюра приводят к линейному виду, разделив концентрацию с на левую и правую части уравнения. После несложного преобразования получим:
C |
|
C |
1 |
(12.3) |
|
|
|
|
|
|
|
A |
|
A |
|
A k |
|
При построении графика в координатах C/A – C должна получиться прямая:
Рисунок 6 – Изотерма адсорбции Ленгмюра в линейном виде
18

Полученную прямую продолжают до пересечения с осью C/A и по величине тангенса угла наклона прямой находят значение предельной адсорбции A∞. Значение константы адсорбции вычисляют, зная длину отрезка, отсекаемого прямой на оси C/A. Длина отрезка будет равняться 1/kA∞.
Согласно принципу независимости поверхностного натяжения, который ввел Ленгмюр, величина предельной адсорбции A∞ одинакова для всех членов гомологического ряда, то есть не зависит от длины углеводородной цепи, а определяется только площадью поперечного сечения
молекул Sмолекулы. Это утверждение становится понятным, если рассмотреть строение поверхностного слоя при его предельном заполнении. В этом случае дифильные
молекулы могут располагаться в поверхностном слое единственно возможным образом, когда гидрофильные части молекул находятся на поверхности воды и плотно примыкают друг к другу, а гидрофобные радикалы ориентируются к воздушной среде (так называемый «частокол Ленгмюра»).
Если предельная адсорбция – это количество моль ПАВ, полностью занимающее единицу поверхности, то величина, обратная предельной адсорбции, будет давать суммарную площадь поперечного сечения одного моль молекул, тогда площадь одной молекулы:
S молекулы |
|
1 |
|
(12.4) |
|
|
|
||
|
|
|
||
|
A |
|
N A |
|
Для нахождения толщины поверхностного слоя (соответствует длине молекулы ПАВ при предельной величине адсорбиции) необходимо помимо Sмолекулы знать ее объем:
Vмолекулы |
M |
, (12.5) |
|
|
|||
N A |
|||
|
|
тогда толщина поверхностного слоя:
Vмолекулы |
|
M A N A |
|
M A |
, (12.6) |
S молекулы |
|
N A |
|
|
|
|
|
|
|
где М – молярная масса ПАВ, ρ – плотность ПАВ, δ – толщина поверхностного слоя ПАВ.
12.2Уравнение Фрейндлиха
Адсорбция газов на твердой поверхности в области средних давлений может быть описана полуэмпирическим уравнением Бедекера-Фрейндлиха:
x |
kp1/ n (12.7) |
|
|
||
m |
||
|
где x – количество адсорбированного вещества; m – масса адсорбента; k и 1/n – константы; p – равновесное давление пара или газа в системе.
Это уравнение широко используется при обработке экспериментальных данных и инженерных расчетах в области средних концентраций (или давлений). Чаще всего оно применяется в логарифмической форме:
19

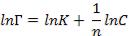 (12.8)
(12.8)
позволяющей построить линейную зависимость lnГ = f (lnC) и графически определить
К и п.
Несмотря на то, что уравнение Фрейндлиха широко применяется на практике, оно имеет определенные недостатки. Многочисленные исследования показали, что значения величины адсорбции, вычисляемые на основании этого уравнения, не соответствуют данным опыта в области малых и больших концентраций. Константы К и 1/n не имеют определенного физического смысла и являются исключительно эмпирическими.
12.3Полимолекулярная (потенциальная) теория адсорбции Поляни
Было установлено, что наряду с изотермами монослойной адсорбции, на практике часто встречаются изотермы, не имеющие второго участка, почти параллельного оси абсцисс и отвечающего насыщению адсорбента адсорбатом:
Для объяснения этого явления М. Поляни предложил теорию полимолекулярной адсорбции, называемую также потенциальной теорией Поляни.
Основные положения теории Поляни
1.Адсорбция обусловлена исключительно физическими силами взаимодействия.
2.На поверхности адсорбента нет активных центров, а адсорбционные силы действуют вблизи поверхности адсорбента и образуют около этой поверхности со стороны газовой фазы непрерывное силовое поле.
3.Адсорбционные силы действуют на расстояниях, бóльших, чем размеры отдельных молекул, и поэтому у поверхности адсорбента образуется адсорбционный объем, который при адсорбции заполняется молекулами адсорбата.
4.Действие адсорбционных сил по мере удаления от поверхности уменьшается и на некотором расстоянии становится равным нулю.
5.Притяжение данной молекулы поверхностью адсорбента не зависит от наличия в адсорбционном пространстве других молекул, вследствие чего возможна полимолекулярная адсорбция.
6.Адсорбционные силы не зависят от температуры и поэтому адсорбционный объем при изменении температуры не изменяется.
Всоответствии с теорией Поляни для каждой пары адсорбент-адсорбат характеристическая кривая, то есть зависимость адсорбционного потенциала ε от объема V, заключенного между поверхностью, соответствующей данному потенциалу, и поверхностью адсорбента, устанавливается по экспериментально определяемой изотерме адсорбции. Эта зависимость имеет вид:
20
