
- •Введение
- •1 Коллоидное состояние вещества
- •2 Поверхностный слой
- •3 Свободная поверхностная энергия. Поверхностное натяжение
- •4 Адгезия и когезия
- •5 Смачивание
- •6 Адсорбция
- •7 Адсорбция Гиббса
- •8 Поверхностно-активные вещества
- •9 Адсорбция поверхностно-активных веществ
- •10 Уравнение Шишковского. Правило Траубе
- •11 Поверхностная активность. Работа адсорбции
- •12 Адсорбция на твердых адсорбентах
- •12.1 Уравнение Ленгмюра
- •12.2 Уравнение Фрейндлиха
- •12.3 Полимолекулярная (потенциальная) теория адсорбции Поляни
- •12.4 Теория полимолекулярной адсорбции БЭТ
- •13 Адсорбционное понижение прочности. Эффект Ребиндера
- •Лабораторная работа №1. Адсорбция ПАВ на твердом абсорбенте
- •Вопросы
- •Задания
- •14 Получение коллоидных растворов. Лиофильные и лиофобные коллоидные растворы
- •15 Образование и строение заряженных коллоидных частиц
- •16 Очистка коллоидных систем
- •17 Теории строения двойного электрического слоя
- •18 Электрокинетические явления
- •19 Устойчивость дисперсных систем
- •20 Коагуляция лиофобных дисперсных систем
- •21 Защита коллоидных частиц и сенсибилизация
- •Лабораторная работа №2. Получение коллоидных систем конденсационными методами
- •Лабораторная работа №3. Очистка коллоидных систем
- •Лабораторная работа 6. Определение порога коагуляции
- •Лабораторная работа 7. Определение защитного числа желатины для золя Fе(ОН)3
- •Лабораторная работа 8. Взаимная коагуляция золей
- •Вопросы для самоподготовки и контроля.
- •Задания.
- •22 Общая характеристика высокомолекулярных соединений
- •23 Растворы полимерных электролитов. Изоэлектрическая точка
- •24 Белки – природные полиамфолиты
- •25 Влияние рН на структуру и свойства растворов белка
- •26 Оптические свойства коллоидных систем
- •26.1 Рассеяние света
- •26.2 Абсорбция света
- •27 Оптические методы исследования коллоидных систем
- •28 Фотоэлектроколориметр ФЭК-56
- •Порядок работы на приборе ФЭК-56
- •Лабораторная работа 9. Определение изоэлектрической точки казеина
- •Вопросы для самоподготовки и контроля.
- •Список использованной литературы
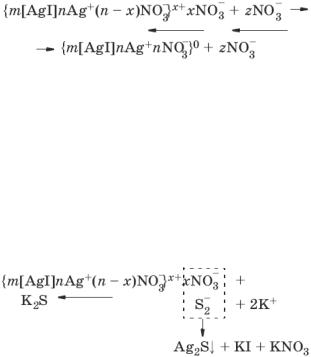
минимума. В системе, находящейся в таком состоянии, происходит быстрая флокуляция частиц на расстояниях, соответствующих вторичному минимуму. Благодаря наличию потенциального барьера частицы во флокулах не имеют непосредственного контакта и разделены прослойками среды. Очевидно, что такое состояние отвечает обратимости коагуляции. Пептизация возможна после устранения вторичного минимума или его уменьшения до значения меньше кТ. Кривая З отвечает состоянию системы с высоким потенциальным барьером при отсутствии вторичного минимума или при его глубине, меньшей тепловой энергии (кТ). Вероятность образования агрегатов частиц в таких условиях очень мала, и дисперсные системы обладают большой агрегативной устойчивостью
20 Коагуляция лиофобных дисперсных систем
Наибольший теоретический и практический интерес представляет коагуляция гидрофобных золей электролитами. Как Вы помните, для большинства гидрофобных золей основным фактором, обеспечивающим их стабильность (наряду с гидратной оболочкой), является наличие одноименного заряда у частиц дисперсной фазы. Введение электролитов в гидрозоли может приводить к уменьшению или полной нейтрализации заряда коллоидных частиц, что ослабляет их электростатическое отталкивание, способствует сближению и агрегации. Однако механизм электролитной коагуляции может быть различен. Было обнаружено, что электролиты существенно различаются по способности вызывать коагуляцию золей. По механизму изменения заряда коллоидных частиц электролиты делятся на индифферентные и неиндифферентные.
Индифферентными (от лат. indifferens – безразличный) являются электролиты, которые не способны прочно адсорбироваться на поверхности агрегата. Они вызывают концентрационную коагуляцию. Такая ситуация обычно реализуется, когда коллоидная частица имеет значительный заряд, а ионы, входящие в состав электролита, не являются идентичными с ионами, образующими адсорбционные слои. В этом случае основное действие вводимого электролита заключается, главным образом, в увеличении ионной силы дисперсионной среды. Согласно теории Дебая-Хюккеля это приводит к сжатию ионной атмосферы коллоидной частицы, что вызывает увеличение вероятности проникновения противоионов из диффузного слоя в адсорбционный. В результате данного процесса заряд коллоидной частицы, и, следовательно, δ-потенциал уменьшается.
Состояние, при котором диффузный слой исчезнет и коллоидная частица становится электронейтральной, называется изоэлектрическим – электрокинетический потенциал (δ) равен нулю, наступает коагуляция. Формула мицеллы в таком состоянии приобретает вид:
{m[AgI]nAg+nNO3¯}0.
Электролиты являются неиндифферентными по отношению к данному гидрозолю, если они способны прочно адсорбироваться на поверхности агрегата, либо за счет достройки кристаллической решетки (согласно правилу Пескова-Панета-Фаянса), либо за счет замещения потенциалопределяющих ионов. Очевидно, что это приведет к изменению как φ-, так и δ-потенциалов. Данный механизм реализуется лишь тогда, когда заряд коллоидной частицы невелик. При этом может происходить нейтрализация заряда коллоидной частицы,
поэтому коагуляцию называют нейтрализационной или адсорбционной.
43
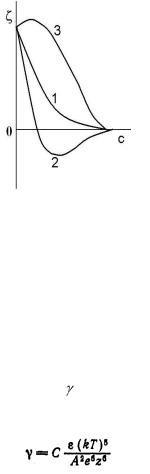
Если электролит содержит те же ионы, что и противоионы исходного двойного слоя, δ-потенциал уменьшается вследствие уменьшения толщины ионной атмосферы (рис.14, кривая 1). Если добавленный электролит содержит ионы большего знака, происходит ионный обмен и при наличии сильных электростатических и адсорбционных сил притяжения ионов к поверхности, может происходить изменение знака δ-потенциала, т.е. перезарядка частиц золя (рис.14, кривая 2). При добавлении неиндефферентных электролитов, содержащих ионы одинакового знака с потенциалопредедяющими ионами, сначала происходит увеличение δ-потенциала (вместе с потенциалом поверхности), а затем его уменьшение из-за сжатия диффузного слоя (рис.14, кривая 3). Если неиндефферентный электролит содержит ионы противоположного знака потенциалопределяющим, то происходит перезарядка поверхности и зависимость δ-потенциала от концентрации добавленного электролита будет иметь вид кривой 2 рис.14.
Рис.14. Влияние электролитов на δ-потенциал (дзета-потенциал)
Введение любого электролита приводит к увеличению ионной силы и, следовательно, к сжатию ДЭС. При небольших концентрациях индифферентного электролита его влияние обычно невелико. Иная ситуация типична для неиндифферентных электролитов – уже небольшое его количество способно вызвать существенное изменение строения ДЭС. Коагулирующее действие электролитов определяется, прежде всего, величиной заряда, электронной структурой и размером тех ионов, знак которых противоположен знаку заряда коллоидных частиц.
Минимальная концентрация электролита, которая вызывает начало процесса коагуляции называется порогом коагуляции к (ммоль/мл). Она является постоянной величиной для данной пары золь–электролит при одинаковых внешних условиях (температура, давление и т. п.).
где С – константа зависящая от отношения числа зарядов катиона и аниона, е – заряд электрона, z – валентность противоиона, А – постоянная притяжения.
Иногда используют величину, обратную порогу коагуляции, – коагулирующую способность электролита Vк.
Правила коагуляции
1.Для протекания коагуляции с заметной скоростью необходимо достижение некоторой минимальной концентрации электролита – порога коагуляции.
2.Коагулирующим действием обладает тот из ионов электролита, заряд которого противоположен заряду коллоидных частиц, причем коагулирующее действие иона тем сильнее, чем больше его заряд (правило Шульце-Гарди). Правило Шульце-Гарди имеет приближенный характер и справедливо только для неорганических ионов.
Отношение порогов коагуляции одно-, двух- и трехзарядных ионов в соответствии с эмпирическим правилом Шульце-Гарди приближенно равно:
γ1 : γ2 : γ3 = 500 : 25 : 1,
44

где γ1 – порог коагуляции для однозарядного иона; γ2 – то же для двухзарядного иона; γ3 – то же для трехзарядного иона.
3.В ряду органических ионов коагулирующее действие пропорционально их способности адсорбироваться.
4.Началу коагуляции соответствует снижение ξ-потенциала до критической величины
(~0,03 В).
5.В рядах неорганических ионов с одинаковыми зарядами коагулирующее действие возрастает с уменьшением гидратируемости ионов, или, увеличением радиуса ионов; например:
Возрастание коагулирующей активности
Li+ Na+ К+ Rb+
Возрастание степени гидратации
Такие ряды, в которых ионы расположены в порядке убывания или возрастания коагулирующей способности, называют лиотропными рядами.
6. В осадках, получаемых при коагуляции золей электролитами, всегда присутствуют ионы, вызвавшие коагуляцию. Например, при коагуляции хлоридом бария золя сульфида
мышьяка, частицы которого имеют отрицательный заряд, в осадке содержится некоторое количество Ва2+.
7. При коагуляции золей смесями электролитов сравнительно редко наблюдается их независимое (аддитивное) действие; обычно имеет место взаимное усиление (синергизм ионов) либо ослабление коагулирующего действия (антагонизм ионов).
21 Защита коллоидных частиц и сенсибилизация
При введении в золь определенных высокомолекулярных веществ и образовании на поверхности частиц соответствующего адсорбционного слоя устойчивость системы может быть значительно повышена. Такое явление получило название коллоидной защиты. Веществами, способными обусловливать коллоидную защиту, являются белки, углеводы, пектины, а для систем с неводной дисперсионной средой — каучук.
Защитное вещество как бы придает золю свойства раствора этого вещества. В присутствии высокомолекулярных защитных веществ золи, вообще не поддающиеся концентрированию до высокого содержания дисперсной фазы, можно выпарить досуха и затем полученный сухой остаток можно снова коллоидно растворить. Электрофоретическая подвижность частиц золей, адсорбировавших достаточное количество защитного вещества; обычно равна электрофоретической подвижности молекул полимера. Наконец, защищенные золи при добавлении электролитов не подчиняются правилу Шульце — Гарди, а ведут себя как растворы защитного высокомолекулярного вещества, причем для выделения дисперсной фазы в осадок требуется то же количество электролита, что и для осаждения высокомолекулярного вещества. Существенно, также, что реагент, способный осаждать защитное вещество, осаждает и защищенный золь даже в том случае, если исходный золь индифферентен к этому реагенту.
Для характеристики защитного действия различных высокомолекулярных веществ Зигмонди предложил так называемое «золотое число». Под золотым числом подразумевают число миллиграммов высокомолекулярного вещества, которое необходимо—добавить к 10 мл красного золотого золя для того, чтобы предотвратить его .посинение при введении в
систему 1 мл 10%-ного раствора хлорида натрия.
45
Механизм защитного действия сводится к образованию вокруг коллоидной частицы адсорбционной оболочки из высокомолекулярного вещества.
Иногда введение в коллоидную систему очень малых количеств высокомолекулярного вещества приводит не к защите, а, наоборот, к сенсибилизации, т. е. к тому, что порог коагуляции золя, в который введено высокомолекулярное вещество, оказывается меньшим, чем для исходного золя.
46
