
- •Введение
- •1 Коллоидное состояние вещества
- •2 Поверхностный слой
- •3 Свободная поверхностная энергия. Поверхностное натяжение
- •4 Адгезия и когезия
- •5 Смачивание
- •6 Адсорбция
- •7 Адсорбция Гиббса
- •8 Поверхностно-активные вещества
- •9 Адсорбция поверхностно-активных веществ
- •10 Уравнение Шишковского. Правило Траубе
- •11 Поверхностная активность. Работа адсорбции
- •12 Адсорбция на твердых адсорбентах
- •12.1 Уравнение Ленгмюра
- •12.2 Уравнение Фрейндлиха
- •12.3 Полимолекулярная (потенциальная) теория адсорбции Поляни
- •12.4 Теория полимолекулярной адсорбции БЭТ
- •13 Адсорбционное понижение прочности. Эффект Ребиндера
- •Лабораторная работа №1. Адсорбция ПАВ на твердом абсорбенте
- •Вопросы
- •Задания
- •14 Получение коллоидных растворов. Лиофильные и лиофобные коллоидные растворы
- •15 Образование и строение заряженных коллоидных частиц
- •16 Очистка коллоидных систем
- •17 Теории строения двойного электрического слоя
- •18 Электрокинетические явления
- •19 Устойчивость дисперсных систем
- •20 Коагуляция лиофобных дисперсных систем
- •21 Защита коллоидных частиц и сенсибилизация
- •Лабораторная работа №2. Получение коллоидных систем конденсационными методами
- •Лабораторная работа №3. Очистка коллоидных систем
- •Лабораторная работа 6. Определение порога коагуляции
- •Лабораторная работа 7. Определение защитного числа желатины для золя Fе(ОН)3
- •Лабораторная работа 8. Взаимная коагуляция золей
- •Вопросы для самоподготовки и контроля.
- •Задания.
- •22 Общая характеристика высокомолекулярных соединений
- •23 Растворы полимерных электролитов. Изоэлектрическая точка
- •24 Белки – природные полиамфолиты
- •25 Влияние рН на структуру и свойства растворов белка
- •26 Оптические свойства коллоидных систем
- •26.1 Рассеяние света
- •26.2 Абсорбция света
- •27 Оптические методы исследования коллоидных систем
- •28 Фотоэлектроколориметр ФЭК-56
- •Порядок работы на приборе ФЭК-56
- •Лабораторная работа 9. Определение изоэлектрической точки казеина
- •Вопросы для самоподготовки и контроля.
- •Список использованной литературы
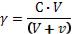
б) Определение порога коагуляции золя серы
Золь серы заряжен отрицательно, поэтому коагулирующими ионами являются катионы. Для работы используются электролиты с одинаковыми анионами: 4М раствор NaCl
инасыщенный раствор CaCl2.
Втри сухие и чистые пробирки наливается по 5 мл приготовленного золя серы. Одна пробирка является контрольной. Во вторую и третью наливаются по каплям (при взбалтывании) растворы хлорида натрия и хлорида кальция соответственно до появления белой мути и замеряется объем электролита, пошедшего на коагуляцию. Порог коагуляции рассчитывается по формуле:
Лабораторная работа 7. Определение защитного числа желатины для золя Fе(ОН)3
В три сухие пробирки наливают по 5 мл приготовленного золя Fe(OH)3. Первая пробирка контрольная. Во вторую пробирку при непрерывном встряхивании по каплям добавляют 0,0005М раствор К3[Fе(СN)6] до появления мути (явная коагуляция). В третью пробирку сначала наливается 1-2 мл 1 %-го раствора желатины, хорошо перемешивается и прибавляется раствор 0,0005М К3[Fе(СN)6] в таком объеме, который вызвал коагуляцию во второй пробирке (коагуляция не наблюдается).
Лабораторная работа 8. Взаимная коагуляция золей
В 10 пробирок наливают золь Fе(ОН)3 в убывающем количестве по порядку (табл.). В каждую пробирку приливают золь MnО2 в количестве, указанном в таблице. По окончании опытов отмечают номер пробирки, в которой наблюдается максимум коагуляции.
Таблица 4
№ пробирки |
Fе(ОН)3, мл |
MnО2, мл |
Результаты смешения |
1 |
9,9 |
0,1 |
|
2 |
9,7 |
0,3 |
|
3 |
9,5 |
0,5 |
|
4 |
9,0 |
1,0 |
|
5 |
7,0 |
3,0 |
|
6 |
5,0 |
5,0 |
|
7 |
3,0 |
7,0 |
|
8 |
1,0 |
9,0 |
|
9 |
0,5 |
9,5 |
|
10 |
0,2 |
9,8 |
|
51
