
- •Сборник памяток для студентов направления 270800 «Строительство»
- •Расписание занятий
- •1 Неделя
- •2 Неделя
- •Студенту о модульно-рейтинговой системе организации и квалиметрии учебной деятельности
- •Памятка по изучению дисциплины «Английский язык»
- •Содержание дисциплины
- •2. Литература и учебно-методические материалы.
- •Основная
- •Дополнительная
- •Методические рекомендации для студентов
- •Интернет ресурсы
- •3. График контроля.
- •Памятка по изучению дисциплины «Отечественная история» Составил проф. Суверов в.М. Утверждена на заседании кафедры
- •Содержание дисциплины
- •Литература и учебно-методические материалы
- •Учебные пособия
- •График контроля
- •Возможности повышения рейтинга
- •3. График контроля
- •4. Шкала оценок и правила вычисления рейтинга
- •Памятка по изучению дисциплины «Химия»
- •1. Содержание дисциплины
- •Самостоятельно студенты изучают следующие вопросы:
- •3. График контроля
- •4. Шкала оценок и правила вычисления рейтинга
- •5. Возможности повышения рейтинга
4. Шкала оценок и правила вычисления рейтинга
В АлтГТУ принята 100-бальная шкала оценок. Именно эти оценки учитываются при подсчете рейтингов, назначении стипендии и в других случаях. Традиционная шкала будет использоваться только в зачетных книжках.
Соответствие оценок устанавливается следующим образом:
75 -100 баллов – «отлично»,
50 - 74 балла – «хорошо»,
25 - 49 баллов – «удовлетворительно»,
менее 25 баллов – «неудовлетворительно».
Семестровый (предэкзаменационный) рейтинг вычисляется по формуле:
Rсем=0,9R+ Бп ,
где R – текущий рейтинг на конец семестра, вычисленный по результатам контрольных точек,
БП – дополнительные баллы за посещаемость занятий, определеннее по следующей схеме:
П< 50% - Бп = 0 ; 50% < П < 60% - Бп = 2; 60% < П < 70% - Бп = 4; 70% < П < 80% - Бп = 6; 80% < П < 90% - Бп = 8; 90% < П < 100% - Бп = 10;
Текущий рейтинг вычисляется по формуле:
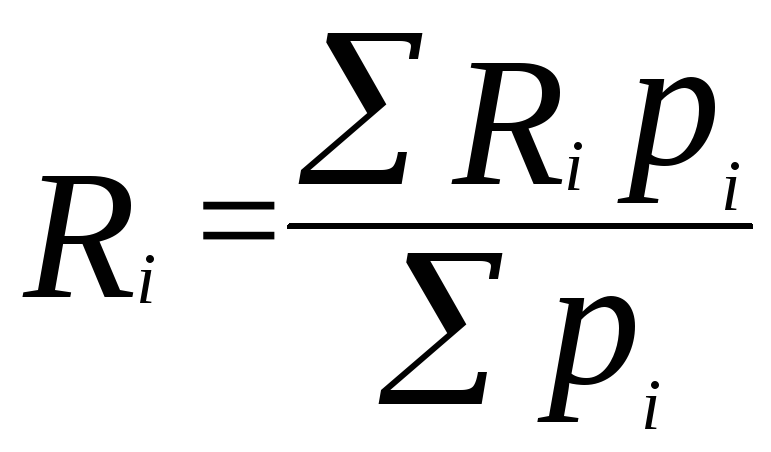
где Ri – оценка за i –ю контрольную точку, pi – вес этой контрольной точки. Суммирование проводится по всем контрольным точкам с начала семестра до момента вычисления рейтинга.
Итоговый рейтинг, учитывающий экзамен:
Rитог.=0,5Rсем + 0,5Rэкз
где Rэкз – рейтинг экзамена
Памятка по изучению дисциплины «Химия»
Составил: Христенко М.С. Утверждаю: Зав. кафедрой ОНиАХ _________________________ Хлебников А.И.________________
«25» июня 2011 года
1. Содержание дисциплины
Дисциплина ХИМИЯ общим объемом 108 часов изучается в течение 1 – го семестра, сопровождается сквозным рейтингом и завершается экзаменом.
Предусмотрено: 17 ч. лекций, 34 ч. лабораторных занятий, 57 часов самостоятельной работы, еженедельная двухчасовая консультация.
Будут рассмотрены следующие темы.
|
Модуль 1 |
|
Введение. Химические свойства основных классов неорганических соединений. Электролитическая диссоциация соединений. Типы химических реакций. Окислительно-восстаносительные реакции в растворах. Модуль 2 Тема 1 Энергетические эффекты химических реакций. Термохимические законы. |
|
Энтропия. Энергия Гиббса Тема 2. Скорость хим. реакций в гомогенных системах. Ее зависимость от различных параметров. Равновесие химических реакций. Константа равновесия. Смещение химического равновесия |
|
Модуль 3 Тема 3. Растворы электролитов и неэлектролитов. Обменные реакции в растворах электролитов. Гидролиз солей |
|
Модуль 4 Тема 4. Строение атома. Периодический закон периодическая система элементов. Тема 5. Химическая связь. Метод валентных связей. Характеристики ковалентной связи. Ионная связь. |
|
Модуль 5 Тема 6. Электрохимические системы. Гальванические элементы Электролиз растворов и расплавов солей. Законы Фарадея Химическая и электрохимическая коррозия |
|
Тема 7. Основные классы органических соединен й. Полимеры и олигомеры. |
Самостоятельно студенты изучают следующие вопросы:
Модуль 1 Реакции получения оксидов, кислот, солей, оснований. Амфотерность.
Модуль 2 Тема 1: I и II закон термодинамики. Следствия из закона Гесса (1 и 2).
Тема 2: Фазовые равновесия. Константа равновесия и её связь с термодинамическими функциями. Порядок химической реакции.
Модуль 3 Тема 3: Способы выражения концентрации растворов. Ионное произведение воды, водородный показатель рН. Коллигативные свойства растворов (осмос, закон Рауля).
Модуль 4 Тема 4: Значение периодического закона Д.И.Менделеева.
Тема 5: Водородная связь. Металлическая связь..
Модуль 5 Тема 6: Практическое применение электролиза. Гальванопластика. Гальваностегия. Нанесение металлических покрытий. Кинетика коррозионных процессов.
Тема 7: Пластмассы. Основные полимерные материалы и их применение в машиностроении.
2. Литература и учебно-методические материалы
Глинка Н.Л. Общая химия.– М: Интеграл-Пресс, 2000. -727с. -605 экз.
Коровин и др. Общая химия.– М.: Высшая школа, 1998.-559с. -53 экз.
Глинка Н. Л. Задачи и упражнения по общей химии.– М.: Интеграл-Пресс, 2002. -240с.-206 экз.
Основы аналитической химии. пол.ред.Ю.А.Золотова. –Т.1.М.:Высшая школа. -2002. -352с. -80 экз.
5. Основы аналитической химии. пол.ред.Ю.А.Золотова. –Т.2.М.:Высшая школа. -2002. -364с. -80 экз.
Перечень методических указаний находится на кафедре «Общая химия».
