
Фотосинтез
.pdf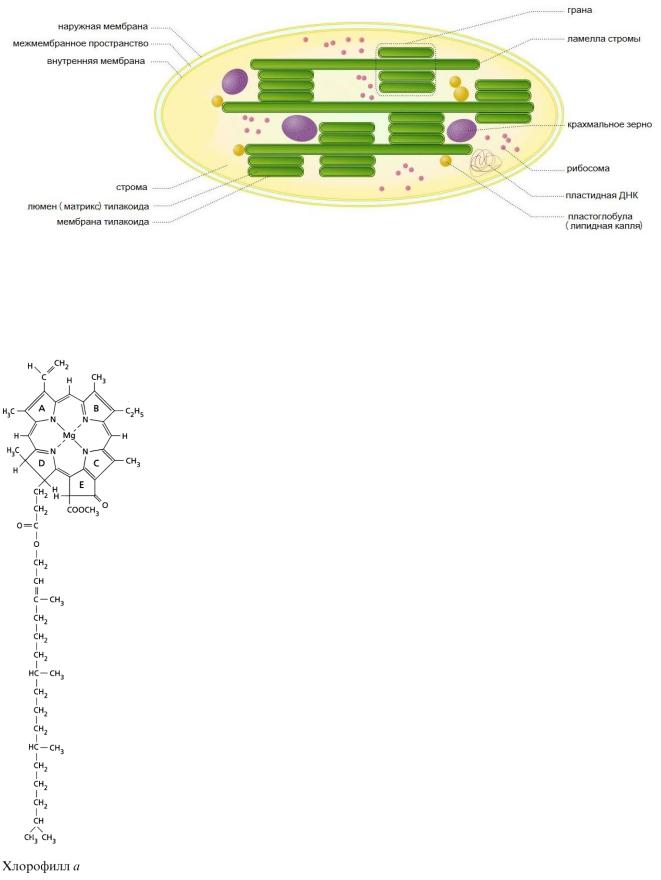
Использованы материалы: Медведев С.С. Физиология растений: учебник. СПб: БХВ-Петербург, 2013 – 512 с.
Фотосинтез – процесс, в котором растения на солнечном свету синтезируют органические соединения из неорганических путем трансформирования энергии солнечного света в энергию химических связей органических соединений.
Хлоропласты отличаются наличием сложно организованной системы внутренних мембран, что позволяет упорядочить компоненты реакционного центра, пространственно разделить восстановленные и окисленные продукты фотосинтеза и отделить фотофизические процессы, протекающие с разными скоростями. Во внутренних мембранах обоих типов тилакоидов локализованы фотосинтетические пигменты, компоненты электронтранспортной цепи и синтеза АТФ.
Пигменты хлоропластов. В пластидах высших растений и водорослей встречаются пигменты трех основных классов - хлорофиллы, каротиноиды и фикобилины. Хлорофиллы и каротиноиды нерастворимы в воде, фикобилины - растворимы. Хлорофиллы и каротиноиды связаны с соответствующими белками с помощью ионных, гидрофобных и координационных связей. Фикобилины связаны с белками (апопротеинами) ковалентно и образуют фикобилипротеины. Пигмент-белковые комплексы обеспечивают упорядоченную ориентацию хромофорных групп и повышают эффективность их функционирования.
Хлорофиллы нерастворимы в воде, но хорошо растворимы в органических растворителях. У высших растений и водорослей обнаружены хлорофиллы a, b, c, d. Только хлорофилл a и бактериохлорофилл a приспособлены не только для поглощения, но также и для преобразования энергии света. Все остальные пигменты участвуют только в процессах поглощении и миграции энергии.
Молекула хлорофилла состоит из порфириновой "головки" и фитольного "хво-
ста". При этом порфириновая часть молекулы находится на поверхности мембраны тилакоида и связана с белками, а жирорастворимая фитольная цепь погружена в липидный слой. Хлорофилл представляет собой сложный эфир дикарбоновой кислоты хлорофиллина, у которой одна карбоксильная группа этерифицирована остатком метилового спирта, а вторая — остатком спирта фитола.
При разрыве сложноэфирной связи и отщеплении фитола образуется соединение, называемое хлорофиллидом. Четыре пиррольных кольца (A–D) соединены между собой метиновыми мостиками, формируя порфириновое ядро. Атомы азота пиррольных колец соединяются двумя координационными связями с атомом Mg. В структуре порфиринового ядра имеется также циклопентановое кольцо (E). Если в молекуле хлорофилла атом Mg замещен на два атома водорода, образуется соединение бурооливкового цвета — феофитин, выполняющий функции первичного акцептора электронов в фотосистеме II.
В порфириновом ядре молекулы хлорофилла имеет место чередование одинарных и двойных связей, что является причиной появления вокруг него делокализованных -электронов, легко переходящих в возбужденное состояние при попадании квантов света видимой части спектра. Именно эта система из 18 сопряженных двойных связей выполняет функции основного хромофора и отвечает за избирательное поглощение энергии света.
Биосинтез молекулы хлорофилла представляет собой сложный процесс, включающий более чем 10 реакций. Синтез хлорофилла начинается с глутаминовой кислоты, которая превращается в 5-аминолевулиновую кислоту. Далее две молекулы последней конденсируются и образуют порфобилиноген. Затем четыре молекулы порфобилиногена связываются и формируют протопорфирин IX. После этого происходит встраивание магния и светозависимое формирование кольца Е; образующееся при этом соединение называют моновинилпротохлорофиллидом а. На заключительной стадии синтеза происходит восстановление кольца D (хлорофиллид а) и присоединение фитола (хлорофилл а).
2
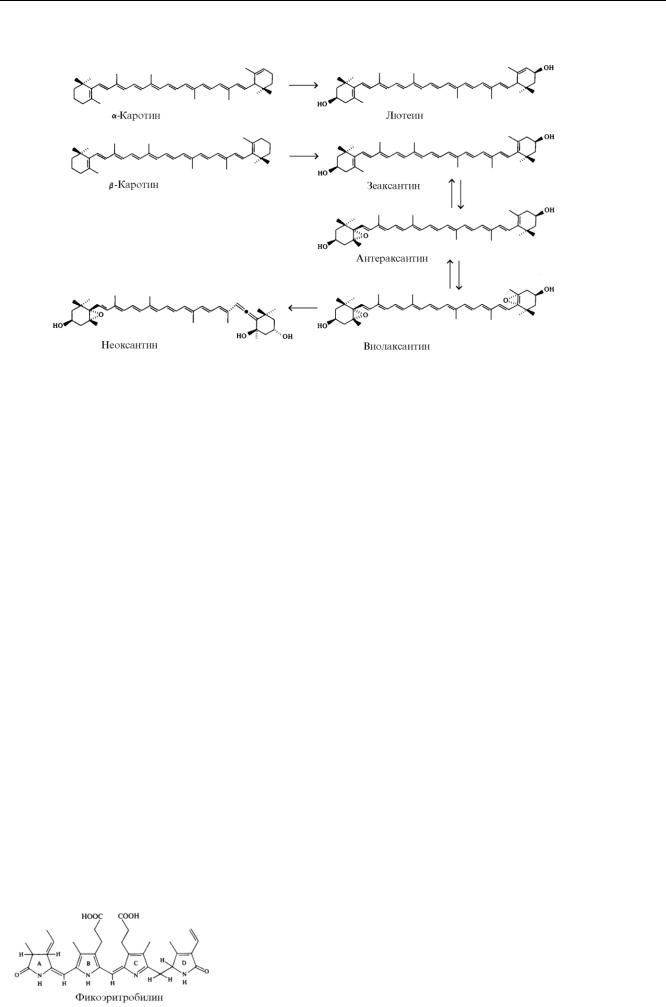
Каротиноиды - желтые, оранжевые или красные пигменты, найденные во всех фотосинтезирующих клетках растений. Каротиноиды образуют 40-углеродную цепь, построенную из 8 остатков изопрена, которая у большинства из них замыкается в два иононовых кольца.
Функции хромофора выполняет центральная часть молекулы, состоящая из 18 атомов углерода и формирующая систему сопряженных двойных связей. Спектр поглощения каротиноидов характеризуются наличием полос в области от 400 до 500 нм. Каротиноиды нековалентно связаны с белками и липидами внутри тилакоидной мембраны. Выявлено более 600 модификаций молекулярной структуры каротиноидов, различающихся по числу двойных связей, пространственной конфигурации, содержанию кислорода. Пространственные стереоизомеры (цис и транс) каротиноидов существенно различаются по физико-химическим свойствам и выполняют различные функции. По содержанию кислорода каротиноиды делят на два класса: каротины (С40Н56) — пигменты, не содержащие кислорода ( -, - и -каротины) и ксантофиллы — пигменты, которые содержат кислород. Среди ксантофиллов выделяют гидроксильные производные С40Н54(ОН)2 — лютеин и зеаксантин и эпоксидные производные, например виолаксантин и неоксантин (С40Н54О4), которые содержат и гидроксильные, и эпоксидные группы. Наиболее распространенными каротиноидами растений являются -каротин и ксантофиллы: лютеин, виолаксантин и неоксантин. На ярком свету в хлоропластах накапливаются антероксантин и зеаксантин. Интересно отметить, что витамин А представляет собой половину молекулы -каротина.
Выделяют три основные функции каротиноидов в процессе фотосинтеза: антенная, антиоксидантная и фотопротекторная. Антенная функция проявляется в светособирающих комплексах и обусловлена возможностью каротиноидов под действием света переходить в синглетное возбужденное состояние. Затем энергия возбуждения каротиноидов резонансным путем передается на близлежащую молекулу хлорофилла. Обязательным условием для передачи энергии от возбужденных светом каротиноидов на хлорофилл является частичное перекрывание электронных облаков молекул пигментов. Это достигается близким расположением хлорофиллов и каротиноидов в светособирающем комплексе. Каротиноиды способны играть роль дополнительных светособирающих пигментов в той части солнечного спектра (450-570 нм), где слабо поглощают хлорофиллы. Функции таких дополнительных пигментов выполняют виолаксантин, лютеин и неоксантин. Антиоксидантная функция заключается в том, что каротиноиды способны тушить триплетное состояние хлорофилла и синглетный кислород, которые возникают при избытке света. При этом энергия возбуждения триплетного хлорофилла и синглетного кислорода резонансным путем передается на каротиноиды, а затем рассеивается в виде тепла.
|
|
|
|
Каротиноиды также защищают фотосинтетический аппарат |
|
виолаксантин |
|
от фотоокисления на слишком ярком свету. Переключение функ- |
|
|
|
|
|
|
|
|
|
ций каротиноидов с аккумулирования энергии света на ее рассеи- |
|
(избыток света) |
|
|
||
антераксантин |
(слабый свет) |
вание происходит в виолаксантиновом (ксантофилловом) цикле. |
||
|
|
|
|
|
|
|
На сильном свету виолаксантин превращается вначале в антерак- |
||
|
зеаксантин |
|
||
|
|
сантин, а затем в зеаксантин, который способен рассеивать изли- |
||
|
|
|
|
|
шек световой энергии в форме тепла.
Фикобилипротеины. Цианобактерии (Cyanobacteria), красные морские водоросли (Rhodophyceae) и криптофиты (Cryptophyceae) содержат группу пигментов, называемых фикобилипротеинами. Выявлено более 10 типов фикобилипротеинов — фикоэритробилины, фикоцианобилины, аллофикоцианобилины, фикоэритроцианобилины и др. Они представляют собой тетрапиррольные структуры с открытой цепью, имеющие систему конъюгированных двойных связей. Фикобилипротеины имеют максимум поглощения в желто-зеленой области спектра (500—650 нм) и являются вспомогательными фотосинтетическими пигментами
3
Суммарное уравнение фотосинтеза:
6CO |
|
12H |
|
свет |
|
|
|
6H |
|
O 6O |
|
2 |
2 |
O C H O |
2 |
2 |
|||||||
|
|
хлоропласты |
6 |
12 |
6 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Фотосинтез представляет собой 2-стадийный процесс, включающий фотохимические (световые) процессы и темновые химические реакции. Темновые реакции могут протекать как в темноте, так и на свету. В ходе световых реакций, локализованных на мембране тилакоида, идет фотоокисление воды, выделяется кислород, синтезируются АТФ и НАДФН:
НАДФ |
НАДФН |
|
|
|
АДФ + Фн |
АТФ |
|
|
|
2Н О |
О |
+ |
+ 4е |
– |
+ 4Н |
|
|||
2 |
2 |
|
|
|
свет, мембрана тилакоида |
|
|
|
|
В темновых реакциях происходит связывание углекислоты и образование углеводов:
4H |
|
|
CO |
|
(CH |
O) H |
O |
|
|
4e |
2 |
||||||
|
|
|
|
строма хлоропластов |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
СВЕТОВЫЕ РЕАКЦИИ ФОТОСИНТЕЗА. Световая стадия фотосинтеза состоит из трех этапов и включает фотофизические и фотохимические процессы. На первом фотофизическом этапе энергия света поглощается, переходит в энергию электронного возбуждения пигментов и передается в реакционный центр фотосистем. Эти процессы протекают со скоростью 10-12- 10-9 с и локализованы в светособирающих антенных комплексах.
На втором фотохимическом этапе энергия электронного возбуждения пигментов используется для разделения зарядов в реакционном центре фотосистем. В фотосистеме II, например, электроны с высоким энергетическим потенциалом от возбужденных пигментов (П*680) передаются на первичный акцептор феофитин. Пигменты при этом приходят в окисленное состояние ((П+680) и приобретают способность "отнимать" электроны у белков кислород-выделяющего комплекса. Именно в этом процессе происходит преобразование физической формы энергии в химическую.
На третьем этапе образуется НАДФН (сильный восстановитель), синтезируется АТФ, а при фотоокислении воды как побочный продукт выделяется О2. Образование НАДФН, АТФ и О2 происходит в электронтранспортной цепи при переносе электронов по цепи переносчиков. При этом каждый переносчик поочередно присоединяет электрон (восстанавливается) и отдает электрон (окисляется), что сопровождается высвобождением или поглощением энергии и (на некоторых участках) - переносом протона.
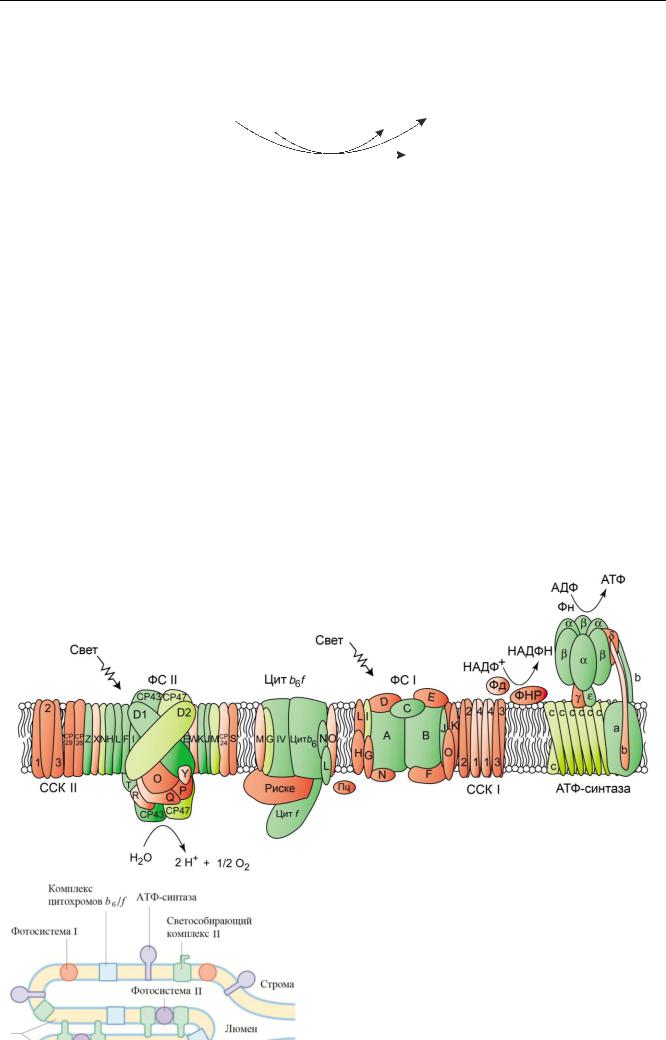
Бóльшая часть фотосинтетических пигментов тилакоидных мембран находится в форме пигмент-белковых комплексов, образуя так называемые фотосинтетические единицы (ФСЕ). Фотосинтетическая единица включает антенный (светособирающий) комплекс, функционально сопряженный с реакционным центром.
В мембранах тилакоидов выявлено пять типов интегральных белковых комплексов: 1) светособирающий комплекс II (ССК II), 2) фотосистема II (ФС II), 3) комплекс цитохромов b6/f, 4) фотосистема I (ФС I), 5) светособирающий комплекс I (ССК I). Обозначения: Пц - пластоцианин, Фд - ферредоксин, ФНР - ферредоксин-НАДФН редуктаза.
Белковые комплексы имеют строго определенную локализацию и асимметричную ориентацию в мембранах тилакоидов. ФС I и комплекс АТФ-синтазы находится в тилакоидах стромы, а также в боковых и концевых областях гран. ФС II - в области плотного контакта тилакоидов. Цитохромный комплекс равномерно распределен внутри тилакоидов. Фотоокисление воды происходит внутри тилакоидов, восстановление НАДФ+ до НАДФН — в строме хлоропласта, синтез АТФ – в полости тилакоида.
4
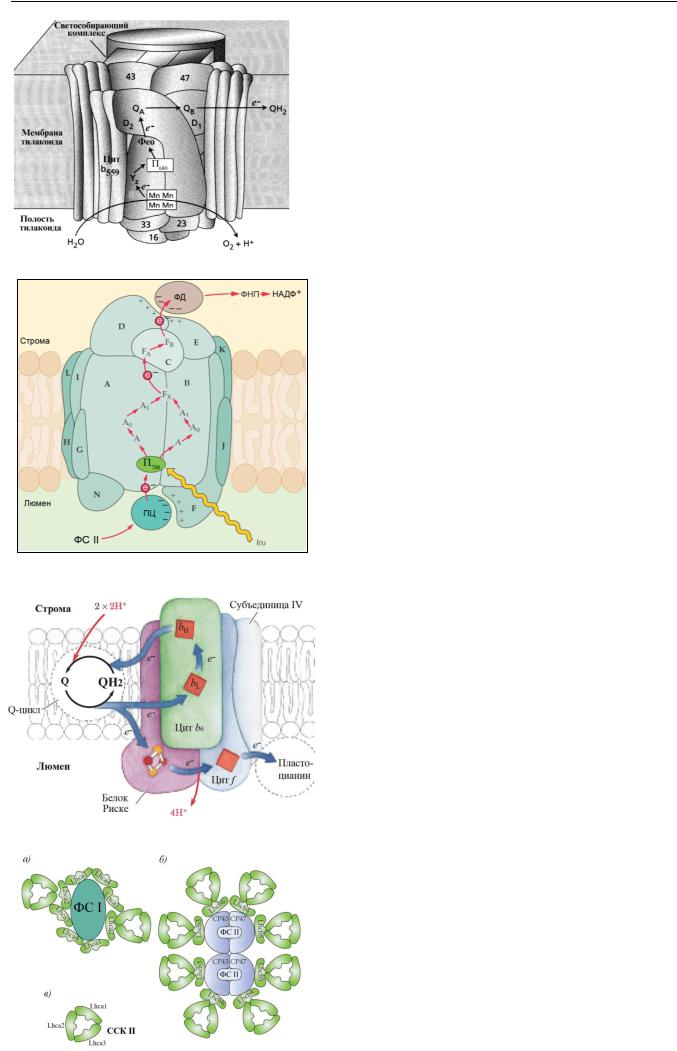
Фотосистема II. Реакционный центр фотосистемы II включает первичный донор электронов — димер Хл а с максимумом поглощения 680 нм (П680); два первичных акцептора электронов феофитина а (Phe); вторичные акцепторы — молекулы пластохинона (QA и QB). Ядро реакционного центра фотосистемы II составляют два мембранных белка - D1 и D2. Оба этих белка служат основой для связывания групп реакционного центра, выполняющих функции переносчиков электронов. Другие белки формируют внутренний светособирающий комплекс (43 и 47 кДа), участвуют в выделении кислорода при фотоокислении воды (33, 23 и 16 кДа) или выполняют иные функции. В кисло- род-выделяющий центр входят Mn-содержащий кластер и, как кофакторы - кальций и хлор. Посредником между кислородвыделяющим центром и хлорофиллом П680 является остаток аминокислоты тирозина (YZ) белка D1.
Фотосистема I представляет собой пигмент-белковый комплекс молекулярной массой около 340 кДа, состоящий из 13 белков. В структуре комплекса выделяют центральную часть из двух крупных белков (А и В) и два периферийных домена — со стороны стромы (белки C, D и E) и стороны люмена (белки F и N) .
Белки А, В и С включают первичный донор электронов — димер хлорофиллов а с максимумом поглощения 700 нм (П700); дополнительный хлорофилл а (А); мономер хлорофилла а (А0); вторичный акцептор витамин филлохинон (А1); терминальные акцепторы белки, содержащие железосерные
(Fe4S4) кластеры (FX, FA, FB).
От терминальных акцепторов электроны поступают на водорастворимый железосерный (Fe2S2) белок ферредоксин (ФД), а затем на растворимый флавопротеин — ферредоксин- НАДФ-редуктазу (ФНП). Двойной набор дополнительных хлорофиллов (А), первичных акцепторов (А0) и филлохинонов (А1) формируют две практически симметричные ветви транспорта электронов от П700 к FX.
Комплекс цитохромов состоит из цитохрома b6 (цит b6), цитохрома f (цит f), железосерного белка Риске (Fe2S2)R
и субъединицы IV.
Q — пластохинон, QH2 — пластохинол, bL и bH — низкопотенциальный (L) и высокопотенциальный (H) гемы цитохрома b6
Основная часть молекулы цитохрома f расположена в полости тилакоида, в то время как ее С-концевой участок находится на его поверхности. Цитохрома b6 состоит из 2- х гемов: низкопотенциальный bL и высокопотенцальный bH , ковалентно связанных с остатками гистидина.
От комплекса цитохромов b6/f электроны передаются на пластоцианин (Пц) — водорастворимый белок, содержащий два атома меди, который восстанавливает окисленную форму хлорофилла П700.
Антенные светособирающие комплексы. В хлоропластах пигменты организованы в светособирающие комплексы (ССК), в которых осуществляется процесс "сбора" и переноса энергии от антенн на особый тип молекул хлорофилла, входящих в состав реакционного центра и являющихся ловушкой энергии возбуждения. Один реакционный центр могут обслуживать десятки и сотни молекул пигментов, которые поглощают свет и передают энергию возбужденного состояния. Роль светособирающих комплексов у эукариот хлорофиллы а и b, а также связанные с белками каротиноиды; у цианобактерий и красных водорослей - фикобилисомы, в состав которых входят фикобилипротеины.
Выделено 4 типа ССК растений. Два из них локализованы в реакционных центрах и связывают только молекулы хлорофилла а и -каротина (внутренние антенны ФС II и I).

5
Два других выполняют функции внешних светособирающих антенн и связывают хлорофиллы а и b, -каротин и ксантофиллы (лютеин, неоксантин, зеаксантин, антераксантин и виолаксантин).
На рисунке показаны антенные комплексы: фотосистемы I (рис., а); фотосистемы II (рис., б и в). Внутренняя антенна ФС II (рис., б) организована на пигмент-содержащих белках СР43 и СР47, которые связывают около 30 молекул хлорофилла а и 2-3 молекулы -каротина (рис., в). В состав внешней антенны ФС II входят шесть типов пигмент-связывающих белков Lhcа1-6 (light-harvesting complex). Каждый мономер ССК II содержит 14 молекул хлорофиллов и 4 молекулы каротиноидов (две молекулы лютеина, одну молекулу неоксантина и одну молекулу виолаксантина).
Всостав внутренней антенны ФС I (рис., а) входят около 90 молекул хлорофилла а и 22 молекулы - каротина. Внешняя антенна ФС I содержит четыре типа пигмент-связывающих белков — Lhcа1-4 и включает 80120 молекул хлорофиллов а и b и каротиноиды.
Вантенных комплексах энергия передается от каротиноидов к хлорофиллам b, далее к хлорофиллам а и,
наконец, в реакционный центр к димерам хлорофиллов а П680 или П700, служащим ловушками энергии возбуждения "светособирающих" пигментов. При возбуждении пигменты переходят в синглетные состояния. В реакционных центрах энергия возбуждения фотосинтетических пигментов используется для разделения зарядов.
Разделение зарядов в фотосистемах. Время жизни возбужденных электронов хлорофиллов составляет около 5 нс. За это время энергия возбужденного состояния молекулы либо переходит в тепло, либо испускается в виде кванта флуоресценции. Для того чтобы эта энергия могла использоваться, скорость передачи энергии возбуждения должна быть больше, чем испускание квантов флуоресценции. Поэтому время передачи энергии в реак-
ционных центрах фотосистем составляет 3-5 пикосекунд. Образующаяся при этом окисленная форма хлорофилла П+680 приобретает способность "отнимать" электроны у белков кислород-выделяющего комплекса, а те, в свою очередь, — у воды.
Разделение зарядов в реакционном центре фотосистемы II условно можно разделить на три этапа (см. строение ФС II). На первом этапе под действием света происходит возбуждение молекулы хлорофилла (П*680). На втором этапе электрон передается первичному акцептору феофитину (за 3 пс). При этом хлорофилл переходит в
окисленную форму (П+680), а феофитин восстанавливается (феофитин–). Появление неспаренного электрона в молекуле хлорофилла (П+680) инициирует переход на нее (за 20-260 нс) электрона от кислород-выделяющего центра. Посредником между Mn-кластером кислород-выделяющего центра и П+680 служит редокс-активный остаток тиро-
зина (
YZ
) белка D1. На заключительном этапе электрон от восстановленной формы феофетина– поступает на
первичный хинон QA.Fe2+ (за 200 пс), а затем на вторичный хинон QB (за 100 мкс). После этого электроны уже выходят за пределы реакционного центра фотосистемы II и идут на восстановление липидорастворимого пула пластохинонов (1 мс).
Процесс первичного разделения зарядов в ФС I происходит аналогичным путем (см. строение ФС I). От возбужденного под действием света П*700 электроны вначале переносятся (за 3 пс) на первичный акцептор хлорофилл А0, затем (за 40-200 пс) на вторичный акцептор филлохинон (А1) и на белок FX (за 15-200 нс). Дефицит электронов у окисленного П+700 восполняется за счет их поступления из фотосистемы II через медь-содержащий белок — пластоцианин (за 200 мкс). Затем электроны от белков, содержащих железосерные кластеры FA/FB ФС I, переносятся на ферредоксин (за 15-200 нс). Перенос электрона по фотосинтетической цепи приводит к восстановлению переносчиков и к появлению конечных продуктов — АТФ и НАДФН, которые вступают в ферментативные реакции, средняя скорость которых находится в миллисекундном диапазоне(10-3 с).
Под вторичным разделением зарядов понимают процесс генерации на мембране тилакоида градиента протонов. Следует подчеркнуть, что электрохимический градиент ионов водорода, формируемый в процессе разделения зарядов на тилакоидной мембране, представляет собой уже электрическую форму энергии, которая c помощью АТФ-синтазы может быть трансформирована в химическую энергию макроэргической связи АТФ.
Фотоокисление (фотолиз) воды. Центр фотолиза воды находится внутри тилакоида. В основе механизма этого процесса лежит гипотеза Кока, согласно которой происходит одновременное окисление двух молекул воды без образования промежуточных продуктов:
2H |
2 |
O 4e |
|
4H |
|
O |
2 |
|
|
||||||
|
|
|
|
|
|
В центр фотолиза входят белок D1, который содержит марганец (Mn), остаток аминокислоты тирозина (YZ) и в качестве кофакторов кальций и хлор. Центр может находиться в пяти функциональных состояниях (S0 -S4) в зависимости от уровня окисления Mn. Переход между состояниями (т.н."S-цикл") происходит при попадании кванта света на реакционный центр ФС II и изъятии одного электрона у возбужденного хлорофилла
П680 с помощью YZ.
Выделение О2 из 2Н2О происходит только при переходе из S3 в S4. Надо отметить, что в S-цикле происходит также выделение 4-х протонов (Н+) .
Z-схема фотосинтеза представляет собой последовательность переноса электронов в электронтранспортной цепи (ЭТЦ) мембраны тилакоида. Сплошными стрелками отмечен нециклический перенос электронов по цепи. При нециклическом транспорте электрона синтез АТФ сопряжен с образованием НАДФН и выделе-
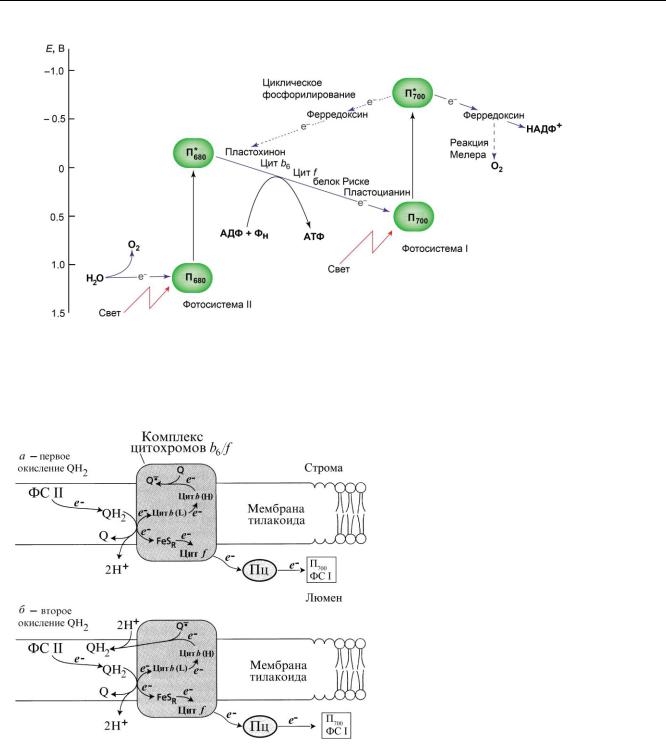
6
нием О2. Пунктирными стрелками показан циклический путь электронов в ФС I и реакция Мелера. В случае циклического переноса электрона в качестве единственного продукта образуется АТФ.
Нециклический перенос электронов. Липидорастворимые пластохиноны, работают как "двухэлектронные ворота", поскольку в ходе окисления пластохинола (QH2) один из двух электронов по линейной цепи направляется в фотосистему I, а второй электрон поступает в цикл цитохромов b6/f. В цитохроме b6 имеются два отдельных сайта для связывания восстановленной (QH2) и окисленной (Q) форм пластохинона. В процессе транспорта электронов в комплексе цитохромов b6/f происходит формирование пластосемихинона (Q- ) и последующее его восстанов-
ление до пластохинола.
На первом этапе (а) после окисления пластохинола (QH2), один из электронов передается на белок Риске (FeSR) и далее на цитохром f, пластоцианин (Пц) и хлорофилл П700. Второй электрон идет на низкопотенциальный (L) гем цитохрома b6. От восстановленного гема L электроны поступают на высокопотенциальный гем (H) цитохрома b6 и далее на пластохинон (Q), который восстанавливается в пластосемихинон (Q- ). В итоге 2 протона выкачиваются внутрь тилакоида. На втором этапе (б) происходит окисление еще одной молекулы пластохинола (QH2). Один из электронов как и в первом этапе идет по линейной цепи в ФС I. Второй электрон поступает на образованный в первом этапе пластосемихинон (Q- ) и восстанавливает его до пластохинола (QH2), при этом происходит связывание еще двух протонов из стромы. Таким образом, на каждые 2 электрона, поставляемые в ФС I, через тилакоидную мембрану переносится 4 протона. Формируемый на тилакоидной мембране гради-
ент протонов далее используется на синтез АТФ.
Циклический перенос электронов в ФС II является защитным механизмом, который включается, когда ЭТЦ тилакоидов не справляется с утилизацией световой энергии или при повреждении системы фотолиза воды. Он связан с транспортом электронов от восстановленных пластохинонов (QA и QB) обратно в реакционный центр к окисленному пигменту П680. В этом процессе участвуют цитохром b559, β-каротин и сопровождающие молекулы хлорофиллов (Хл Z и Хл D).
В циклическом переносе электронов в ФС I участвуют комплекс цитохромов b6/f и пул пластохинонов. Электроны от восстановленного ферредоксина идут не на восстановление НАДФ+, а переносятся на пластохиноны (с помощью фермента ферредоксин-хиноноксидоредуктазы), далее на комплекс цитохромов b6/f, а затем к окисленному П+700. Результатом является создание протонного градиента. Циклический поток электронов может быть альтернативным путем использования энергии при избытке света.
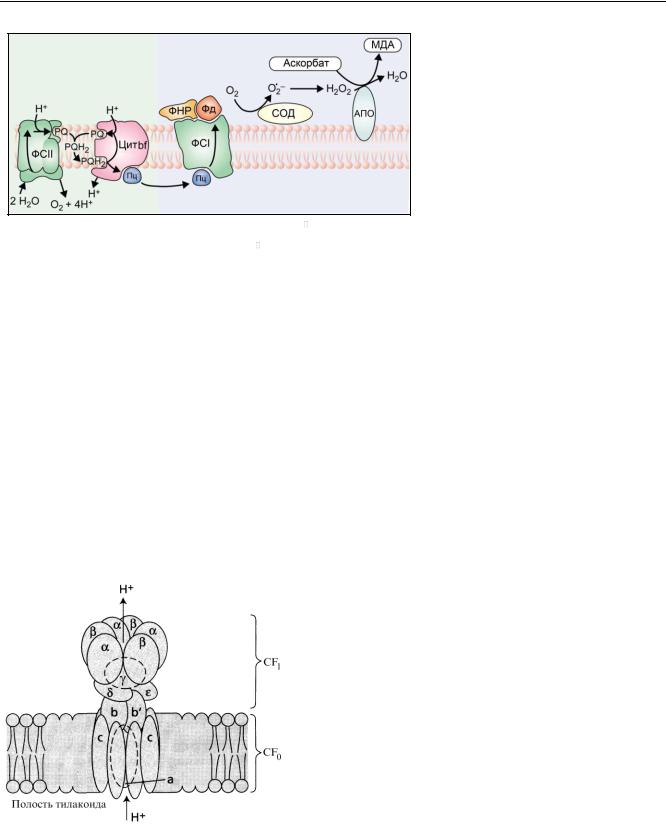
7
Реакция Мелера (цикл вода-вода). Электроны от восстановленного ферредоксина или железосерных кластеров белков FA и FB идут не на восстановление НАДФ+, а переносятся на кислород с образованием воды.
Q — пластохинон, QH2 — пластохинол, Цит bf — комплекс цитохромов b6/f,
Пц — пластоцианин, ФНР — ферредок- син-НАДФН редуктаза, Фд — ферредоксин, СОД — Cu-Zn-супероксидисмутаза, МДА — монодегидроаскорбат, АПО — аскорбатпероксидаза
Этот процесс идет в несколько этапов:
1)O2 e O2
2)2O2 2H H2O2
3)H2O2 2аскорбат H2O 2монодегидроаскорбат
Вторую и третью реакции катализируют, соответственно, Cu-Zn-супероксиддисмутаза и аскорбатпероксидаза. Поэтому этот процесс иногда называют (аскорбат)пероксидазный путь Мелера. Образующиеся активные формы кислорода могут повреждать фотосинтетический аппарат. С помощью этого пути может происходить регуляция содержание окисленного НАДФ+ и НАДФН. При достаточном количестве НАДФ+ практически весь поток электронов идет на его восстановление до НАДФН. При дефиците НАДФ+ происходит переключение потока электронов на кислород и запуск реакции Мелера.
Фотофосфорилирование. В ЭТЦ имеются два участка, на которых процесс переноса электронов сопровождается транспортом протонв (Н+) внутрь тилакоидов. Один из них связан с фотоокислением воды, другой — с окислением молекулы пластохинола комплексом цитохромов b6/f . Энергия, выделяющаяся при окислении, транс-
формируется в электрохимический градиент |
H |
|
на мембране тилакоида. Дальнейшие энергетические превраще- |
|
ния осуществляются АТФ-синтазным комплексом, который осуществляет трансформацию электрохимического градиента протонов в энергию макроэргической связи АТФ.
Хемиосмотический механизм синтеза АТФ. Механизм фосфорилирования АДФ, сопряженный с работой электрон-транспортной цепи на сопрягающих мембранах, объясняет хемиосмотическая теория. Он ввел понятие сопрягающей мембраны, т.е. мембраны, на которой процесс транспорта протонов сопряжен с процессом синтеза АТФ. Сущность теории Митчелла можно свести к двум положениям: во-первых, электрон-транспортная цепь функционирует таким образом, что на мембране возникает электрохимический градиент протонов, а во-вторых, обратный ток протонов через протонный канал сопровождается образованием энергии фосфатной связи АТФ.
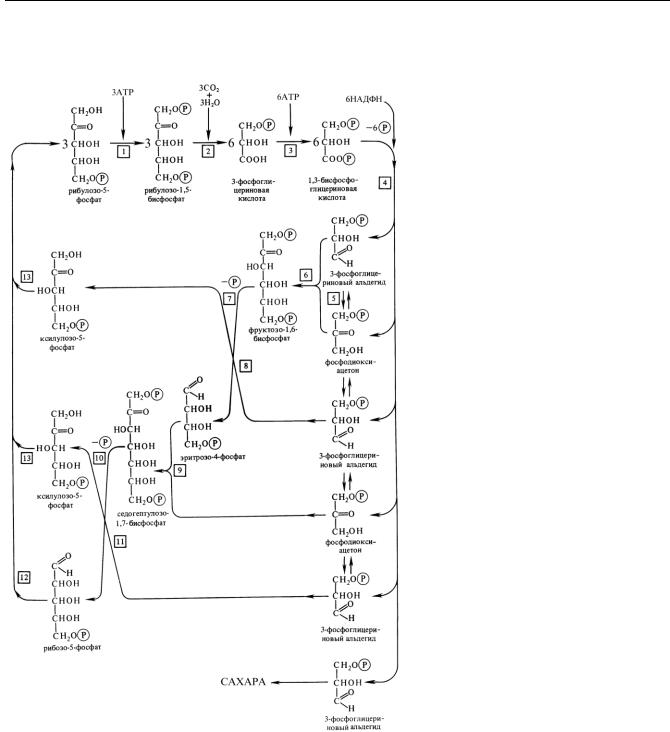
АТФ-синтазный комплекс. Синтез АТФ при фосфорилировании осуществляет АТФ-синтаза (АТФаза). Этот фермент молекулярной массой около 400 кДа состоит из 2 крупных частей: гидрофобной, расположенной в тилакоидной мембране (CF0), и гидрофильной, находящейся в строме (CF1). Протоны проходят через канал, формируемый белками, входящими в состав CF0, затем попадают в комплекс белков CF1, где процесс транспорта Н+ сопрягается с процессом фосфорилирования АДФ и образования АТФ. В CF1-комплекс входит 5 типов полипептидов: (три), (три), (один), (один) и (один). Каталитический центр располагается на -субъединицах. Другие пептиды выполняют обслуживающие функции. В CF0-комплекс входит 4 типа пептидов (a, b, b' и с12), которые формируют протонный канал. Предполагается, что в ходе катализа происходит вращение большей части CF1-комплекса на -субъединице. - субъединица при этом работает как стержень-эксцентрик, который попеременно вращается то против -, то против - субъединиц. Энергия конформационных изменений трансфор-
мируется в энергию фосфатной связи АТФ в три этапа. На первом этапе происходит присоединение АДФ и ФН к активному центру фермента без затраты энергии. На втором этапе ионы Н+, перемещаясь по протонному каналу по градиенту электрохимического потенциала, вызывают конформационные изменения фермента, в результате чего из АДФ и ФН синтезируется АТФ. В течение третьего этапа за счет энергии, выделяющейся при транспорте протонов, происходит высвобождение АТФ и возврат АТФ-синтазного комплекса в исходное состояние.
8
ТЕМНОВЫЕ РЕАКЦИИ ФОТОСИНТЕЗА. Продуктами описанных выше световых реакций фотосинтеза являются АТФ и НАДФН. Далее происходят темновые процессы фиксации СО2, в которых используется "ассимиляционная сила" молекул АТФ и НАДФН. Первичным продуктом при фиксации СО2 при фотосинтезе является ФГК. Поэтому такой способ связывания углекислоты называют С3-путь фотосинтеза. Этот процесс также называют циклом Кальвина (или циклом Кальвина—Бенсона—Бассэма).
Ферменты цикла Кальвина:
1 — рибулозо-5-фосфаткиназа;
2 — рибулозо-1,5- бисфосфаткарбоксилаза/оксигеназа (Рубиско); 3 — фосфоглицераткиназа; 4 — НАДФ-глицеральдегид-3- фосфатдегидрогеназа; 5 — триозофосфатизомераза; 6 — альдолаза;
7 — фруктозо-1,6-бисфосфатфосфатаза;
8 — транскетолаза;
9 — альдолаза;
10 — седогептулозо-1,7-бисфосфатфосфатаза;
11 — транскетолаза;
12 — рибозо-5-фосфатизомераза;
13 — рибулозо-5-фосфатэпимераза
Процессы, осуществляющие фиксацию СО2 и синтез углеводов, условно делят на 4 стадии.
Стадия карбоксилирования. На этой ста-
дии происходит присоединение |
CO2 |
к дие- |
нольной форме рибулозобисфосфата (РуБФ) и образование двух молекул фосфоглицериновой кислоты (ФГК). Эта реакция катализируется ферментом Рубиско. Рубиско является наиболее распространенным ферментом в биосфере (около 2 кг на каждого жителя Земли).
Стадия восстановления ФГК. На этой стадии 3-фосфоглицериновая кислота восстанавливается до 3-фосфоглицеринового альдегида. Процесс идет в два этапа. Вначале от молекулы АТФ на 3-ФГК переносится еще одна фосфатная группа и образуется 1,3-дифосфоглицериновая кислота (1,3- ФГК). На втором этапе происходит восстановление 1,3-ФГК в 3-фосфоглицериновый альдегид (3-ФГА) за счет НАДФН. Восстановление 1,3-ФГК до 3-ФГА — единственный восстановительный процесс цикла Кальвина, в котором используется НАДФН, образуемый в световых реакциях фотосин-
теза. Последующие процессы цикла Кальвина необходимы для того, чтобы регенерировать потраченный на стадии карбоксилирования рибулозо-1,5-бисфосфат, который является первичным акцептором СО2.
Стадия регенерации рибулозо-1,5-бисфосфата (РуБФ). Основной итог этой стадии состоит в том, что 5
молекул триозофосфата ФГА (что соответствует 15 атомам углерода) подвергаются перегруппировке, в результате которой образуются три молекулы 5-углеродного сахара — 1,5-рибулозобисфосфата. Этот процесс происходит в результате альдолазных и транскетолазных реакций с участием фосфатов трех-, четырех-, пяти-, шести- и семиуглеродных сахаров. В результате из 5 молекул 3-углеродных сахаров образуются 3 молекулы 5-углеродных сахаров, которые затем превращаются в РуБФ.
Стадия синтеза углеводных продуктов фотосинтеза. Вовлечение шести молекул СО2 в цикл Кальвина приводит к образованию шести молекул ФГА, из которых пять молекул используются для регенерации РуБФ, а одна покидает цикл и используется на синтез углеводных продуктов фотосинтеза. На этом этапе из фосфоглицеринового альдегида и фосфодиоксиацетона под действием альдолазы синтезируется фруктозо-1,6-дифосфат, который затем может превращаться в сахарозу или крахмал. Можно подсчитать, что для синтеза 1 молекулы глюкозы в цикле Кальвина необходимо 12 молекул НАДФН и 18 молекул АТФ.
Система регуляции цикла Кальвина включает генетический, метаболический и энергетический уровни. Важнейшим фактором регуляции цикла является транспорт метаболитов из хлоропластов. Необратимыми в цикле Кальвина являются следующие процессы: реакция карбоксилирования, две реакции, связанные с работой фосфатаз, а также работа фосфорибулозокиназы. Пять ферментов Кальвина активируются светом — Рубиско, триозофосфатдегидрогеназа, фруктозобисфосфатаза, седогептулозобисфосфатаза и фосфорибулозокиназа.
9
С4-путь фотосинтеза. Листья таких растений, как сахарный тростник, кукуруза, сорго, амарант и др. (более 10 тыс.видов), способны фиксировать СО2 не только в реакциях цикла Кальвина, но и другим путем, в ходе которого появляются С4-кислоты — щавелевоуксусная, яблочная и аспарагиновая. Такой способ связывания углекислоты получил
название С4-путь фотосинтеза.
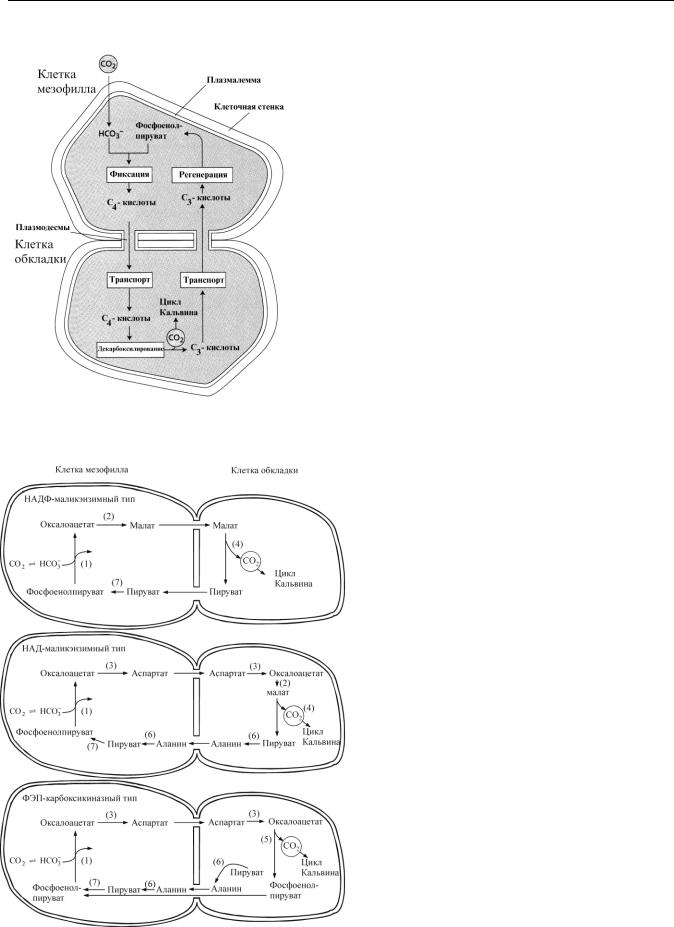
Для листьев С4-растений характерно анатомическое строение кранц-типа (от нем. kranz — венец, корона). Проводящие пучки у таких растений окружены двумя слоями зеленых клеток ассимиляционной паренхимы. Внешний слой образуют клетки мезофилла, а внутренний слой составляют клетки обкладки сосудистого пучка. Оба слоя содержат хлоропласты. При этом хлоропласты мезофилла имеют обычную гранальную структуру, а хлоропласты клеток обкладки не имеют гран и содержат много крахмальных зерен. Вокруг клеток мезофилла расположено множество воздушных полостей, что обеспечивает эффективное поглощение ими углекислоты. Клетки мезофилла и клетки обкладки связаны между собой большим числа плазмодесм.
Фиксация СО2 происходит в клетках мезофилла в результате ее присоединения к фосфоенолпировиноградной кислоте (ФЕП) и образования 4-углеродной щавелевоуксусной кислоты, которая затем превращается в яблочную (малат) или аспарагиновую (аспартат) кислоты.
Необходимо особо отметить, что ФЭП-карбоксилаза, в отличие от Рубиско (которая связывает только СО2 в цикле Кальвина), может ассимилировать НСО-3 в условиях очень низкого парциального давления СО2 и высокого - О2. Затем малат
или аспартат транспортируются в клетки обкладки, где происходит их декарбоксилирование и образование С3- кислот. После этого С3-кислоты возвращаются в клетки мезофилла, а углекислота попадает в цикл Кальвина. С4- путь фотосинтеза иногда сравнивают с углекислотным насосом, поставляющим СО2 в хлоропласты клеток обкладки для цикла Кальвина.
В хлоропластах клеток обкладки очень низка активность фотосистемы II и поэтому не происходит фотолиза воды и выделения кислорода. Это позволяет поддерживать в клетках обкладки высокую концентрацию СО2 и низкую концентрацию О2, что необходимо для работы фермента Рубиско. В хлоропластах клеток обкладки энергия света идет только на синтез АТФ в результате работы фотосистемы I и циклического транспорта электронов. НАДФН, необходимый для синтеза углеводов в цикле Кальвина в хлоропластах обкладки, образуется при окислении маликэнзимом яблочной кислоты, поступающей из клеток мезофилла.
Различают три варианта С4-пути фотосинтеза —
НАДФ-маликэнзимный, НАД-маликэнзимный и ФЕП-карбоксикиназный, которые отличаются по типу С4-кислоты, которая транспортируется в клетки обкладки (аспартат или малат), по типу С3-кислоты, которая возвращается в клетки мезофилла для регенерации (пируват или аланин), и, наконец, по типу декарбоксилирования в клетках обкладки.
Ферменты:
1 — фосфоенолпируваткарбоксилаза;
2 — НАДФ:малатдегидрогеназа;
3 — аспартатаминотрансфераза;
4 — НАД(Ф)-маликэнзим;
5 — фосфоенолпируват-карбоксикиназа;
6 — аланинаминотрансфераза;
7 — пируватортофосфатдикиназа
10
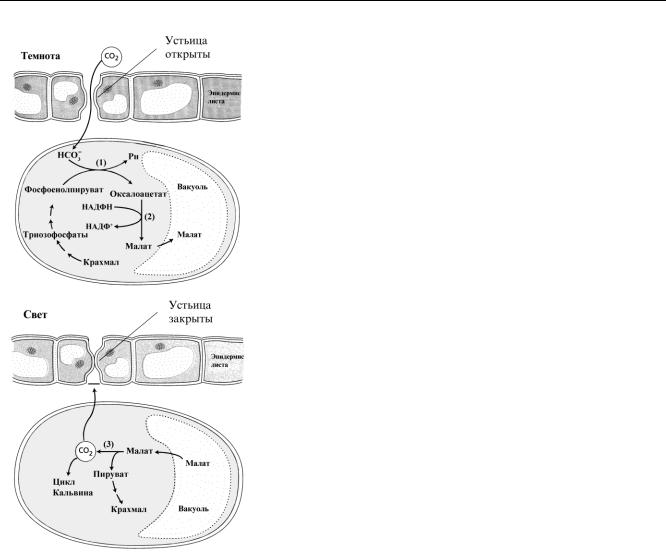
Фотосинтез по типу толстянковых (САМ-метаболизм). Для многих суккулентных растений, обитающих в за-
сушливых и безводных условиях, характерен особый тип С4- фотосинтеза. Реакции связывания СО2 и накопление С4-кислот у них идут ночью. Днем же С4-кислоты декарбоксилируются, а выделяющийся при этом СО2 фиксируется Рубиско в С3-пути фотосинтеза.
Процесс фотосинтеза у САМ-растений (Сrassulaceae acid metabolism) происходит в специализированной зеленой ткани — хлоренхиме, которая окружена водозапасающей тканью — гидренхимой. На долю гидренхимы приходиться до 50% и более массы САМ-растений.
У этих растений днем устьица обычно закрыты, что предотвращает потерю воды. Ночью устьица открываются, СО2 проникает в клетки листа и при участии фермента ФЕП-карбоксилазы (рис., 1) взаимодействует с фосфоенолпируватом, образуя щавелевоуксусную кислоту (оксалоацетат или ЩУК). ЩУК под действием малатдегидрогеназы (рис., 2) восстанавливается в яблочную кислоту (малат), которая накапливается в вакуолях.
В течение дня, когда устьица закрыты, малат переносится в цитоплазму и декарбоксилируется при участии маликэнзима (рис.,3), образуя пируват и СО2. Высвободившаяся углекислота проникает в хлоропласты и фиксируется там Рубиско в цикле Кальвина с образованием сахаров.
Таким образом, в С4-растениях процессы разделены пространственно, а в САМ-растениях – во времени. Фиксация СО2 с образованием малата в С4-растениях протекает в хлоропластах мезофилла, а в САМ-растениях – ночью. Декарбоксилирование малата с высвобождением углекислоты и образованием пирувата в С4- растениях протекает в хлоропластах обкладки, а в САМ-растениях – днем.
