
- •Литература
- •Лекция №1 Колебания и волны
- •Примеры решения задач
- •Колебательные системы в биологии и медицине
- •2. Механические волны
- •Примеры решения задач
- •Ультразвук
- •Эффект Доплера
- •Диагностическое применение эффекта Доплера
- •Примеры решения задач
- •Лекция №2 Течение и свойства жидкостей
- •Примеры решения задач
- •Формула Пуазейля
- •Примеры решения задач
- •Примеры решения задач
- •Лекция №3 Электростатика
- •4. Работа перемещения заряда в электрическом поле. Потенциал.
- •5. Использование электрического поля в медицине.
- •Примеры решения задач
- •Лекция №4 Контактные явления
- •Лекция №5 Электромагнетизм
- •5. Магнитные свойства тканей организма. Физические основы магнитобиологии.
- •Примеры решения задач
- •Лекция №6
- •2. Частица в электрическом поле
- •4. Электромагнитные счетчики скорости крови
- •Примеры решения задач
- •Лекция №7
- •Примеры решения задач
- •Лекция №8 Электрические колебания и электромагнитные волны
- •Примеры решения задач
- •Лекция №9 Оптика
- •4. Эндоскопическая аппаратура и ее применение в клинической практике.
- •Примеры решения задач
- •Лекция №10 Волновые свойства света
- •Примеры решения задач
- •Лекция №11
- •Примеры решения задач
- •Лекция №12 Квантовые свойства света и строение атома
- •Примеры решения задач
- •4. Дискретность энергетических состояний атома. Постулаты Бора.
- •5. Квантовая теория строения атома водорода.
- •Примеры решения задач
- •Лекция №13 Рентгеновское излучение, его использование в медицине
- •3. Использование р.И. В медицинской практике
- •Лекция №14 Лазерное излучение, его использование в медицине.
- •4.Использование лазера в медицине
- •Примеры решения задач
- •Лекция №15 Магнито-резонансные явления, их применение в медицине.
- •Примеры решения задач
- •Лекция №16 Основы ядерной физики. Понятия ядерной медицины.
- •Примеры решения задач
4. Дискретность энергетических состояний атома. Постулаты Бора.
Линейчатый характер спектров излучения и поглощения атомов свидетельствует о том, что атом может излучать (поглощать) энергию не в любых количествах, а только вполне определенными порциями (квантами).
Исходя из представления о дискретности энергетических состояний атома Н.Бор в 1913 г. усовершенствовал атомную модель Резерфорда, создав квантовую теорию строения атома. В ее основу положены 3 постулата:
Электроны могут двигаться в атоме не по любым орбитам, а только по орбитам вполне определенного радиуса. На этих орбитах, называемых стационарными, момент количества движения электрона
![]() –условие
квантования (12)
–условие
квантования (12)
Где m- масса электрона,![]() - его скорость,r- радиус
орбиты,n- квантовое число
(n=1.2.3…)
- его скорость,r- радиус
орбиты,n- квантовое число
(n=1.2.3…)
Движение электронов по стационарным орбитам не сопровождается излучением (поглощением) энергии.
Переход электрона с одной стационарной орбиты на другую сопровождается излучением (поглощением) кванта энергии.
Величина
![]() этого кванта равна разности энергий
(W1иW2)
стационарных состояний атома до и после
излучения (поглощения):
этого кванта равна разности энергий
(W1иW2)
стационарных состояний атома до и после
излучения (поглощения):
![]() =W1-W2(13)-условие частоты
=W1-W2(13)-условие частоты
Т.о., частота э/м волн, излучаемых атомом, определяется не частотой вращения электронов в атоме, а разностью энергий стационарных состояний атома.
Постулаты Бора, сохранив в основном модель атома Резерфорда, вместе с тем освободили ее от упомянутых выше недостатков (противоречий опыту).
5. Квантовая теория строения атома водорода.
В атоме водорода вокруг ядра (протона), несущего заряд e, движется один электрон. Ядро можно считать неподвижным, поскольку его масса в 1840 раз больше массы электрона; орбиты электрона в первом приближении можно считать круговыми.
Центростремительной силой, удерживающей электрон на орбите радиусом r, является кулоновская сила притяжения между электроном и ядром:
![]() (14)
(14)
m- масса электрона,![]() - его скорость,
- его скорость,![]()
Решая (14) совместно с (12), получим выражение для радиуса стационарных орбит атома водорода
![]() (15)
(15)
Где n=1,2,..Дляn=1,r1≈0.53![]()
Полная энергия Wэлектрона в атоме слагается из кинетической энергииWкпоступательного движения электрона по орбите и потенциальной энергииWппритяжения электрона к ядру.
Учитывая (14), получим
![]() (16)
(16)
Потенциальная энергия должна быть отрицательна и равна
![]() (17)
(17)
![]() (18)
(18)
Т.е. полная энергия электрона оказывается отрицательной и равной по абсолютной величине его кинетической энергии. Подставляя в (18) выражение для rиз (15), получим
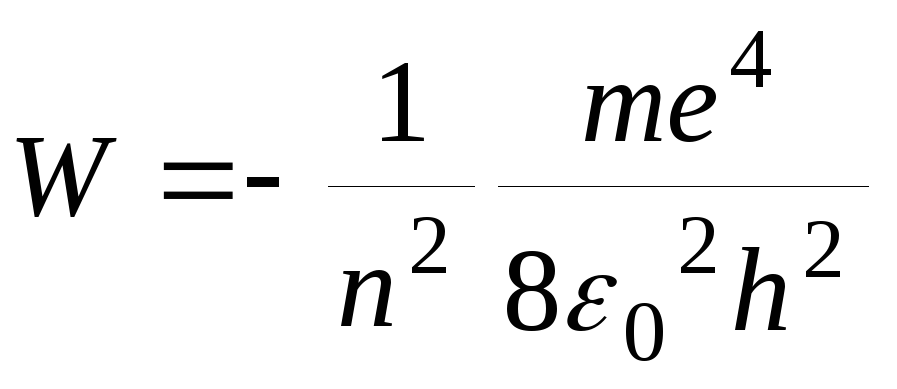 (19)
(19)
По этой формуле можно рассчитать энергию электрона для любой стационарной орбиты.
Величина полной энергии электрона, находящегося на стационарной орбите, называется уровнем энергии атома.
Согласно (19), энергия атома возрастает с увеличением квантового числа n, или с увеличением радиуса электронной орбиты. Так какWотрицательна, уменьшение ее абсолютной величины соответствует возрастанию энергии.
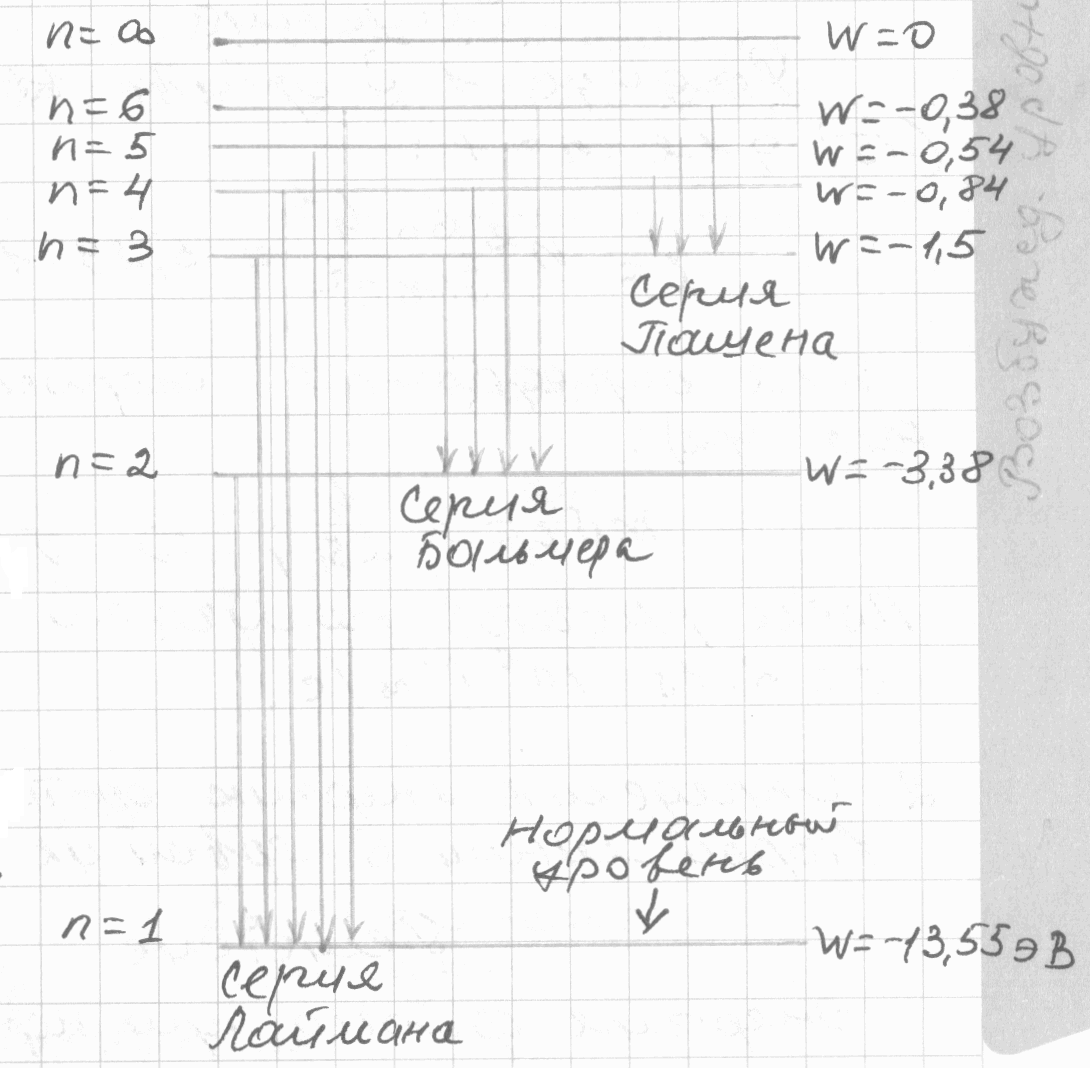
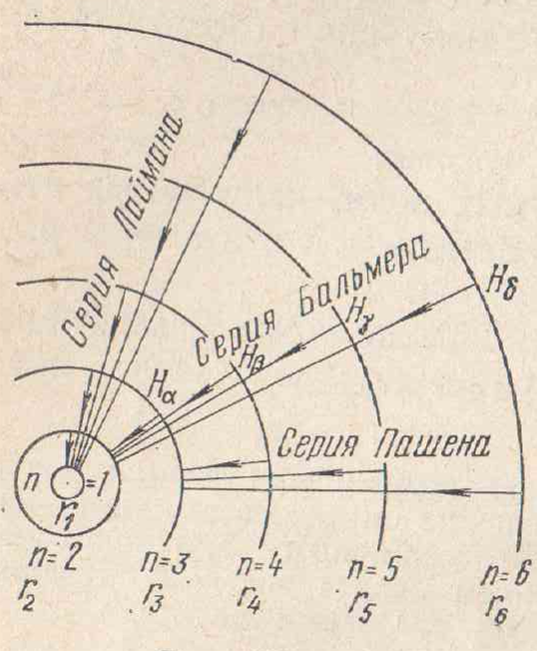
Энергетический уровень W=-13,55эВ называется нормальным уровнем, все остальные уровни называются возбужденными.
Выведем общую формулу для частоты
![]() излучения атома. Для этого (19) подставим
в (13):
излучения атома. Для этого (19) подставим
в (13):
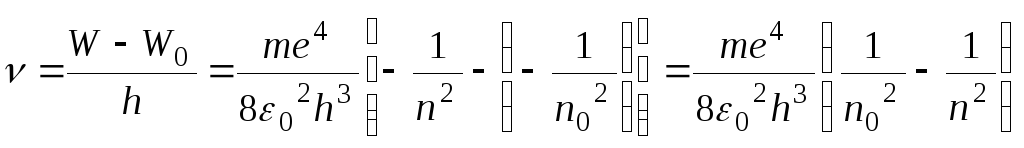 (20),
(20),
где nиWсоответствуют начальным состояниям атома (до излучения), аn0.иW0–после излучения
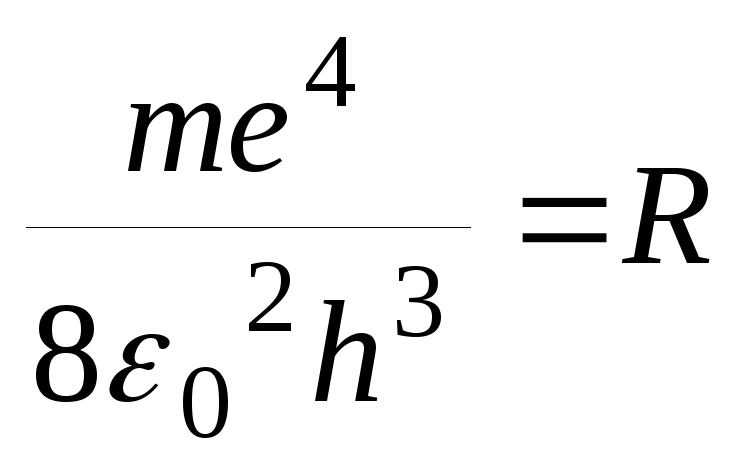 (21)
–постоянная Ридберга
(21)
–постоянная Ридберга
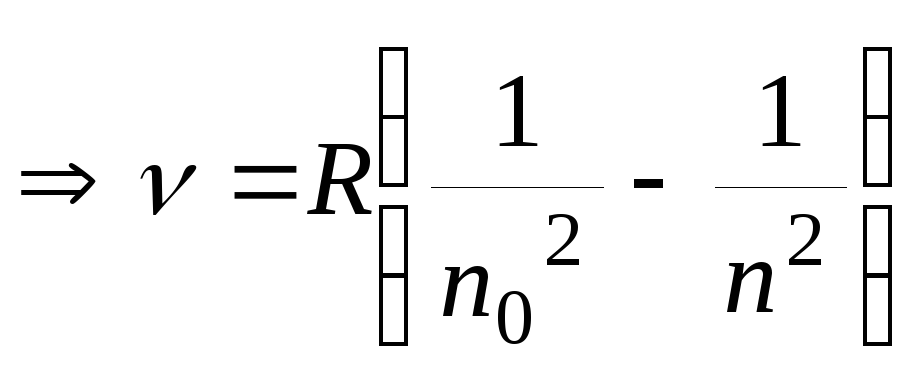 (22)
(22)
Эмпирические формулы (9),(10) и (11) являются частными случаями (22).
