
- •Электрохимические процессы
- •1. Гальванический элемент понятие об электродном потенциале
- •Гальванический элемент (гэ) даниэля-якоби
- •Электродвижущая сила элемента (эдс)
- •Водородная шкала потенциалов
- •Потенциалы металлических электродов
- •Потенциалы газовых электродов
- •Коррозия металлов
- •7.2.1.Химическая коррозия
- •7.2.2. Электрохимическая коррозия
- •Механизм электрохимической коррозии
- •Термодинамика электрохимической коррозии
- •Основные случаи возникновения коррозионных гальванических пар
- •7.2.3 Защита металлов от коррозии
- •7.3. Электролиз
- •7.3.1. Общие понятия
- •7.3.2. Электролиз расплавов электролитов
- •7.3.3. Электролиз растворов электролитов
- •7.3.4 Электролиз с растворимыми анодами
- •7.3.5. Законы электролиза
- •7.3.6. Применение электролиза
- •Химические источники тока
- •Энергия химическая энергия электрическая
- •Эффективность преобразования энергии из одних форм в другие
- •Гальванические элементы
- •Параметры гальванических элементов
- •Сухие гальванические элементы
- •Марганцово-цинковый элемент
- •Воздушно (кислородно) - цинковый элемент
- •Ртутно-цинковый гальванический элемент
- •Свинцовый элемент
- •Топливные элементы. Электрохимические генераторы
- •Кислородно-водородный топливный элемент
- •Электрохимические генераторы
- •Практическое применение топливных элементов
- •Электрохимические аккумуляторы
- •Характеристики перспективных аккумуляторов
- •Свинцовый аккумулятор
- •Никель - железный аккумулятор
- •Никель - кадмиевый аккумулятор
- •Другие типы перспективных аккумуляторов
7.3. Электролиз
7.3.1. Общие понятия
Электролизом называют процессы, происходящие на электродах под действием электрического тока, подаваемого от внешнего источника тока.
При электролизе происходит превращение электрической энергии в химическую. Для этого процесса G > 0, при стандартных условиях он самопроизвольно не идет.
Ячейка для электролиза, называемая электролизером (рис.7.13), состоит из двух электродов и электролита.
Рис.7. 5. Схема,
иллюстрирующая принцип действия
электролизера.
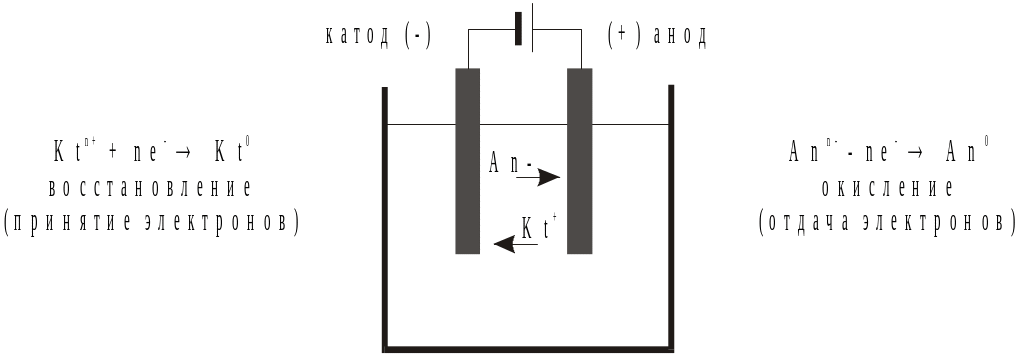
Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока. Положительно заряженные ионы - катионы - перемещаются к отрицательному электроду - катоду, а отрицательно заряженные ионы - анионы - перемещаются к положительному электроду - аноду.
Таким образом, сущность процесса электролиза заключается в том, что на катоде происходит процесс восстановления, а на аноде - процесс окисления.
Для практического осуществления электролиза конкретного электролита необходимо определенное минимальное пороговое напряжение. Это напряжение называется напряжением разложения электролита Uн.р.. Повышение напряжения, необходимое для развития процесса электролиза, обусловленное поляризацией электродов и омическими потерями, называется перенапряжением.
U = (А - К) + поляриз. + IR
При наличии перенапряжения потенциал катода становится более отрицательным, а потенциал анода - более положительным (рис.7.14).
Увеличение напряжения по сравнению с э.д.с. приводит к перерасходу электрической энергии. Иногда поляризация при электролизе играет положительную роль.
Рис.7.
6. Поляризация электродов при электролизе.
1 - поляризация анода, 2 - поляризация
катода.

7.3.2. Электролиз расплавов электролитов
Рассмотрим электродные реакции на примере электролиза расплава хлорида натрия.
Под действием температуры ионная кристаллическая решетка NaCl разрушается на ионы Na+ и Cl-. Если погрузить в расплавленную соль два графитовых (инертных) электрода и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов и на электродах будут происходить следующие реакции:
а) восстановление ионов Na+ до металлического натрия (катодный процесс).
б) окисление ионов Cl- до газообразного хлора (анодный процесс).
-
NaCl
(-) K
Na+ + Cl-
A (+)


Суммируя уравнения катодного и анодного процессов, (с учетом электронного баланса) получим окислительно-восстановительную реакцию, протекающую при электролизе:
2NaCl = 2Na(ж) + Cl2(г)
