
- •Электрохимические процессы
- •1. Гальванический элемент понятие об электродном потенциале
- •Гальванический элемент (гэ) даниэля-якоби
- •Электродвижущая сила элемента (эдс)
- •Водородная шкала потенциалов
- •Потенциалы металлических электродов
- •Потенциалы газовых электродов
- •Коррозия металлов
- •7.2.1.Химическая коррозия
- •7.2.2. Электрохимическая коррозия
- •Механизм электрохимической коррозии
- •Термодинамика электрохимической коррозии
- •Основные случаи возникновения коррозионных гальванических пар
- •7.2.3 Защита металлов от коррозии
- •7.3. Электролиз
- •7.3.1. Общие понятия
- •7.3.2. Электролиз расплавов электролитов
- •7.3.3. Электролиз растворов электролитов
- •7.3.4 Электролиз с растворимыми анодами
- •7.3.5. Законы электролиза
- •7.3.6. Применение электролиза
- •Химические источники тока
- •Энергия химическая энергия электрическая
- •Эффективность преобразования энергии из одних форм в другие
- •Гальванические элементы
- •Параметры гальванических элементов
- •Сухие гальванические элементы
- •Марганцово-цинковый элемент
- •Воздушно (кислородно) - цинковый элемент
- •Ртутно-цинковый гальванический элемент
- •Свинцовый элемент
- •Топливные элементы. Электрохимические генераторы
- •Кислородно-водородный топливный элемент
- •Электрохимические генераторы
- •Практическое применение топливных элементов
- •Электрохимические аккумуляторы
- •Характеристики перспективных аккумуляторов
- •Свинцовый аккумулятор
- •Никель - железный аккумулятор
- •Никель - кадмиевый аккумулятор
- •Другие типы перспективных аккумуляторов
Электрохимические процессы
Процессы взаимного превращения химической и электрохимической форм энергии называют электрохимическими.
Электрохимические процессы можно разделить на две основные группы:
процессы превращения химической энергии в электрическую (в гальванических элементах, при электрохимической коррозии, в электрохимическом аккумуляторе: цикл - разряд);
процессы превращения электрической энергии в химическую (при электролизе, в электрохимическом аккумуляторе: цикл - заряд).
1. Гальванический элемент понятие об электродном потенциале
Рассмотрим процессы, протекающие при погружении металла в раствор собственных ионов. Металлы имеют кристаллическое строение. В узлах решеток расположены ион - атомы, находящиеся в равновесии со свободными электронами:
![]()
При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора.
Наиболее важной реакцией является взаимодействие поверхностных ион-атомов металла, находящихся в узлах решетки, с полярными молекулами растворителя (воды), ориентированными у поверхности электрода. В результате процесса происходит окисление металла, и его сольватированные (гидратированные) ионы переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами в металле:
![]()
Металл с поверхности становится заряженным отрицательно, а раствор - положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла. На границе металл - раствор возникает двойной электрический слой.

Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом (ЭП) или потенциалом электрода.
Для характеристики электродных процессов пользуются относительными значениями ЭП. Для этого находят разность потенциалов измеряемого электрода и электрода, который принят за эталон.
Гальванический элемент (гэ) даниэля-якоби
Рассмотрим систему, в которой два электрода находятся в растворах собственных ионов. Примером может служить гальванический элемент Даниэля-Якоби, схема которого приведена на рис.
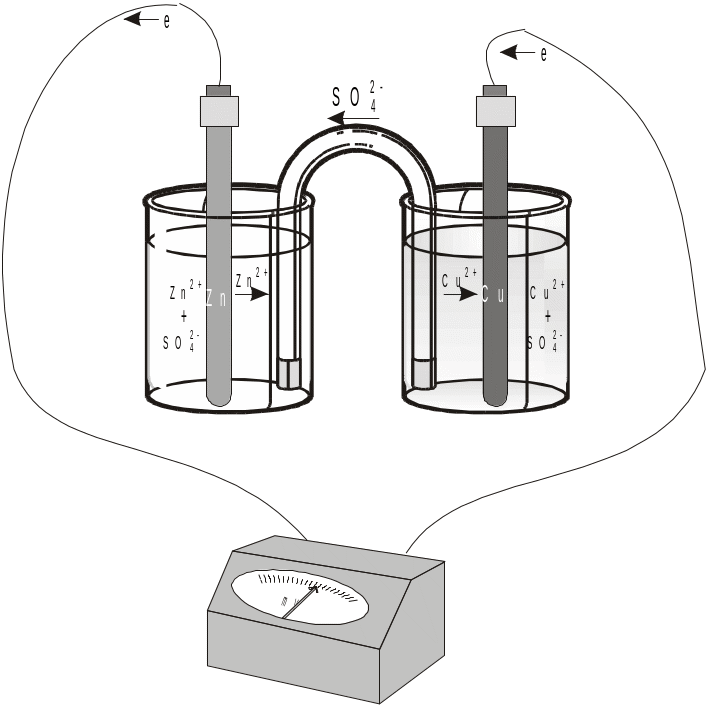
Он состоит из медной пластины, погруженной в раствор CuSO4 и цинковой пластины, погруженной в раствор ZnSO4. На поверхности цинковой и медной пластин возникает двойной электрический слой и устанавливается равновесие, характеризующееся определенными значениями ЭП.
![]()
Вследствие большей активности цинка с его поверхности уходит больше ионов и на поверхности металлической пластины возникает больший избыток электронов. Поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде сместится вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд дополнительного количества ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде.
Чтобы предотвратить явление, известное как «запирание ГЭ», т.е. дать возможность ионам соли свободно перемещаться из одного раствора в другой, используют солевой мостик.
Он представляет собой изогнутую (U- образную) стеклянную трубку, заполненную насыщенным раствором хлорида калия. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится цинковая пластина (или не высадятся из раствора все ионы меди).
Итак, при работе медно-цинкового элемента протекают следующие основные процессы:
1) реакция окисления цинка
![]()
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди
![]()
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
3) движение электронов во внешней цепи;
4) движение ионов в растворе.
Суммируя электродные реакции, получаем:
Zn + Cu2+ = Cu + Zn2+
Вследствие этой химической реакции в ГЭ возникает электрический ток, поэтому ее называют токообразующей.
При схематической записи ГЭ границу раздела между проводником 1-го рода (металлом) и проводником 2-го рода (раствором электролита) обозначают одной вертикальной чертой, а границу раздела между проводниками 2-го рода - двумя чертами.
Схема элемента Даниэля-Якоби записывается в виде:
(-) A Zn | Zn2+ || Cu2+ | Cu K (+)
