
- •Растворы дисперсные системы
- •Растворимость
- •Способы выражения состава растворов
- •Разбавленные растворы неэлектролитов
- •Давление пара над растворами
- •Температура кипения и замерзания растворов
- •Осмотическое давление
- •Растворы электролитов. Основы теории электролитической диссоциации
- •Этапы электролитической ионизации полярных молекул (а) и ионных кристаллов (б):
- •Сильные и слабые электролиты
- •Равновесие в растворах слабых электролитов
- •Основания, кислоты и соли в свете теории электролитической диссоциации
- •Ионное произведение воды
- •Произведение растворимости
- •Реакции обмена в растворах электролитов
- •Гидролиз солей
Произведение растворимости
Применение закона действующих масс к гетерогенной системе - насыщенному раствору сильного малорастворимого электролита, находящемуся в равновесии со своим осадком:
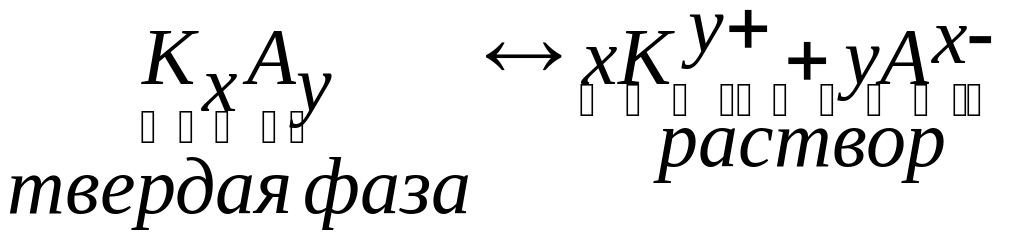
дает выражение константы равновесия:
K = [Ky+]x[Ax-]y ,
которая в данном случае называется произведением растворимости (ПР).
ПР = [Ky+]x[Ax-]y
Таким образом, в насыщенном растворе сильного малорастворимого электролита произведение концентраций его ионов в степенях, равных стехиометрическим коэффициентам при данных ионах (при данной температуре), есть величина постоянная, называемая произведением растворимости.
Величина ПР характеризует сравнительную растворимость однотипных (образующих при диссоциации одинаковое количество ионов) веществ.
Чем больше ПР данного вещества, тем больше его растворимость.
Например:
Ca(OH)2 Mg(OH)2 Fe(OH)2
ПР 5,510-6 5,010-12 4,810-16
В данном случае наименее растворимым является гидроксид железа (II).
Реакции обмена в растворах электролитов
Необходимым условием протекания обменных реакций в растворах электролитов является удаление из раствора тех или иных ионов вследствие образования малодиссоциирующих (слабые электролиты и комплексные ионы) или малорастворимых веществ (осадки и газы).
Реакции обмена в растворах электролитов записывают в виде трех уравнений: молекулярного, полного ионно-молекулярного и сокращенного ионно-молекулярного. Для составления этих уравнений необходимо знать характер электролитической диссоциации участников реакции.
Малодиссоциирующие и малорастворимые вещества в ионно-молекулярных уравнениях записываются в молекулярном виде. Реакции, в которых слабые электролиты или малорастворимые вещества входят в состав только продуктов реакции, протекают, как правило, необратимо, т.е. до конца.
Примеры реакций, протекающих практически необратимо:
с образованием малодиссоциирующих соединений:
а) HCl + NaOH = NaCl + H2O - молекулярное уравнение,
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O - полное ионно-молекулярное уравнение,
H+ + OH- = H2O - сокращенное ионно-молекулярное уравнение,
б) NaF + HCl = NaCl + HF,
F- + H+ = HF - сокращенное ионно-молекулярное уравнение,
в) NH4Cl + NaOH = NH3H2O + NaCl,
+ OH- = NH3H2O - сокращенное ионно-молекулярное уравнение,
с образованием малорастворимых веществ:
а) NaCl + AgNO3 = NaNO3 + AgCl
Cl- + Ag+ = AgCl - сокращенное ионно-молекулярное уравнение.
Реакции, в которых слабые электролиты или малорастворимые вещества входят в состав как продуктов, так и исходных веществ, протекают, как правило, не до конца, т.е. являются обратимыми. Равновесие обратимого процесса в этих случаях смещено в сторону образования наименее диссоциированных или наименее растворимых частиц.
Примеры обратимых реакций, равновесие которых смещено вправо:
HF + NaOH NaF + H2O,
HF + OH- F- + H2O - сокращенное ионно-молекулярное уравнение.
NH3H2O + HCl NH4Cl + H2O,
NH3H2O + H+ + H2O - сокращенное ионно-молекулярное уравнение
HF + NH3H2O NH4F + H2O,
HF + NH3H2O + F- + H2O - сокращенное ионно-молекулярное уравнение
AgCl + NaI NaCl + AgI,
AgCl + I- Cl- + Ag - сокращенное ионно-молекулярное уравнение
ПР(AgCl) = 1,7810-10 ПР(AgI) = 8,310-17
ПР(AgI) меньше ПР(AgCl), равновесие обратимого процесса смещено в сторону образования AgI.
MnS + 2HCl H2S + MnCl2 ,
MnS + 2H+ H2S + Mn2+ - сокращенное ионно-молекулярное уравнение
Be(OH)2 + 2KOH K2[Be(OH)4],
Be(OH)2 + 2OH- [Be(OH)4]2- - сокращенное ионно-молекулярное уравнение
