
- •Растворы дисперсные системы
- •Растворимость
- •Способы выражения состава растворов
- •Разбавленные растворы неэлектролитов
- •Давление пара над растворами
- •Температура кипения и замерзания растворов
- •Осмотическое давление
- •Растворы электролитов. Основы теории электролитической диссоциации
- •Этапы электролитической ионизации полярных молекул (а) и ионных кристаллов (б):
- •Сильные и слабые электролиты
- •Равновесие в растворах слабых электролитов
- •Основания, кислоты и соли в свете теории электролитической диссоциации
- •Ионное произведение воды
- •Произведение растворимости
- •Реакции обмена в растворах электролитов
- •Гидролиз солей
Разбавленные растворы неэлектролитов
Свойства разбавленных растворов неэлектролитов, относящихся к нелетучим веществам, описываются следующими законами.
Давление пара над растворами
Первый закон Рауля: относительное понижение парциального давления пара растворителя над разбавленным раствором неэлектролита равно молярной доле растворенного вещества:
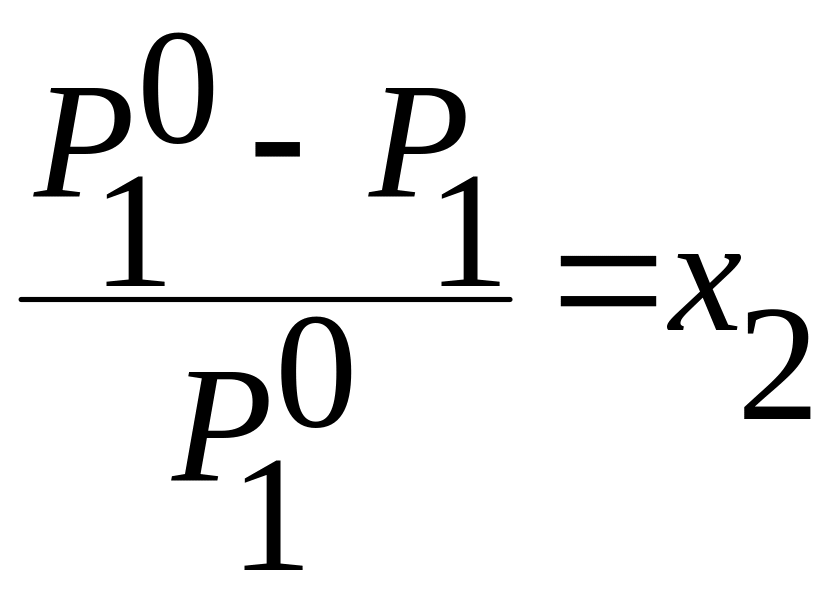
где
![]() - давление насыщенного пара чистого
растворителя при данной температуре;
- давление насыщенного пара чистого
растворителя при данной температуре;
P1 - давление насыщенного пара растворителя над раствором;
x1 и x2 - молярная доля растворителя и растворенного вещества, соответственно.
 Франсуа
Мари Рауль 1830
Франсуа
Мари Рауль 1830
1 закон Рауля

Учитывая, что x1 + x2 = 1 и, проведя преобразования, можно получить:
P1
=
![]() x1
x1
Это уравнение представляет собой другое выражение закона Рауля: парциальное давление насыщенного пара растворителя над раствором прямо пропорционально его молярной доле.
Температура кипения и замерзания растворов
Из первого закона Рауля вытекает, что растворы нелетучих веществ должны кипеть при более высокой и замерзать при более низкой температуре, чем чистый растворитель.
Второй закон Рауля: повышение температуры кипения или понижение температуры замерзания разбавленных растворов неэлектролитов пропорциональны числу частиц растворенного вещества и не зависят от его природы:
Tкип. = ECm
Tзам. = KCm ,
где E и K - коэффициенты пропорциональности, соответственно, эбуллиоскопическая и криоскопическая константы, зависящие только от природы растворителя (для воды K = 1,86, E = 0,516);
Cm - моляльность неэлектролита в растворе.
Осмотическое давление
Если раствор и растворитель разделены полупроницаемой (т.е. проницаемой только для растворителя) мембраной, то растворитель проникает в раствор, преодолевая избыточное давление, до достижения его равновесного давления - осмотического давления.
Осмотическое давление не зависит от природы растворителя и растворенного вещества. Оно пропорционально молярной концентрации раствора C и абсолютной температуре T:
Pосм. = CRT,
где R - универсальная газовая постоянная.
Подставляя в выражение С = n/V, где n - количество растворенного вещества, моль; V - объем раствора, л;
получим уравнение, аналогичное уравнению газового состояния:
Pосм.V = nRT.
Закон Вант-Гоффа: осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объем, равный объему раствора.
Растворы электролитов. Основы теории электролитической диссоциации
Распад растворенного вещества на ионы под действием молекул растворителя называют электролитической диссоциацией или ионизацией вещества в растворах.
Теория электролитической диссоциации была создана в 1884-1887 гг. шведским химиком С. Аррениусом и развита в трудах И.А. Каблукова, В.А. Кистяковского на основе химической (гидратной) теории растворения Д.И. Менделеева.
 Сванте
Аррениус
Сванте
Аррениус
 Каблуков Иван Алексеевич
Каблуков Иван Алексеевич
 Кистяковский
Владимир Александрович
Кистяковский
Владимир Александрович
 Менделеев Дмитрий Иванович
Менделеев Дмитрий Иванович
Основные положения теории электролитической диссоциации:
при растворении солей, кислот и оснований в воде происходит ионизация этих веществ с образованием заряженных частиц - ионов: положительных (катионов) и отрицательных (анионов);
электрическая проводимость растворов солей, кислот и оснований в воде прямо пропорциональна общей концентрации ионов в растворе.
Возможность и степень распада растворенного вещества на ионы определяется природой растворенного вещества и растворителя. Электролитической ионизации в полярных растворителях подвержены ионные и молекулярные соединения с полярным типом связи.
Электролитическую диссоциацию в растворе вызывают не только вода, но и неводные полярные растворители, такие как жидкие аммиак, диоксид серы и др.
Электролитическая диссоциация обусловлена взаимодействием полярных молекул растворителя с частицами растворенного вещества.
