
- •Практическое занятие № 1, 2. Самореплицирующиеся молекулы. Естественный отбор самореплицирующихся молекул.
- •II. Третичная структура днк. Cверхспирализация днк.
- •Доказательства генетической роли нуклеиновых кислот
- •Принципиальная организация днк. Модель днк Уотсона и Крика
- •Хугстеновское спаривание – основа формирования триплексов днк. Н-днк.
- •Явление суперспирализации днк.
- •Регуляция топологии днк in vivo.
- •Классификация днк-топоизомераз
- •Ядро эукариотической клетки и организация генома эукариот
- •Типичные характеристики гистонов млекопитающих
Типичные характеристики гистонов млекопитающих
Тип гистона |
Число аминокислот |
Число оснóвных аминокислот |
Число кислых аминокислот |
Отношение Lys/Arg |
Значение общего положительного заряда |
Молекуляр-ная масса, Да |
Н1 |
224 |
65 |
12 |
21 |
+ 58 |
23,000 |
Н2А |
129 |
26 |
20 |
1,2 |
+ 15 |
13 960 |
Н2В |
125 |
28 |
16 |
2,5 |
+ 19 |
13 774 |
Н3 |
135 |
32 |
18 |
0,7 |
+ 20 |
15 342 |
Н4 |
102 |
26 |
10 |
0,8 |
+ 16 |
11 282 |
Гистоны, как оснóвные белки, часто классифицируют следующим образом: богатые лизином (Н1), умеренно богатые лизином (Н2А и Н2В) и богатые аргинином (Н3 и Н4). Каждый гистон кора имеет компактный домен из 70-100 аминокислотных остатков и гибкий (подвижный) N-концевой «хвост» содержащий приблизительно 30 аминокислотных остатков. Рентгеноструктурный анализ высокого разрешения минимальных нуклеосом и изолированных гистоновых октамеров показал, что компактные домены гистонов построены из характерных Z-образных «гистоновых складок», состоящих из одного длинного α-спирализованного участка и двух примыкающих к нему более коротких α-спиралей (рис. 2.6). Не оснóвные или слабооснóвные аминокислоты гистонов расположены ближе к С-концу, формируя глобулярную структуру, которая, по-видимому, является сайтом взаимодействия между гистонами в нуклеогистоновых комплексах. Оснóвные N-концевые области белков ответственны за связывание с ДНК.
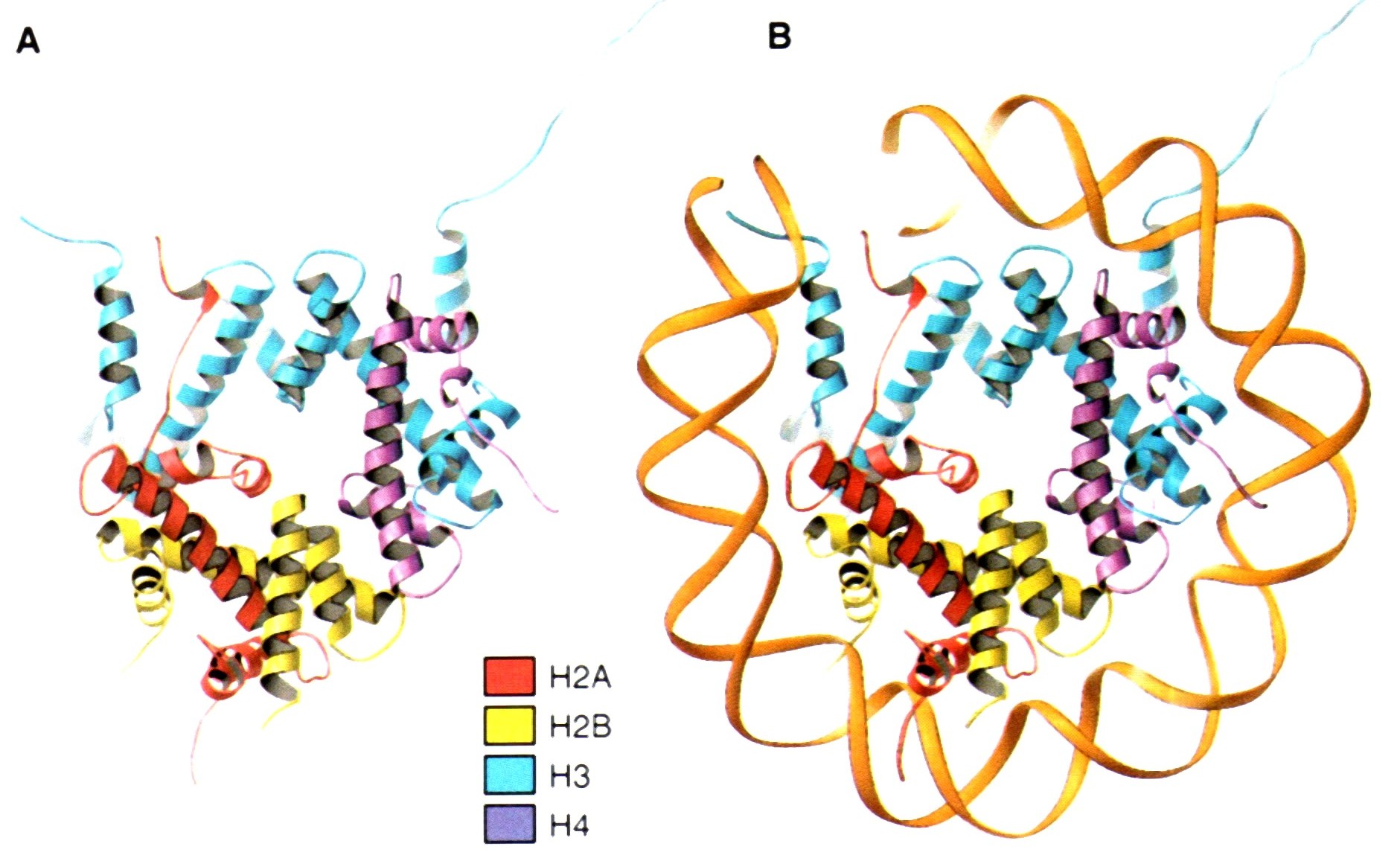
Рис. 2.6 |
Вторичная структура гистонов в составе гистонового октамера и минимальной нуклеосомы. А – «лентами» показано, что каждый гистон в составе октамера обладает характерными α-спирализованными участками. N-концевые последовательности гистонов, которые играют принципиальную роль в регуляции структуры хроматина не занимают уникального положения в кристаллах и не обнаруживаются в этой структуре. В – гистоновый октамер окружен одним из двух оборотов ДНК. Luger K., Mäder A.W., Richmond R.K., et al., Crystal structure of the nucleosome core particle at 2.8 Å resolution, Nature, 389, 251-260, 1997. |
Анализ аминокислотных последовательностей гистонов Н4, выделенных из проростков гороха и из тимуса теленка показал, что они различаются только по двум положениям из 102. Замены эти очень незначительны: Val – вместо Ile и Lys – вместо Arg. Таким образом, последовательность аминокислот в гистоне Н4 сохранилась почти без изменений на протяжении 1,2∙109 лет, прошедших со времени разделения всего живого на царства растений и животных. Гистон Н3 также мало изменился на протяжении этого колоссального периода эволюции. Последовательности аминокислот в гистоне Н3 из проростков гороха и из тимуса теленка различаются по четырем положениям. Интересно сравнить скорость изменения последовательности этих гистонов в ходе эволюции со скоростью изменения других белков. Для этого используется величина единичного эволюционного периода. Она равна времени, за которое последовательность аминокислот в белке изменяется на 1% после того, как расходятся две эволюционные линии. Эта величина для гистонов Н3 и Н4 составляет 3∙108 и 6∙108 лет, соответственно, и значительно превышает значения, полученные для других исследованных белков. Например, для другого достаточно консервативного белка – цитохрома с – единичный эволюционный период составляет 2∙107 лет, а для гемоглобина – 6∙106 лет.
Замечательная консервативность структуры гистонов Н3 и Н4 свидетельствует о важности функции, возникшей на заре эволюции эукариот и необходимости ее сохранения почти без изменений.
Гистоны Н2А и Н2В являются менее консервативными, но все еще проявляют существенную эволюционную стабильность, особенно в пределах неоснóвных последовательностей аминокислот. Гистоны Н1 существенно отличаются от внутренних гистонов. Они крупнее, более оснóвные и характеризуются намного более высокой видовой и даже тканевой специфичностью. Вследствие чрезвычайно высого содержания в них лизина и аргинина эти белки обладают сильно выраженными поликатионными свойствами и поэтому легко взаимодействуют с полианионным остовом ДНК, образуя незаряженные нуклеопротеидные комплексы.
Итак, все пять типов гистонов характеризуются присутствием центрального неполярного полипептидного домена, который при соответствующей ионной силе стремится образовать глобулярную структуру, и наличием N- и С-концевых областей, которые содержат бóльшую часть оснóвных аминокислот. Амино-концевые последовательности гистонов (N-концевые «хвосты») чрезвычайно важны для образования контактов как внутри, так и снаружи нуклеосомы. Они выступают наружу от цилиндрических поверхностей нуклеосомного кора, а также проходят по «туннелям» малых бороздок, причем два оборота суперспирализованной ДНК располагаются так, что смежные области малых бороздок сближены.
Хотя эти N-концевые последовательности не упорядочены ни в кристаллах, ни в растворе, они относятся к наиболее высококонсервативным областям этих высококонсервативных белков, так как они выполняют две существенные функции. Во-первых, способствуя образованию контактов между нуклеосомами, N-концевые последовательности дают возможность нуклеосомам упаковываться в волокна диаметром 30 нм. В частности было показано, что гистоны, из которых при обработке протеазами были удалены N-концевые последовательности, продолжали сохранять способность к сборке в нуклеосомы, но утрачивали способность формировать волокна диаметром 30 нм. Во-вторых, специфические модификации этих N-концевых последовательностей используются для сборки хроматина, с одной стороны, и для регуляции доступности ДНК в составе хроматиновых волокон аппаратам транскрипции, репликации и репарации.
Каждый кластер ДНК-гистоны имеет форму диска с диаметром ~10 нм и высотой 6 нм. Кластеры организованы так, что к тетрамеру (Н3)2(Н4)2 с каждой стороны присоединяется по одному димеру Н2А-Н2В. Диаметр всего октамера гистонов определяется размером тетрамера (Н3)2(Н4)2. Эта особенность объясняет способность тетрамера организовывать ДНК в условиях in vitro в частицы, проявляющие некоторые свойства минимальной нуклеосомы. Накручивание ДНК на нуклеосомную сердцевину обеспечивает конденсацию ДНК, поскольку это приводит к уменьшению ее линейного размера. Так, сегмент ДНК длиной 200 пар оснований имеет в растворе протяженность 68 нм. В нуклеосоме это количество ДНК укладывается в частицу диаметром 10 нм. Следовательно, плотность упаковки ДНК в данном случае имеет значение приблизительно равное 7. При описании строения нуклеопротеидных комплексов принято различать две основные структуры : – нуклеосомный «кор» и хроматосому. Описание строения нуклеосомного кора было приведено выше (рис. 2.5). Хроматосому принято считать базовым структурным элементом нуклеопротеидных комплексов. Она состоит из 166 пар нуклеотидов суперспирализованной ДНК, обернутой дважды вокруг гистонового октамера. Данная структура фиксируется гистоном Н1 (рис. 2.7).
Следующий уровень организации хроматина представлен полинуклеосомой, состоящей из многочисленных нуклеосом, связанных между собой линкерной ДНК, размеры которой отличаются в клетках разных типов. Поскольку вокруг гистонового октамера в минимальной нуклеосоме оборачивается сегмент ДНК в 146 пар оснований, а наименьший размер линкера составляет 20 пар нуклеотидов, полинуклеосома имеет минимальную повторяемость из 166 пар оснований.
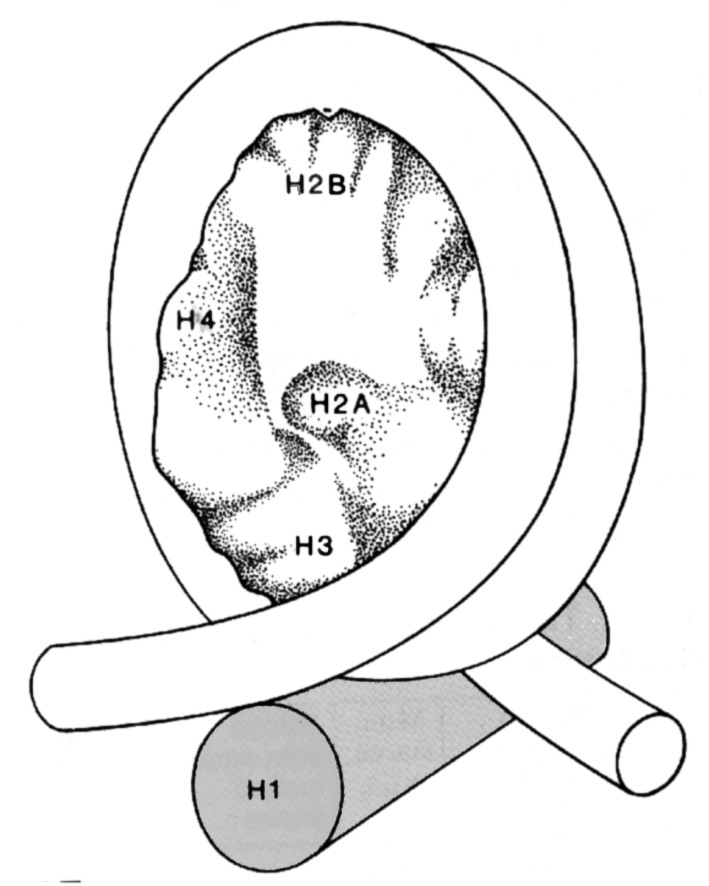
Рис. 2.7 |
Гистон Н1 «сшивает» ДНК в местах, где она начинает и прекращает наматываться на нуклеосомный «кор» (Klug A., Les Prix Nobel, Stockholm, Sweden, Nobel Foundation, 1982, p. 93). |
Результаты по реконструкции ДНК с гистонами показали, что при низких концентрациях октамеров каждый белковый «кор» связывает более 146 пар нуклеотидов. При увеличении концентрации октамеров каждый из них оказывается связанным только со 146 парами нуклеотидов. Это выглядит так, как будто в отсутствие соседней минимальной нуклеосомы гистоновый октамер стремится «захватить» бóльше ДНК, но при появлении ближайшего соседа отдает всю «лишнюю» ДНК, за исключением той ее части, которая входит в состав собственной минимальной нуклеосомы. Что же отвечает за регуляцию реакции связывания ДНК in vivo, определяющей расположение нуклеосом с определенным интервалом, специфичным для соответствующей клетки.
Системой, в которой удалось получить подлинную плотность расположения нуклеосом в опытах in vitro, оказалась система ооцитов Xenopus. Из ооцитов был выделен белок сборки, который контролирует реакцию ДНК с гистонами таким образом, что этот процесс становится эффективным и ведет к образованию нуклеосом, а не случайных агрегатов. Этот белок, названный нуклеоплазмином, представлен пентамером, состоящим из идентичных субъединиц по 29.000 дальтон. Нуклеоплазмин – это кислый белок, который не связывается ни со свободной ДНК, ни с интактными нуклеосомами, но взаимодействует со всеми индивидуальными гистонами. Нуклеоплазмин, возможно, играет роль «молекулярного сопровождающего», связываясь с гистонами и передавая их ДНК более регулируемым способом. В пользу этого предположения говорит тот факт, что кислая полиглутаминовая кислота (polyGlu) и РНК могут действовать сходным образом в качестве факторов сборки.
Общая особенность нуклеоплазмина, кислой polyGlu, а также РНК состоит в том, что все эти молекулы способны связываться с гистонами, уменьшая их суммарный положительный заряд. Использование высокой концентрации солей при сборке гистоновых октамеров in vitro имитирует эту ситуацию. В результате таких взаимодействий гистоны могут, вероятно, образовывать термодинамически более стабильные комплексы, минуя стадии формирования иных комплексов, которые в состоянии возникать вследствие естественного высокого сродства гистонов к ДНК.
Из сказанного выше следует, что в процессе сборки минимальных нуклеосом должны быть реализованы, по меньшей мере, две функции, не свойственные самим компонентам нуклеосомы. Первая из них – функция нуклеоплазмина – касается контроля сродства гистонов к ДНК. Вторая связана с определением длины ДНК, которая содержится в нуклеосоме. Эту функцию еще предстоит выяснить.
В дальнейшей конденсации ДНК принимает участие сильнооснòвный гистон Н1. В результате его взаимодействия с нуклеосомными частицами в составе вытянутой цепочки полинуклеосомы происходит формирование волокна диаметром 10 нм (100Å), называемого нуклеофиламентом, при этом молекулы гистона Н1 располагаются близко друг к другу (рис. 2.8), способствуя этой конденсации.
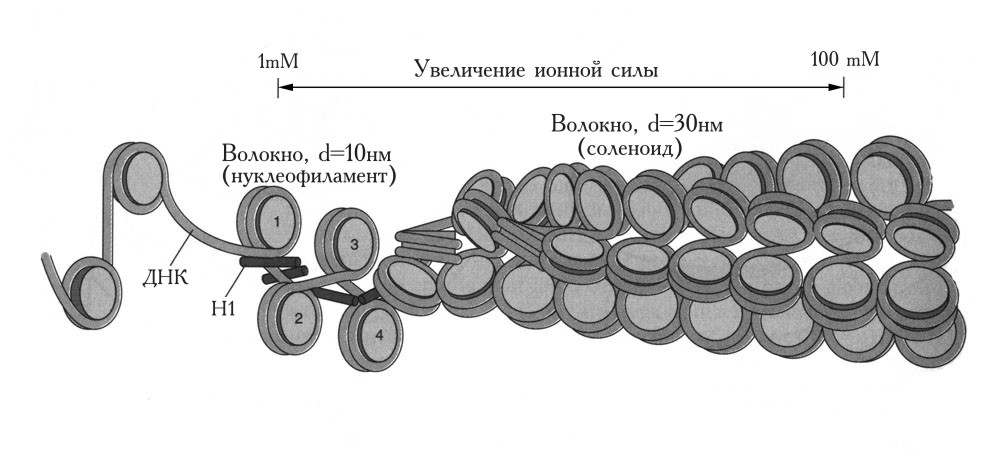
Рис. 2.8 |
Структура хроматина с разной степенью конденсации. В левой части рисунка показан хроматин, представленный полинуклеосомой, находящейся в растянутой форме. Она имеет вид нити с нанизанными на нее «бусинками». Хроматин в частично конденсированной форме представляет собой волокно диаметром 10 нм. Обратите внимание на взаимодействие молекул гистона Н1, связанных с каждой нуклеосомой, которое способствует конденсации волокна диаметром 10 нм в более плотную структуру – нуклеофиламент. В правой части рисунка представлен хроматин в наиболее конденсированном состоянии, при котором волокно диаметром 10 нм образует соленоид диаметром 30 нм (Kornberg R.D., Klug A., The nucleosome, Sci. American, 1981, 244, 48-62). |
Предполагают, что при повышении ионной силы нуклеофиламенты формируют очень компактную спиралеобразную структуру или спиральный соленоид (рис. 2.8) диаметром 30 нм (300Å), существование которого подтверждено электронно-микроскопическими исследованиями (рис. 2.2). Данный этап конденсации ДНК характеризуется плотностью упаковки со значением 40-50. Следует, однако, отметить, что, несмотря на более чем 30-летние интенсивные исследования структуры волокон диаметром 30 нм их «устройство» до сих пор остается предметом полемики. На рис. 2.9 приведены различные варианты строения таких волокон от классической соленоидной структуры до зигзагообразного варианта укладывания нуклеосом в волокно диаметром 30 нм. Имеющиеся разногласия по поводу строения хроматина на данном уровне его организации являются следствием того, что нити хроматина крайне хрупки и легко повреждаются в ходе приготовления его препаратов для структурных исследований.

Рис. 2.9 |
Предполагаемая структура волокон хроматина диаметром 30 нм. А – классическая модель спирального соленоида, B – соленоидная структура с перекрещенными участками линкерной ДНК, С – волокно организованное случайным образом, D – зигзагообразная структура волокна. Е – электронная микрофотография вытянутого волокна хроматина после удаления гистонов Н1: волокно диаметром 10 нм или так называемая «нить с нанизанными на нее бусинами», F – этот же препарат хроматина в присутствии гистонов Н1: волокно диаметром 30 нм (Thoma F., Koller T., Influence of histone H1 on chromatin structure, Cell, 1977, 12, 101-107). |
В соответствии с одной из моделей описывающих структуру хроматина (рис. 2.10), спирализованный соленоид укладывается в спираль высшего порядка, которая впоследствии формирует «шпилькообразную» структуру диаметром 60 нм (600Å).
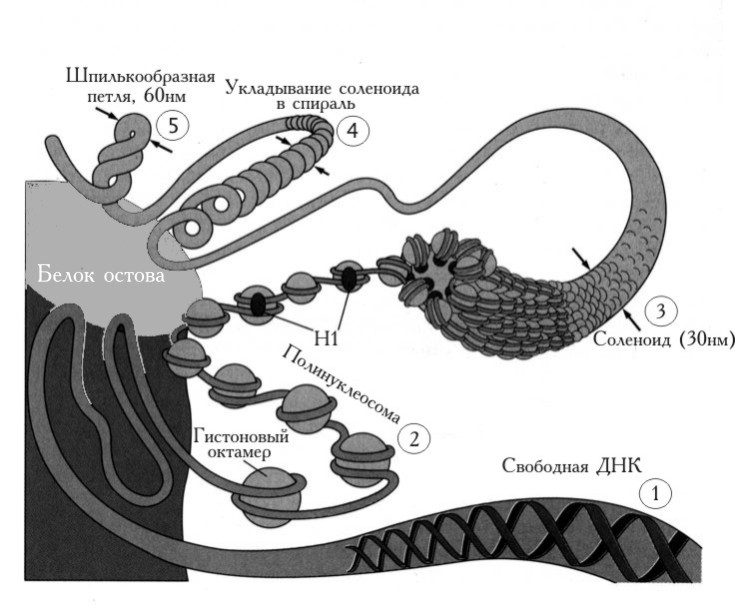
Рис. 2.10 |
Различные уровни организации хроматина в клетке. 1 – свободная ДНК, 2 – полинуклеосома после связывания Н1 образует нуклеофиламент, 3 – соленоидная структура диаметром 30 нм, 4 – суперспирализация волокна диаметром 30 нм, 5 – петли суперскрученной ДНК диаметром 60 нм присоединяются к остову в центре хромосомы (Textbook of Biochemistry with clinical correlations, Devlin T.M., (ed.), WILEY-LISS, 1993, p. 641). |
На этой последней стадии упаковки петли суперскрученной ДНК (структуры диаметром 60 нм), включающие 40.000 – 80.000 пар оснований, соединяются в центре хромосомы в области, обогащенной белками и называемой остовом (scaffold). В конце концов, на уровне конденсации хроматина, который обнаруживается в хромосомах непосредственно перед делением клетки, ДНК упакована так, что ее линейные размеры уменьшаются в 7.000 – 10.000 раз.
Кроме гистонов в нуклепротеидных комплексах с ДНК связано также множество других белков, которые иногда обозначают, как негистоновые белки. Данная гетерогенная группа белков характеризуется чрезвычайно высокой видовой и даже тканевой специфичностью, большинство из которых присутствует в следовых количествах. К классу негистоновых белков относят белковые компоненты нуклеопротеидов, которые изменяют набор экспрессирующихся генов, отличающий один тип специализированных клеток от другого. Так, к числу негистонов можно отнести РНК-полимеразы, ДНК-топоизомеразы, а также белки-активаторы и белки-репрессоры транскрипции.
Существование модели, описывающей структуру хроматина в виде нити двухцепочечной ДНК, закрученной вокруг серии нуклеосом, является первой принципиальной вехой в выяснении способа организации генетического материала в ядре. Организация хромосом в действительности должна быть достаточно гибкой, для того чтобы удовлетворять многим требованиям, предъявляеимым к структуре и функциям хроматина. Известно, что наличие нуклеосом характерно как для гетерохроматина, так и для эухроматина. В митотических хромосомах эухроматин обязательно должен принимать более плотноупакованное состояние, в то время как в интерфазе степень конденсации эухроматина существенно снижается. Снижение плотности упаковки эухроматина должно происходить при особых событиях двух типов, имеющих место только в таких условиях, когда структура находится в растянутом состоянии. Это процессы репликации и транскрипции. Какие события происходят при удвоении ДНК, пока еще не установлено, однако необходимость разделения цепей родительской ДНК, по-видимому, должно неизбежно нарушать конденсированную структуру, по крайней мере, волокон диаметром 30 нм, а, возможно, также волокон диаметром 10 нм.
При транскрипции также должно происходить раскручивание ДНК, что продиктовано требованием разделения цепей хотя бы в ограниченном участке хроматина. Поскольку ДНК должна быть расплетена – кажется маловероятным, чтобы участок, связанный с РНК-полимеразой, мог оставаться на поверхности нуклеосомы. При рассмотрении этих вопросов следует четко представлять относительные размеры РНК-полимеразы и нуклеосом. Эукариотические ДНК-зависимые РНК-полимеразы – это крупные белки, имеющие молекулярные массы в пределах 500 000 дальтон. Нуклеосомы имеют молекулярную массу порядка 260 000 дальтон. Сопоставление этих размеров выдвигает на первое место вопрос о том, имеет ли РНК-полимераза достаточный доступ к ДНК, если нуклеиновая кислота по-прежнему закручена вокруг нуклеосомы. Принимая во внимание относительные размеры нуклеосом и РНК-полимераз, трудно представить, чтобы в процессе транскрипции полимераза передвигалась по ДНК вокруг нуклеосомы.
Таким образом, первый вопрос, касающийся структуры активных генов, заключается в том, организована ли транскрибируемая ДНК в виде нуклеосом. Гены, кодирующие рРНК, были достаточно детально исследованы с помощью электронного микроскопа. Рассчитанная плотность упаковки ДНК в таких транскрипционно активных единицах составляла приблизительно 1,2. Поскольку плотность упаковки ДНК в нуклеосомах равняется ~7, можно с уверенностью утверждать, что в данном случае ДНК практически полностью вытянута и не может быть организована в нуклеосомы. Нетранскрибируемые спейсеры между единицами транскрипции также почти полностью вытянуты – плотность их упаковки составляет около 1,4. Все эти наблюдения свидетельствуют о том, что состояние ДНК в интенсивно транскрибируемых тандемных генах рРНК сильно отличается от компактной организации в цепочке полинуклеосом.
Более редко транскрибируемые гены наблюдаются в виде частично вытянутых структур, в которых все же сохраняются нуклеосомы. Очевидно, что при интенсивной транскрипции генов происходят существенные структурные изменения хроматина. В случае генов рРНК это проявляется в исчезновении нуклеосомной организации. Но, возможно, это исключительная ситуация. Наблюдаемое присутствие нуклеосом в умеренно транскрибируемых генах согласуется с предположением о том, что РНК-полимераза нарушает нуклеосомную структуру непосредственно в точке транскрипции, но сразу после этого гистоновый октамер снова связывает соответствующий участок ДНК, если только другая молекула РНК-полимеразы не воспрепятствует этому процессу.
