
- •Типы рестриктаз.
- •Молекулярная основа мутаций. Причины мутаций. Действие физических факторов
- •Молекулярная основа мутаций
- •Мутации концентрируются в горячих точках
- •Мутант ctgg ctgg ctgg ctgg
- •Частота мутирования
- •Причины мутаций
- •Репарация ошибок спаривания (mismatch)
- •Эксцизионная репарация оснований
- •Эксцизионная репарация нуклеотидов
- •Прямая репарация (обращение повреждений днк)
- •Специфические механизмы репарации днк
Практическое занятие № 4. Системы защиты ДНК у прокариот. Репарация повреждений ДНК.
Системы рестрикции и модификации
Молекулы ДНК осуществляют свои наследственные функции посредством репликации и транскрипции. В каждом из этих процессов участвует большое количество ферментов и белковых факторов, среди которых обязательно присутствие соответствующих ДНК- и РНК-полимераз. Кроме того, с молекулами ДНК взаимодействуют многочисленные ферменты, которые модифицируют ее структуру или репарируют (исправляют) возникающие в ней повреждения. Рассмотрение этих процессов очень важно с точки зрения проблемы сохранения целостности структуры ДНК в течение многочисленных поколений, поскольку сам по себе акт репликации, как бы точно он не функционировал, еще не гарантирует выполнение роли ДНК в ходе эволюции.
Как про- так и эукариоты содержат ферменты, метилирующие ДНК. В каждом бактериальном штамме присутствует один или несколько ферментов, которые катализируют характерные реакции, определяющие уникальный тип модификации их собственной ДНК. Именно поэтому бактерия способна отличить свою ДНК от любой вторгающейся «чужеродной» ДНК по типу ее модификации. Различия в характере модификации делают чужеродную ДНК чувствительной к действию бактериальных рестриктирующих ферментов, которые узнают отсутствие специфической модификации (метилирования) в определенных местах дезоксирибонуклеиновой кислоты и разрезают эту ДНК.
Системы модификации и рестрикции широко распространены у бактерий и их существование играет важную роль в защите своей собственной ДНК от загрязнения «чужими последовательностями».
Метилирование ДНК у эукариот также имеет место, но преследует другую цель: в частности степень метилирования определенных сайтов определяет степень функциональной активности тех или иных генов и метильная модификация не связана с рестрикцией немодифицированных сайтов.
Бактерии имеют несколько систем, защищающих ее ДНК от возможных повреждений, вызываемых действием внешних химических и физических факторов или ошибками репликации. Любое появляющееся отклонение от правильной двухцепочечной структуры ДНК узнается соответствующими репарирующими ферментными системами и исправляется. Изменения в структуре ДНК могут быть обусловлены точечными мутациями, делетированием или вставками коротких последовательностей, структурными изменениями, модифицирующими ДНК или связыванием двух оснований с образованием циклобутиловых (пиримидиновых) димеров.
Сайты мутаций узнаются специальными нуклеазами, которые вырезают поврежденные участки, ДНК-полимеразы синтезируют удаленные фрагменты и бреши соединяются лигазами. Все эти ферментные активности составляют основную репарирующую систему. Кроме того, существуют системы, исправляющие ошибки репликации. Впервые такие системы были обнаружены и описаны у мутантных штаммов E. coli. Оказалось, что такие системы существуют в норме и предназначены для исправления ошибок репликации, не улавливаемых корректирующей (3′5′)-экзонуклеазной активностью ДНК-полимераз. Эта система коррекции неправильного спаривания (mismatch proofreading system), называемая также системой исправления ошибок спаривания (mismatch repair system), отличается от других систем репарации ДНК тем, что она не зависит от присутствия в ДНК аномальных нуклеотидов (например, продуктов дезаминирования оснований, включения аналогов природных нуклеотидов, алкилированных производных или пиримидиновых димеров), которые должны быть распознаны и удалены с помощью ферментов репарации. Она выявляет деформации, возникающие на внешней стороне двойной спирали, которые появляются в результате плохой пригонки обычных, но не комплементарных оснований. Если бы эта корректирующая система просто узнавала ошибки спаривания в реплицированной ДНК и удаляла без разбора один из двух неправильно спарившихся нуклеотидов, то в половине случаев она сама делала бы ошибки, «исправляя» не вновь синтезированную дочернюю цепь, а исходную материнскую цепь так, что в среднем частота ошибок оставалась бы прежней. Очевидно, что для эффективной коррекции система должна уметь различать неправильно спаренные нуклеотиды, с одной стороны, и избирательно удалять такие нуклеотиды только из дочерней цепи, с другой стороны, тем самым устраняя именно ошибки репликации.
В клетках E. coli процесс узнавания связан с метилированием определенных остатков аденина в молекуле ДНК. Метильные группы присоединяются ко всем остаткам аденина исходной и дочерней цепей, входящих в состав последовательностей GATC, но метильные группы вводятся по остаткам аденина дочерней цепи не сразу, а спустя определенное время после включения в нее аденина. Таким образом, новые дочерние цепи отличаются от старых материнских тем, что только в них сразу за репликативной машиной могут находиться еще не метилированные последовательности GATC. Исправление неправильного спаривания осуществляется крупным мультиферментным комплексом, сканирующим каждую из двух цепей двойной спирали позади репликативной вилки. Этот комплекс удаляет неправильно присоединенные нуклеотиды, но делает это только после того, как на новой цепи обнаружится неметилированная последовательность GATC. Именно поэтому ошибочные нуклеотиды удаляются только из дочерней цепи, приводя к устранению ошибок репликации.
Типы рестриктаз.
Все рестрикционные эндонуклеазы бактерий узнают специфические, короткие последовательности в молекуле ДНК и связываются с ними. Процесс связывания рестриктаз с ДНК сопровождается ее разрезанием либо в точке связывания рестриктазы, либо в каком-то другом месте, которое зависит от типа рестриктазы.
Наряду с рестрикционной активностью бактериальные штаммы обладают способностью модифицировать ДНК посредством метилирования. Метилирование осуществляется так же специфично, как и узнавание мест связывания рестриктаз. Метилазы добавляют метильные группы к остаткам Ade или Cyt в том же сайте, в котором связывается соответствующая рестриктаза. В результате метилирования сайт становится устойчивым к рестрикции. Следовательно, метилирование защищает ДНК от разрезания.
Таким образом, уникальный способ метилирования препятствует деградации своей собственной ДНК под действием своих рестриктаз, однако этот способ защиты не распространяется на «чужую» ДНК. «Чужеродная» ДНК не имеет модифицированных метильными группами сайтов-мишеней и поэтому атакуется бактериальными ферментами рестрикции, что приводит к разрезанию такой «чужеродной» ДНК в соответствующих сайтах с последующей полной деградацией.
Системы модификации и рестрикции были открыты благодаря их действию на инфицирующую фаговую ДНК. Фаговая ДНК, имеющая одинаковый с клеткой-хозяином тип модификации, может успешно инфицировать другую бактериальную клетку того же штамма, т.к. обе клетки имеют одну и ту же систему модификации. Однако, если эта фаговая ДНК попадет в клетку другого штамма, она будет расщеплена рестриктазами. Следовательно, фаг ограничен (restricted) одним бактериальным штаммом, отсюда и появился термин рестрикция. Следует, однако, отметить, что рестрикция «чужеродной» ДНК не всегда неизбежно происходит. Некоторые инфицирующие фаги избегают расщепления их ДНК, что обусловлено либо мутациями в сайтах-мишенях рестрикции, либо недостаточно точным срабатыванием системы рестрикции клетки-хозяина. В таких случаях ДНК фага приобретает тип модификации нового хозяина.
Рассмотрим основные классы рестриктирующих эндонуклеаз и механизм их действия. Рестрикционные ферменты разделяются на два класса по механизму действия. В свою очередь, в пределах двух классов рестриктазы подразделяются на более мелкие группы – рестриктазы типа I, II и III.
Первый класс рестриктаз включает ферменты, проявляющие активности типа. Среди рестриктаз типа II наиболее полно изучена рестриктаза Eco RI. Данный фермент, как и другие рестриктазы, относящиеся к этому классу отвечает только за акт рестрикции; метилирование, узнаваемой рестриктазой последовательности ДНК осуществляет совсем иной фермент. Собственно рестриктаза Eco RI представляет собой димер, состоящий из двух идентичных субъединиц c молекулярной массой 31.000 дальтон. Исходя из гомодимерной структуры Eco RI можно было бы ожидать, что фермент действует симметрично на идентичные последовательности двух частей сайта узнавания и разрезает обе цепи одновременно. Однако на самом деле гидролиз происходит последовательно.
Были получены кристаллы комплекса Eco RI и олигонуклеотида 5′-TCGCGAATTCGCG-3′ и проведен их рентгеноструктурный анализ. Это позволило в деталях выяснить способ взаимодействия данного фермента с ДНК. В частности было показано, что между двумя остатками Arg и одним остатком Glu (в каждой из двух субъединиц), с одной стороны, и парами оснований в сайте узнавания – с другой, образуются водородные связи, в результате чего происходит частичное раскручивание В-ДНК, облегчающее последующее разрезание.
В качестве сайтов рестрикции для рестриктаз типа II часто выступают последовательности из 4-6 пар оснований, представляющие собой в ряде случаев палиндромы, которые обладают симметрией второго порядка и имеют также симметричную модификацию, под которой подразумевают метилирование соответствующих оснований в обеих цепях ДНК (см. табл. 12.1 в главе «Генная инженерия или техника рекомбинантных ДНК»).
Поэтому становится очевидным, что сайт-мишень может быть полностью метилирован (обе цепи молекулы ДНК модифицированы), полуметилирован (модифицирована только одна цепь) и неметилирован. Полностью метилированный сайт не подвержен ни рестрикции, ни модификации. Полуметилированный сайт не узнается рестриктазой, но может быть превращен под действием метилазы в полностью метилированный. Неметилированный сайт-мишень представляет собой субстрат для действия как рестриктазы, так и метилазы, и может быть либо разрезан, либо метилирован.
Поскольку репликация полностью метилированного сайта всегда дает полуметилированную ДНК, узнавание частично метилированных сайтов и добавление недостающих метильных групп является обычным свойством метилаз in vivo.
Большинство рестриктаз типа II разрезают ДНК в неметилированных сайтах, причем, некоторые ферменты вносят ступенчатые разрывы с образованием «липких» концов, тогда как другие рестриктазы II типа вызывают образование тупых концов. Характерными особенностями рестриктаз II типа являются, во-первых, совпадение сайта узнавания (посадки) и сайта рестрикции, а, во-вторых, полное разобщение рестриктирующей и метилирующей активностей.
Ко второму классу рестриктирующих активностей, характеризующих систему рестрикции и модификации отнесены активности ферментов типа и . Эти ферменты представляют собой мультимеры, выполняющие в бактериальной клетке как эндонуклеолитическую, так и метилирующую функции. Механизмы их действия отличны друг от друга и от механизмов действия ферментов типа . Точно не известно, у какой части бактерий функционируют системы типа или , однако очевидно, что они менее распространены, чем система типа .
К наиболее известным ферментам типа относятся рестриктазы Eco K и Eco B, выделенные из штаммов E.coli K и E.coli B, соответственно. На рис. 5.19, приведенном ниже, показано субъединичное строение полифункционального фермента типа. Данные олигомерные рестриктазы состоят из субъединиц трех разных типов – R-субъединицы ответственны за рестриктазную активность, субъединицы М принимают участие в процессе метилирования соответствующих сайтов, а субъединица S ответственна за узнавание сайта посадки рестриктазы в молекуле ДНК.
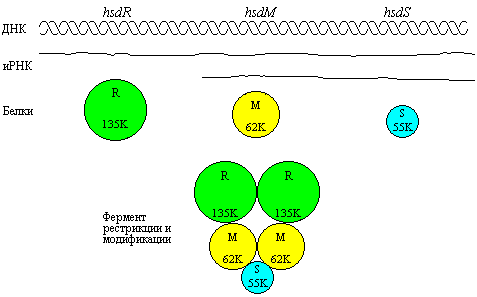
Рис. 5.19 |
Полифункциональные ферменты типа содержат различные субъединицы для рестрикции, модификации и узнавания (Lewin B., Genes III, New York, Wiley, 1987). |
После того как сайт посадки полифункционального фермента узнается S-субъединицей, происходит связывание фермента с ДНК, что сопровождается либо ее рестрикцией, либо модификацией; активности, проявляемые субъединицами R и М являются взаимоисключающими.
Рестриктаза Eco K имеет молекулярную массу около 400.000 дальтон. Она содержит две R-субъединицы (по 135.000 дальтон, каждая), две M-субъединицы (по 62.000 дальтон) и одну S-субъединицу (55.000 дальтон).
Рестриктаза Eco B состоит из субъединиц такого же размера, но их молярное соотношение в составе фермента может быть различным. Субъединицы M и S в соотношении 1:1 могут сформировать комплекс, который проявляет функцию метилирования независимо от рестриктазной активности. Данное явление легко объяснимо, поскольку три гена, кодирующие каждую из субъединиц, расположены в опероне в следующем порядке: P1 – hsdR – P2 – hsdM – hsdS, где Р1 и Р2 – независимые промоторы. Отсюда следует, что гены hsdM и hsdS могут экспрессироваться независимо от hsdR.
Сайты узнавания ферментов Eco B и Eco K - это структуры, состоящие из двух частей. В обоих случаях первая часть представлена специфической последовательностью из трех пар оснований, отделенной у фермента Eco B восемью парами, а у Eco K - шестью парами оснований от специфической последовательности из четырех пар оснований:
TGANNNNNNNNTGCT
ACTNNNNNNNNACGA
Как можно видеть, оба сайта узнавания несимметричны, однако каждый из них несет на каждой из цепей по одному остатку аденина для метилирования, как показано звездочками в последовательности сайта узнавания для фермента Eco B.
Будет ли данная ДНК разрезана или модифицирована, определяется состоянием сайта-мишени. Если сайт-мишень полностью метилирован, фермент может связаться с ним, но затем диссоциировать без проявления любой из своих активностей. Если мишень полуметилирована, фермент модифицирует неметилированную цепь; благодаря этому сохраняется состояние метилирования в ДНК клетки-хозяина. Если мишень не метилирована, ее узнавание приводит к реакции разрезания.
Источником метильных групп для модификации служит кофактор S-аденозилметионин (SАМ), который в ходе реакции превращается в S-аденозилгомоцистеин (SАН).

Механизм действия этих ферментов рестрикции-модификации сводится к их активации посредством связывания SAM с М-субъединицами. На начальной стадии реакции SAM действует как аллостерический эффектор, т.е. изменяет конформацию белка, обеспечивая его связывание с ДНК. Это конформационное изменение затрагивает S-субъединицу, ответственную как за узнавание сайта посадки в молекуле ДНК, так и непосредственно за процесс связывания. После взаимодействия фермента с ДНК, следует реакция с АТР.
Если фермент связался с полностью метилированным сайтом, в присутствии АТР происходит его отделение от ДНК.
В неметилированном сайте АТР индуцирует такую конформационную перестройку R-субъединиц, которая способствует разрезанию ДНК. Для процесса рестрикции необходим гидролиз АТР, при этом до акта разрезания ДНК от фермента отделяется кофактор SAM.
Роль АТР в случае частично метилированного сайта недостаточно ясна: в частично модифицированном сайте происходит метилирование с превращением SAM в SAH. Этот процесс идет и без АТР, но в его присутствии реакция идет более эффективно. Схема описанных выше трех процессов приведена на рис. 5.20.
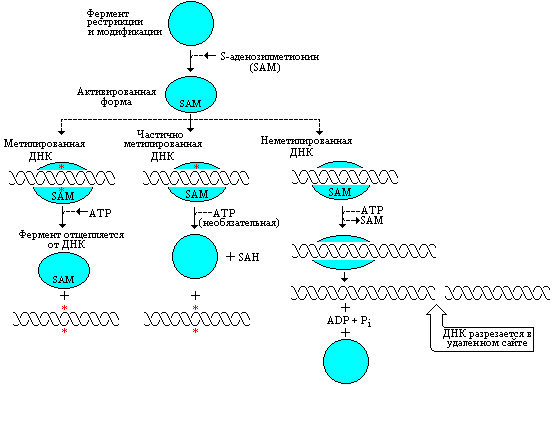
Рис. 5.20 |
Ферменты типа в присутствии SAM связываются с сайтами-мишенями, после чего они либо освобождаются из полностью метилированных сайтов, либо завершают модифицирование частично метилированных сайтов, либо двигаясь вдоль цепи ДНК от неметилированных сайтов, производят разрезание ДНК в каком-то удаленном участке (Lewin B., Genes III, New York, Wiley, 1987). |
Для сайтов узнавания и разрезания ферментов I типа характерны необычные взаимоотношения. Сайт разрезания может быть удален от сайта узнавания на расстоянии от 400 до 7.000 пар нуклеотидов (среднее расстояние составляет около 1.000 пар оснований). Разрезание производится не в специфической последовательности, но и не в случайном сайте: имеются области предпочтительные для событий рестрикции. Реакция разрезания протекает в две стадии. Сначала разрезается одна цепь ДНК, а затем рядом другая. В областях, прилегающих с каждой стороны к сайту разрезания, может происходить экзонуклеотическая деградация ДНК. При этом происходит эффективный гидролиз АТР, роль которого пока не выяснена.
Каким же образом фермент узнает один сайт, а разрезает другой, достаточно удаленный? Важно отметить, что белок никогда не отделяется от молекулы ДНК, с которой он первоначально связался. Следовательно, узнавая сайт связывания, белок не отделяется от неметилированной ДНК для того чтобы найти сайт разрезания. Существуют две альтернативные модели, объясняющие взаимосвязь между сайтами узнавания и разрезания: в соответствии с одной из них фермент движется по молекуле ДНК, согласно другой модели, перемещается ДНК. Предполагаемые схемы этих процессов представлены на рис. 5.21.
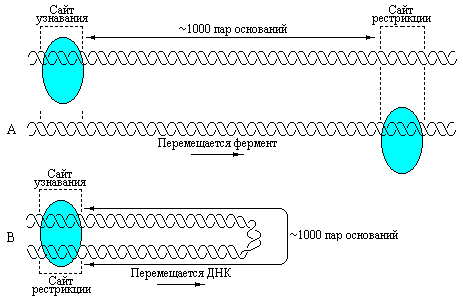
Рис. 5.21 |
Схема, показывающая возможные варианты взаимосвязи между сайтами узнавания и разрезания для ферментов типа . Одна модель предполагает перемещение рестриктазы вдоль ДНК от сайта узнавания к сайту рестрикции (А). В соответствии с другой моделью фермент остается связанным с сайтом узнавания, а ДНК протаскивается через центр рестрикции фермента (В) (Lewin B., Genes III, New York, Wiley, 1987). |
Если движется фермент, то его перемещение вдоль ДНК будет продолжаться до тех пор, пока он не сделает выбор сайта разрезания. Если же движется ДНК, то фермент остается прикрепленным в сайте узнавания, а ДНК протаскивается через второй активный центр на ферменте, и это продолжается до тех пор, пока область разрезания (еще не охарактеризованная) не попадет в этот центр. Полученные в самое последнее время электронно-микроскопические данные свидетельствуют, что фермент вызывает образование петли в ДНК и остается, по-видимому, связанным с сайтом узнавания, а это, в свою очередь, подтверждает вторую модель взаимосвязи сайтов узнавания и разрезания.
Наиболее детально изученными ферментами рестрикции и модификации типа III являются Eco P1 и Eco P15, кодируемые плазмидами Р1 и Р15 у Escherichia coli и Hin f, обнаруженный у Haemophilus influenzae серотипа Rf.
Каждый фермент состоит из субъединиц двух типов, а именно: R-субъединицы, ответственной за рестрикцию (молекулярная масса 106.000 – 110.000 дальтон) и субъединицы MS, ответственной как за узнавание, так и за модификацию (молекулярная масса 73.000 – 80.000 дальтон). У ферментов типа III рестрикционная и модифицирующая активности выражаются одновременно.
Сначала фермент присоединяется к своему сайту на ДНК (данное взаимодействие представляет собой АТР-зависимый процесс). Затем активности модификации и рестрикции начинают конкурировать друг с другом за вступление в реакцию с ДНК. Метилирование ДНК происходит в сайте посадки фермента, что согласуется с объединением двух функций – метилирования и узнавания в одной субъединице MS. Рестрикционное разрезание происходит на расстоянии 24-26 пар оснований от сайта узнавания. Рестрикция сводится к внесению ступенчатых разрезов с образованием «липких концов», имеющих уступы из 2-4 оснований.
Ферменты метилируют остатки аденина, однако сайты-мишени для Р1 и Р15 имеют загадочное свойство. Они могут быть метилированы только на одной цепи. Ниже приведены последовательности этих сайтов:
-
Р1
AGACC TCTGG
P15
СAGCAG
GTCGTC
Возникает закономерный вопрос, как сохраняется состояние метилирования после репликации. На рис. 5.22, приведенном ниже показано, что в процессе репликации формируется два типа сайтов.

Рис. 5.22 |
Репликация метилированной последовательности Р1 приводит к образованию метилированной и неметилированной реплик. |
Одна реплика содержит исходную метилированную цепь и фактически не отличима от родительской. Другая реплика полностью неметилирована и поэтому представляет собой последовательность-мишень для рестрикции или модификации. Чем объяснить, что из этих двух возможностей чаще реализуется вторая? Ответ на данный вопрос в настоящее время неизвестен. Однако, одно из возможных объяснений состоит в том, что реакция метилирования непосредственно связана с актом репликации. Достаточно вспомнить функционирование системы исправления ошибок спаривания при репликации.
