
- •Типы рестриктаз.
- •Молекулярная основа мутаций. Причины мутаций. Действие физических факторов
- •Молекулярная основа мутаций
- •Мутации концентрируются в горячих точках
- •Мутант ctgg ctgg ctgg ctgg
- •Частота мутирования
- •Причины мутаций
- •Репарация ошибок спаривания (mismatch)
- •Эксцизионная репарация оснований
- •Эксцизионная репарация нуклеотидов
- •Прямая репарация (обращение повреждений днк)
- •Специфические механизмы репарации днк
Причины мутаций
Точечные мутации, суть которых связана с заменами одной пары оснований на другую пару, могут быть вызваны самыми различными причинами. К числу наиболее известных и хорошо изученных факторов, вызывающих появление точечных мутаций относятся нижеследующие.
Ошибки репликации, не исправленные ДНК-полимеразой. Как известно, точность копирования в процессе репликации ДНК настолько велика, что в среднем на каждые 1 10 9 пар нуклеотидов приходится одна ошибка. Такую высокую точность репликации обеспечивает корректирующая (3′ 5′)-экзонуклеазная активность ДНК-полимеразы. Тем не менее, в ряде случаев ДНК-полимераза может ошибаться. Одной из причин таких ошибок является способность всех азотистых оснований образовывать термодинамически невыгодные таутомерные формы за счет миграции атома водорода. При этом амино- и оксогруппы превращаются в иминогруппы (=NH) и енольные группы (-ОН), соответственно. Такие редкие таутомерные формы, как правило, образуют неправильные, неканонические пары с другими основаниями. Примером может служить способность Cyt образовывать редкую таутомерную имино-форму, приведенную на рис 5.4.
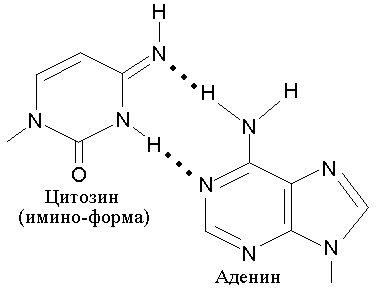
Рис. 5.4 |
Таутомерная имино-форма цитозина спаривается с неканоническим для нее аденином. |
Эта имино-форма Cyt образует пару не с Gua, а с Ade. В результате, в процессе последующей репликации, может произойти замена пары A-T на G-C. Точно также аденин способен образовывать редкую таутомерную имино-форму, которая приобретает способность комплементарно спариваться с неканоническим для него цитозином (рис. 5.5).
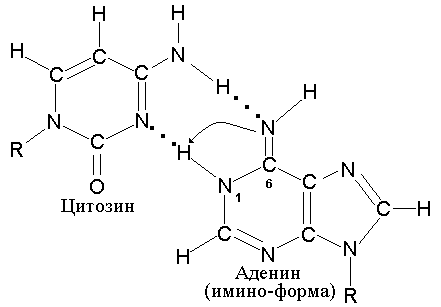
Рис. 5.5 |
Таутомерная имино-форма аденина спаривается с неканоническим для нее цитозином. |
Процессы спонтанного дезаминирования обычных и модифицированных оснований. В настоящее время хорошо известно, что некоторая часть оснований, входящих в состав ДНК как про-, так и эукариот метилируется пострепликативно особыми ферментами - метилазами. Цели метилирования у про- и эукариот различны, но эта модификация ДНК протекает достаточно интенсивно. Чаще всего метилированию подвергаются остатки Ade и Cyt. Ранее нами была рассмотрена схема, показывающая последовательность событий приводящих к возникновению транзиции G-C A-T вследствие спонтанного или индуцированного дезаминирования цитозина (рис. 5.1), а также причины существования горячих точек.
Например, если дезаминированию подвергается не цитозин, а 5-метилцитозин, то этот процесс приводит к образованию нормального для днк основания – тимина (Thy). Естественно, что в этом случае при повторной репликации возможна замена пары G-C на пару A-T. Было обнаружено, что процессы спонтанного дезаминирования происходят с определенной достаточно высокой скоростью, которая составляет 100 актов дезаминирования на один геном в сутки.
Процессы апуринизации ДНК. ДНК каждой клетки человеческого организма в результате апуринизации теряет в сутки около 5.000 пуриновых оснований (Ade и Gua) вследствие термального разрыва N-гликозидных связей между пуриновым основанием и дезоксирибозой. Удаление пиримидиновых оснований из ДНК в какой-либо ощутимой степени не происходит из-за того, что N-гликозидные связи пиримидинов с углеводной частью намного более стабильны, чем связь пурина с углеводом. На интенсивность процесса апуринизации ДНК могут влиять также различные химические факторы. Например, в кислой среде эффективность апуринизации ДНК существенно возрастает. Алкилирование гуанина под действием диметилсульфата приводит к образованию четвертичного азота в 7-ом положении этого азотистого основания, что ослабляет N-гликозидную связь с дезоксирибозой и высвобождает метильное производное гуанина, обеспечивая дополнительную потерю пуринов молекулами ДНК (рис. 5.6).
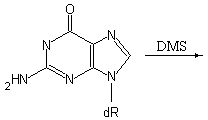
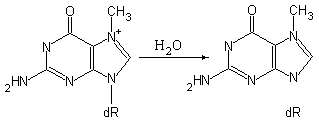
.
Рис. 5.6 |
Алкилирующий агент диметилсульфат метилирует остатки гуанина и ускоряет процесс апуринизации ДНК |
Повреждения ДНК, вызываемые действием химических факторов окружающей среды. Основания в составе ДНК весьма чувствительны к действию многочисленных химических соединений, распространенных в окружающей среде. Многие из них получили название ксенобиотиков, большинство которых имеет антропогенное техногенное происхождение. К разряду ксенобиотиков относятся многочисленные яды, лекарства, канцерогены, пестициды, инсектициды, гербициды и многие другие соединения. Среди эффектов различных соединений наиболее полно изучено воздействие азотистой кислоты (HNO2) (рис. 5.3), гидроксиламина (NH2OH) (рис.5.7), алкилирующих агентов, таких как диметилсульфат (рис. 5.6), N-метил-N/-нитро-N-нитрозогуанидин:

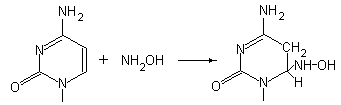
.
Рис. 5.7 |
Реакция цитозина с гидроксиламином |
Под действием азотистой кислоты, которая может образовываться из таких предшественников как NaNO2 - нитрит натрия, NaNO3 - нитрат натрия, а также органических соединений типа нитрозаминов
происходит активное дезаминирование Cyt с образованием Ura, Ade с образованием гипоксантина (Hyp) и Gua с образованием ксантина (Xan). В результате дезаминирования Cyt образуется, как уже известно, Ura, который комплементарно спаривается с Ade. В результате происходит транзиция G-C A-T.
С другой стороны, в результате дезаминирования Ade образуется Hyp, который приобретает способность спариваться с Cyt, вызывая транзицию A-T G-C. если события, касающиеся дезаминирования, произойдут в одном сайте, т.е. сначала дезаминированию подвергнется Cyt и произойдет образование A-T пары вместо G-C, а затем дезаминированию подвергнется появившийся Ade и произойдет обратная транзиция A-T G-C, то при этом последовательность ДНК восстановится.
Дезаминирование Gua в Xan не влияет на способность измененного основания образовывать пару с цитозином (Xan – Cyt).
Алкилирующие агенты могут воздействовать как на структуру оснований, так могут разрушать и фосфодиэфирные связи, приводя к фрагментированию цепей ДНК. Кроме того, некоторые алкилирующие агенты способны ковалентно взаимодействовать с обеими цепями ДНК, вызывая образование поперечных сшивок.
Кроме упомянутого выше диметилсульфата, к числу наиболее активных алкилирующих агентов относятся диметилнитрозамин и азотистый иприт:
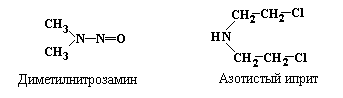
В результате воздействия алкилирующих (как метилирующих, так и этилирующих) агентов может происходить метилирование Gua по 7-положению, что приводит к образованию 7-метилгуанина (рис. 5.8), который впоследствие образует неканоническую пару с тимином. С тимином также может спариваться 7-этилгуанин.
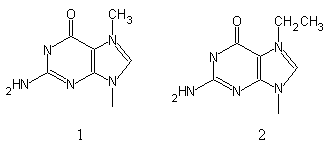
Рис. 5.8 |
Взаимодействие ДНК с метилирующими и этилирующими соединениями приводит к модификации остатков гуанина с образованием 7-метилгуанина (1) и 7-этилгуанина (2), соответственно. |
Образование неканонической пары между тимином и 7-этилгуанином показано на рис. 5.9.
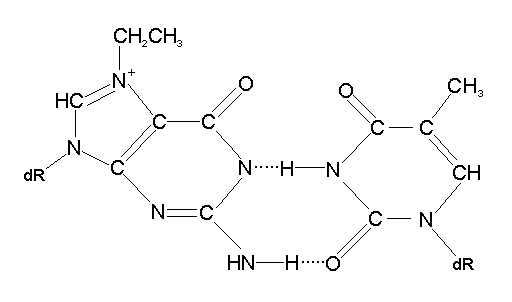
Рис. 5.9 |
Характер взаимодействия 7-этилгуанина и тимина. |
Кроме приведенных выше способов модификации гуанина, это азотистое основание может также метилироваться по гидроксильной группе енольной формы с образованием O6-метил-Gua, не способного образовывать нормальную комплементарную пару с Cyt. В свою очередь, метилирование аденина по аминогруппе приводит к образованию N6-метиладенина.
Ошибки ДНК-полимеразы, связанные с включением аналогов природных нуклеотидов. Одним из аналогов природных нуклеотидов, не выщепляемых ДНК-полимеразой является нуклеотид с азотистым основанием - 2-аминопурином (рис. 5.10), который встраивается в ДНК вместо Ade, но впоследствии спаривается с цитозином и тем самым способствует транзиции A-T G-C.
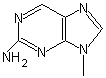
Рис. 5.10 |
Аналог аденина – 2-аминопурин, который после встраивания в ДНК вместо аденина образует пару с цитозином. |
Несмотря на высокую точность функционирования ДНК-полимераз при катализе репликации эти ферменты не всегда способны отличать нормальные дезоксирибонуклеозид трифосфатные субстраты от некоторых других нуклеотидов с очень похожей структурой. Следует отметить, что в случае 2-аминопурина ДНК-полимераза все же делает существенную ошибку, поскольку наличие NH2-группы во 2-ом или в 6-ом положениях пурина структурно является очень заметным. На рис. 5.11, приведенном ниже, представлена схема возникновения транзиции A-T G-C, инициируемая встраиванием 2-аминопурина.
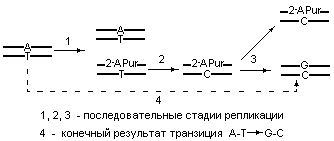
Рис. 5.11 |
Схема, отражающая механизм появления транзиции A-T G-C, вызванной ошибочным встраиванием 2-аминопурина. |
Другой пример таких структурных аналогов природных нуклеозидтрифосфатов – 5-Br-dUTP (5-Br-дезоксиуридинтрифосфат), который является аналогом тимидинтрифосфата из-за присутствия атома Br в 5-положении урацила, где у тимина находится CH3-группа. Первоначально 5-галоидпроизводные урацила были синтезированы как аналоги тимина с целью их возможного применения в качестве цитостатиков или противовирусных средств. В частности цитостатические эффекты 5-Br-dUrd сводятся к эффективному фосфорилированию данного аналога тимидина под действием тимидинкиназы поврежденной клетки и встраиванию этого модифицированного нуклеотида в ДНК. В результате последующего облучения клеток ультрафиолетовым светом встроенный 5-Br-Ura принимает участие в образовании большого числа пиримидиновых димеров и поперечных сшивок в ДНК, что практически полностью блокирует возможность репликации или транскрипции ДНК. Ситуация с 5-Br–dUrd, как соединением способным инициировать транзиции, менее однозначна, чем в случае 2-аминопурина. Дело в том, что 5-Br-dUrd может образовывать кето- и енольную формы. Минорная енольная форма 5-Br-Ura (рис. 5.12) возникает чаще, чем такая же форма тимина, из-за большей электроотрицательности Br по сравнению CH3-группой тимина.
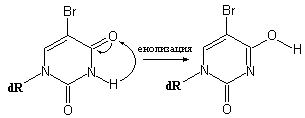
Рис. 5.12 |
Высокая электроотрицательность атома Br вызывает смещение равновесия процесса таутомеризации в сторону образования енольной формы 5-Br-dUrd. |
Поэтому, более часто образуемая енольная форма 5-Br-Ura имеет тенденцию спариваться с Gua, что приводит к транзиции A-T G-C. в норме же, кето-форма 5-Br-Ura, являющегося аналогом тимина спаривается с Ade (рис. 5.13).

Рис. 5.13 |
В норме кето-форма 5-Br-Ura образует пару с аденином (А). В результате таутомеризации, образующаяся енольная форма 5-Br-Ura изменяет характер спаривания и взаимодействует с гуанином (В). |
Схема, иллюстрирующая последовательность этапов приводящих к транзиции A-T G-C, вызванной енолизацией встроенного в ДНК 5-Br-Ura показана на рис. 5.14.
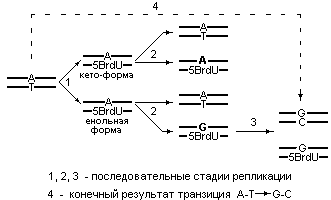
Рис. 5.14 |
Схема появления транзиции A-T G-C, вызванной енолизацией встроенного в ДНК 5-Br-Urа. |
Явление интеркаляции. Некоторые органические соединения, которые характеризуются плоской ароматической структурой с соответствующей геометрией и размерами могут встраиваться в ДНК между парами оснований - интеркалировать. В результате интеркаляции, эти соединения вызывают появление вставок или делеций одной или более пар оснований и тем самым приводят к изменению рамки считывания, если только вставки и делеции не кратны трем парам оснований. К таким интеркалирующим соединениям относятся акридины и этидий бромид (рис. 5.15).
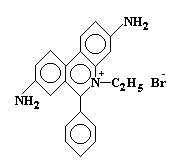
Рис. 5.15 |
Этидий бромид способен интеркалировать в двойную спираль ДНК. |
Рентгеноструктурный анализ комплексов таких соединений с синтетическими двухцепочечными олигонуклеотидами показывает, что плоские ароматические кольца акридиновых красителей внедряются между парами оснований двойной спирали. Механизм внедрения предполагает проникновение молекулы красителя между парами оснований в момент возникновения локального нарушения структуры, при этом водородные связи между парами оснований сохраняются, тогда как «стэкинг»- взаимодействия нарушаются.
Одним из вариантов такого нарушения структуры ДНК вследствие интеркаляции акридиновых красителей или этидий бромида является образование изломов двойной спирали в молекуле ДНК, которые получили название кинков.
Химический канцерогенез. В настоящее время многие эксперты считают, что в подавляющем большинстве случаев заболевание раком инициируется воздействием на нуклеиновые кислоты определенных химических соединений. Канцерогенные вещества поступают в окружающую среду не только благодаря синтезу и использованию новых химических соединений в промышленных масштабах. Канцерогенами являются также многие соединения естественного происхождения. Например, известными канцерогенами являются афлатоксины, продуцируемые некоторыми плесневыми грибками. Несмотря на то, что интенсивное изучение микотоксинов началось сравнительно недавно, к настоящему времени уже описано более 300 таких соединений, относящихся к 25 различным типам. Даже в небольших дозах микотоксины оказывают разнообразные токсические эффекты на человека и животных, приводят к деградации печени, геморрагии и карциноме. В качестве главных по опасности микотоксинов сейчас рассматривают группу метаболитов гриба Aspergillus flavus – афлатоксинов, из которых наиболее коварны афлатоксин В1 и продукт его метаболического гидроксилирования в организме коровы, проникающий в молоко – афлатоксин М1 (рис. 5.16). Доказано, что эти соединения являются причиной цирроза и рака печени у людей. Механизм действия афлатоксинов состоит в том, что они после 15,16-эпоксидирования с участием печеночного цитохрома Р-450 ковалентно связываются с РНК, блокируя синтез белка.

Рис. 5.16 |
Метаболическая активация афлатоксина В1. На первой стадии происходит гидроксилирование афлатоксина В1 с образованием афлатоксина М1, который на второй стадии активации превращается в 15,16-эпоксид. Обе реакции катализируются цитохромом Р-450. |
К другой группе канцерогенов, имеющих естественное происхождение, относятся такие соединения, как бензпирен и бензантрацен, являющиеся постоянными компонентами табачного дыма, а также копченых продуктов питания и продуктов приготовляемых на углях. Хорошо известно, что некоторые канцерогены характеризуются непосредственным воздействием на нуклеиновые кислоты, тогда как другие (бензпирен и бензантрацен сами по себе являются слабыми канцерогенами) прежде, чем стать канцерогенными, должны пройти стадию активации посредством гидроксилирования и эпоксидирования с участием монооксигеназных систем печени. Ферменты, которые катализируют активацию канцерогенов, принадлежат к семейству цитохромов P-450. Как было показано, конечным продуктом активации бензпирена является вещество обладающее мощным канцерогенным действием на человека и животных и сильнейшим мутагенным эффектом на бактериальные клетки. Это соединение представляет собой 7,8-дигидродиол-9,10-эпоксид бензпирена. Схема реакций, приводящих к метаболической активации бензпирена приведена на рис. 5.17.
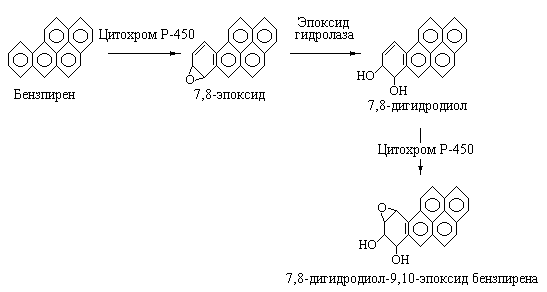
Рис. 5.17 |
Метаболическая активация бензпирена с участием печеночной монооксигеназной системы, содержащей в качестве терминальной оксидазы цитохром Р-450. |
На первой стадии в описываемой последовательности реакций бензпирен под действием цитохрома Р-450 превращается в 7,8-эпоксид, который далее с участием эпоксидгидролазы присоединяет воду с образованием 7,8-дигидродиола бензпирена. На последней стадии, катализируемой также цитохромом Р-450 образуется конечное соединение 7,8-дигидродиол-9,10-эпоксид бензпирена.
Следует иметь в виду, что цитохромы P-450 обладают уникальной способностью индуцироваться неканцерогенными соединениями, такими как этанол. Следовательно, алкоголь может в значительной степени увеличивать потенциальный риск рака в результате воздействия канцерогенов.
Мутагенное действие физических факторов (X-лучи, УФ-, -излучение). Как ультрафиолетовое, так и рентгеновское излучения являются сильнейшими мутагенными средствами. Нормальные основания, входящие в состав ДНК, представлены, как известно, в виде кето- и амино-форм, находящихся в равновесии с очень небольшими количествами минорных енольной и имино-форм. Энергия УФ и X-лучей сдвигает это равновесие в сторону образования минорных таутомерных форм. В результате чего повышенное содержание редких таутомерных форм Ade и Cyt увеличивает частоту их спаривания с Cyt и Ade, соответственно (рис. 5.4 и 5.5). Считают, что повышенное количество енольных форм оснований в момент репликации значительно повышает частоту мутаций в новосинтезируемых цепях ДНК.
Действие на ДНК жесткого излучения типа рентгеновских лучей и -излучения может приводить к изменению структуры оснований. Результатом такого воздействия может быть раскрытие гетероциклов, разрушение фосфодиэфирных связей. В присутствии кислорода накапливается большое количество продуктов окисления азотистых оснований и остатков дезоксирибозы.
При воздействии УФ-света, кроме сдвига равновесия в сторону образования минорных таутомерных форм оснований происходит также появление, в первую очередь, тиминовых димеров (рис. 5.18), хотя в принципе возможно образование ковалентно сшитых пар не только T-T, но также T-C и C-C.

Рис. 5.18 |
Структура тиминового димера, образованного двумя соседними остатками тимина под действием УФ-света. Обращает на себя внимание наличие ковалентных связей между тиминами, что дает основание называть их также циклобутиловыми димерами.
|
