
- •Типы рестриктаз.
- •Молекулярная основа мутаций. Причины мутаций. Действие физических факторов
- •Молекулярная основа мутаций
- •Мутации концентрируются в горячих точках
- •Мутант ctgg ctgg ctgg ctgg
- •Частота мутирования
- •Причины мутаций
- •Репарация ошибок спаривания (mismatch)
- •Эксцизионная репарация оснований
- •Эксцизионная репарация нуклеотидов
- •Прямая репарация (обращение повреждений днк)
- •Специфические механизмы репарации днк
Репарация ошибок спаривания (mismatch)
Система коррекции редко встречающихся несоответствий спаривания оснований остающихся после репликации ДНК E. coli «увеличивает общую точность» копирования данной информационной молекулы на величину, равную 102 – 103. При этом, учитывая, что в результате репликации в дочерних двухцепочечных ДНК могут появляться неканонические пары оснований, данная система репарации должна уметь отличать присутствие «правильного» основания в материнской цепи от неканонического «неправильного» таутомерного основания в новосинтезированной дочерней цепи. Для этого клетка использует особый принцип мечения исходной материнской цепи путем ее метилирования по отдельным основаниям. Система репарации ошибочного спаривания оснований у E. coli состоит, по крайней мере, из 12 различных белков, которые включаются как в процесс распознавания матричной цепи, так и в процесс самой репарации.
Механизм распознавания матричной и новосинтезированной цепей ДНК не известен у большинства бактерий и, тем более, у эукариот, однако, достаточно неплохо охарактеризован у E. coli и некоторых родственных ей микроорганизмов. Так, у E. coli в процессе распознавания цепей в дочерней ДНК принимает участие, уже известная, Dam-метилаза, которая метилирует остатки аденина по N6-положению во всех последовательностях (5/)GATC. Cразу после прохождения репликативной вилки имеется малый промежуток времени (от нескольких секунд до нескольких минут) в течение которого последовательности (5/)GATC в исходных материнских цепях метилированы, в то время как в дочерних цепях метилирование отсутствует. Преходящее неметилированное состояние последовательностей GATC в новосинтезированных цепях дает возможность клетке отличать их от материнских цепей в реплицированной молекуле ДНК. Затем ошибки репликации присутствующие поблизости от полуметилированного сайта GATC репарируются только в новосинтезированных цепях на основании того, что в родительской цепи указанная последовательность метилирована. Дополнительные эксперименты, проведенные in vitro, показали, что при наличии метилированных последовательностей GATC в обеих цепях реплицированной ДНК система коррекции несоответствий спаривания может исправить лишь незначительное количество таких ошибок. При отсутствии метилирования последовательностей GATC в обеих цепях процесс репарации осуществляется, но указанная система коррекции не отдавая предпочтения ни одной из двух цепей, сама делает при этом в половине случаев ошибки.
Клеточная система репарации несоответствий спаривания, функционирование которой зависит от степени метилирования ДНК, может исправлять указанные повреждения даже расположенные на расстоянии до 1.000 пар оснований от полуметилированной последовательности GATC.
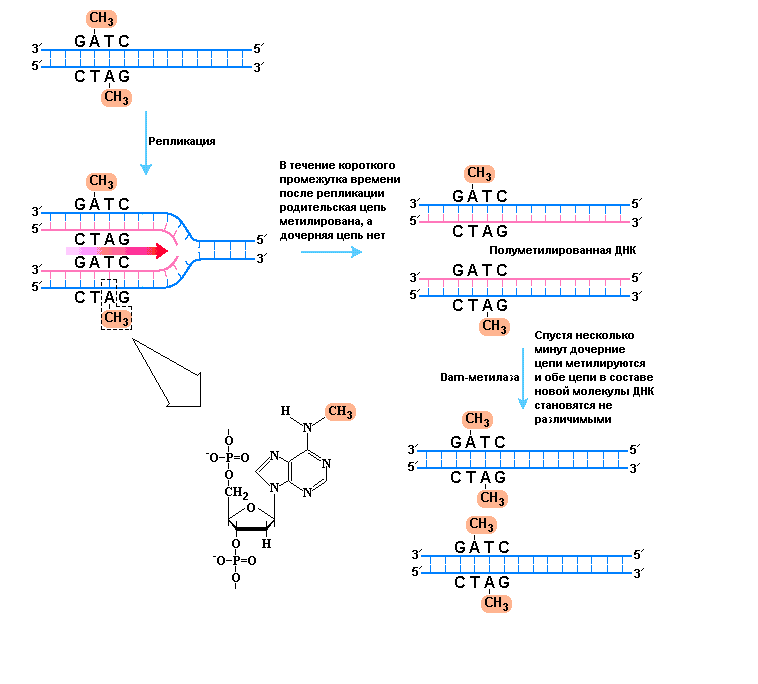
Рис. 1 |
Метилирование и коррекция несоответствий спаривания (ошибок репликации). Процесс метилирования позволяет клеткам E. coli различать родительские и дочерние цепи в реплицированной ДНК, что крайне необходимо для исправления редко возникающих ошибок функционирования ДНК-полимеразы III. Метилирование происходит по положениям N6 аденинов в последовательностях (5/)GATC присутствующих в обеих цепях ДНК в противоположной ориентации. |
Каким же образом процесс коррекции «плохой подгонки пар оснований» направляется последовательностями GATC, расположенными на достаточно большом расстоянии? Механизм данного процесса иллюстрирует схема, приведенная на рис. 2.
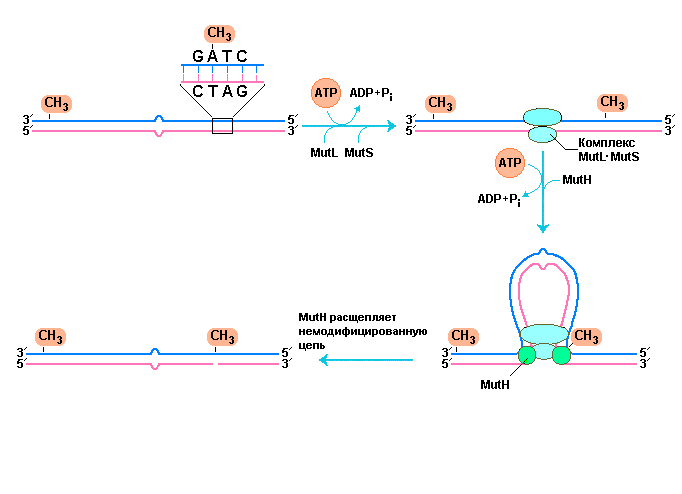
Рис. 2 |
Схема, иллюстрирующая ранние стадии процесса репарации несоответствий спаривания зависящей от характера метилирования ДНК. Узнавание последовательности GATC и сайта содержащего неправильно спаренное основание осуществляется белками MutН и MutS, соответственно. Белок MutL образует двойной комплекс с белком MutS в точке включающей неправильно спаренное основание. Сегменты ДНК расположенные по обе стороны поврежденного сайта начинают протягиваться через двойной комплекс так, что фактически имитируют одновременное движение этого комплекса вдоль ДНК в двух направлениях до тех пор, пока не натолкнутся на белок MutН связанный с полуметилированной следовательностью GATC. MutН расщепляет неметилированную цепь ДНК на 5/-стороне гуанинового нуклеотида (G) последовательности GATC. |
Как следует из рисунка, белок MutL образует комплекс с другим белком – MutS и данный двойной комплекс связывается со всеми неправильно спаренными основаниями (кроме пар С-С). В свою очередь, белок MutH взаимодействует с белком MutL и последовательностями GATC, на которые наталкивается комплекс MutL-MutS. Участки ДНК расположенные по обе стороны от обнаруженного повреждения «протягиваются» через комплекс MutL-MutS образуя петлю. В целом, синхронное продвижение через указанный комплекс белков участков ДНК прилегающих к образованной петле равносильно одновременному движению таких комплексов вдоль ДНК в противоположных направлениях. Характерная особенность белка MutH состоит в том, что он обладает сайт-специфической эндонуклеазной активностью, которая проявляется только тогда, когда весь тройной комплекс наталкивается на полуметилированный сайт GATC. В этом сайте MutH катализирует эндонуклеолитическое расщепление неметилированной цепи ДНК с 5/-стороны гуанинового нуклеотида (G) последовательности GATC, которая метит цепь, подлежащую исправлению. Дальнейшие этапы репарации зависят от местоположения неправильно спаренных оснований относительно сайта расщепления (рис. 3).

Рис. 3 |
Завершающие стадии репарации неправильно спаренных оснований в ДНК. Комбинированное действие ДНК-геликазы II, SSB-белков и одной из четырех различных экзонуклеаз обеспечивает удаление сегмента ДНК из новосинтезированной цепи, который расположен между сайтом расщепления под действием MutH и сайтом локализованным сразу за неправильно спаренным основанием. Природа используемой экзонуклеазы зависит от положения сайта расщепления относительно неправильно спаренного основания. Образующийся в результате действия указанных выше ферментов пробел «заполняется» с участием ДНК-полимеразы III и брешь «зашивается» ДНК-лигазой. |
Если неправильно спаренное основание находится на 5/-стороне сайта расщепления, неметилированная цепь ДНК выплетается из двойной спирали и разрушается в направлении 3/5/ от сайта расщепления, проходя через поврежденное основание. Утраченный сегмент ДНК замещается новым участком. Описанный процесс зависит от согласованного действия многих ферментов и вспомогательных белков: ДНК-геликазы II, SSB-белков, экзонуклеазы I или экзонуклеазы Х (оба фермента расщепляют цепи ДНК в направлении 3/5/), ДНК-полимеразы III и ДНК-лигазы. Способ репарации неправильно спаренного основания расположенного на 3/-стороне сайта расщепления напоминает описанный выше процесс за исключением необходимости участия другого набора экзонуклеаз. В этом случае поврежденный участок ДНК удаляется с помощью экзонуклеазы VII (способной деградировать одноцепочечную ДНК как в направлении 3/5/, так и в направлении 5/3/) или нуклеазы RecJ (деградирующей одноцепочечную ДНК в направлении 5/3/).
Репарация неправильно спаренных оснований является весьма дорогостоящим процессом для клеток E. coli в смысле энергетических затрат. Как указывалось выше, неправильно спаренное основание может находиться на расстоянии в 1.000 или даже более пар оснований от последовательности GATC. Деградация и последующая замена одноцепочечного участка ДНК такой длины требует огромного расходования активированных предшественников дезоксирибонуклеотидов для репарации всего одного единственного неправильно спаренного основания. Приведенные рассуждения еще раз подчеркивают чрезвычайную важность сохранения целостности генома в клетке.
Системы коррекции несоответствий спаривания оснований остающихся после репликации ДНК также функционируют в клетках эукариотических организмов. При этом во всех эукариотических клетках обнаруживаются особые белки структурно и функционально аналогичные бактериальным белкам MutS и MutL (но не белку MutН). Мутации в генах человека, кодирующих белки аналогичного типа, служат причиной врожденной предрасположенности к развитию ряда общеизвестных злокачественных новообразований, еще раз подчеркивая огромное значение систем репарации ДНК для любого организма. Основными гомологами бактериального белка MutS у большинства эукариот, от дрожжей до человека, являются MSH2 (MutS homolog 2), MSH3 и MSH6. В ходе репарации гетеродимеры белков MSH2 и MSH6, как правило, связываются с одним единственным неправильно спаренным основанием или, менее прочно и реже с несколько более протяженным участком ДНК, содержащим петлю, образование которой обусловлено присутствием нескольких неправильно спаренных оснований. В основном же более протяженные участки поврежденной ДНК, включающие от 2 до 6 неправильно спаренных оснований, узнаются гетеродимерами белков MSH2 и MSH3, или узнаются как димерами MSH2-MSH3, так и димерами MSH2-MSH6. При этом комплексы MSH стабилизируются путем связывания гомолога бактериального белка MutL, который представлен, главным образом, в виде гетеродимера, состоящего из белка MLH1 и белка PMS1 (название которого происходит от post-meiotic segregation). Более тонкие детали функционирования системы коррекции неправильно спаренных оснований у эукариот по-прежнему остаются предметом исследования. В частности, до сих пор неизвестно каким образом данная система репарации отличает дочернюю цепь ДНК от материнской, хотя уже установлено, что идентификация новосинтезированной цепи ДНК у эукариот не связана с последовательностью GATC.
